
- •Введение
- •1 Особенности дисциплины «Процессы и аппараты пищевых производств», ее связь с другими дисциплинами
- •2 История создания и развития курса. Роль российских ученых в его формировании
- •1 Основные положения и научные основы дисциплины
- •1.1 Основные понятия и определения.
- •1.2 Классификация процессов пищевых производств
- •1.3 Закон сохранения массы и энергии. Энергетический и материальный балансы
- •1.4 Законы переноса массы и энергии. Принцип движущей силы
- •1.5 Законы равновесия и принцип оптимизации процессов
- •1.6 Моделирование процессов и аппаратов
- •1.7 Метод анализа размерностей
- •2 Гидромеханические процессы
- •2.1 Основные определения и основы гидравлики
- •2.2 Дифференциальное уравнение равновесия Эйлера
- •2.3 Основное уравнение гидростатики
- •2.4 Некоторые практические приложения основного уравнения гидростатики
- •2.5 Основные задачи гидродинамики
- •2.6 Классификация неоднородных систем и методы их разделения
- •2.7 Материальный баланс процесса разделения
- •2.8 Осаждение в поле сил тяжести (отстаивание)
- •2.9 Осаждение под действием центробежной силы
- •2.10 Основные закономерности осаждения в центробежном поле
- •2.11 Фильтрование
- •2.12. Основы мембранных технологий
- •2.12.2. Методы создания полупроницаемых мембран
- •2.12.3. Схемы аппаратов разделения на полупроницаемых мембранах
- •2.12.4. Технологические расчеты мембранных аппаратов
- •2.13 Общая характеристика процессов перемешивания и смешивания
- •2.14. Перемешивание в жидкой среде
- •2.15 Перемешивание и смешивание сыпучих и пластических материалов
- •2.16 Псевдоожижение (кипящий слой)
- •3 Механические процессы
- •3.1 Измельчение твердых материалов
- •3.1.5.Измельчение в воздушном потоке
- •3.1.5.1. Действие воздушного потока на измельчаемый материал
- •3.1.5.2. Измельчение в струйной мельнице
- •3.1.5.3 Действие воздушных потоков при измельчении в роторной мельнице с зубчатоподобным зацеплением
- •3.2 Сепарирование
- •4 Тепловые процессы
- •4.1 Основы теплообмена в пищевой аппаратуре
- •4.2 Тепловые балансы
- •4.3 Основное уравнение теплопередачи
- •4.5. Теплопередача через цилиндрическую стенку.
- •4.7. Уравнение теплопередачи при прямотоке и противотоке теплоносителей.
- •4.8. Определение температуры стенок.
- •4.9. Нагревание, охлаждение пастеризация и стерилизация.
- •4.10. Выпаривание
- •4.11.Конденсация.
- •5. Массообменные процессы
- •5.1. Классификация и краткая характеристика процессов массообмена.
- •5.2.Сушка пищевых продуктов
- •5.2.1.Свойства влажного воздуха
- •5.2.1.Увлажнение продукта в негерметичной упаковке
- •5.2.3.Формы связи влаги с материалом
- •5.2.4.Показатели влажности материала.
- •5.2.4. Процесс сушки
- •5.3.Сушильное оборудование
- •5.3.1.Способы сушки, реализуемые в сушилках
- •5.3.2.Устройство сушилок
- •Эксплуатационные показатели барабанных сушилок
2.12. Основы мембранных технологий
2.12.1 Теоретические основы процесса разделение продуктов на полупроницаемых мембранах.
Мембранные технологии особенно эффективны при концентрировании, очистке и фракционировании растворов и жидких пищевых продуктов (пива, вина, продуктов молочного производства и др.), при очистке воздуха или создании регулируемых газовых сред для хранения сельскохозяйственной продукции и др. Используют мембранные технологии и при выделении ценных или опасных веществ из растворов.
Уменьшение размера пор в мембранах придает им способность задерживать все более мелкие частицы, но приводит и к необходимости повышать давление перед ними. По этому признаку мембранные технологии разделяют на четыре основные группы:
1) классическая фильтрация (диаметр пор превышает 10 мкм, а перепад давлений на перегородке не более 0,06 МПа);
2) микрофильтрация (диаметр пор 0,1...10 мкм, перепад давлений 0,06...0,1 МПа);
3) ультрафильтрация (диаметр пор 3... 100 нм, перепад давлений 0,1...2,0 МПа);
4) обратный осмос (диаметр пор менее 3 нм, перепад давлений 1...25 МПа).
Из этих групп процессов непосредственно к мембранным технологиям относятся обратный осмос и ультрафильтрация.
Обратный осмос обычно применяют для опреснения соленых и очистки сточных вод, для концентрирования растворов отделением от них растворителя и др. При опреснении морской воды, концентрация солей в которой достигает 35 % их растворимости, осмотическое давление приближается к 2,5 МПа, а рабочее давление перед мембранами - к 8 МПа.
Ультрафильтрацию используют для разделения, концентрирования или фракционирования растворов. Такое разделение имеет место при очистке сточных вод, крови, вакцин, обезвоживании сиропов, соков, экстрактов, при фильтровании микроорганизмов, бактерий, спор и др. При ультрафильтрации исходный раствор разделяется на два продукта - низкомолекулярный фильтрат и высокомолекулярный осадок. В частности, ультрафильтрацией могут быть выделены частицы жира или белка из молока и продуктов его переработки.
Рассмотрим сущность осмоса подробнее. Пусть некий сосуд разделяется на две части полностью проницаемой мембраной. По одну сторону от мембраны налит раствор соли, а по другую - чистый растворитель. Это соответствует тому, что по одну сторону от мембраны реализована повышенная концентрация растворенного вещества, а по другую - повышенная концентрация растворителя. Вследствие того, что мембрана полностью проницаема, начнутся два диффузионных процесса. В сторону от раствора к растворителю потечет диффузионный поток растворенного вещества, а в противоположную сторону - диффузионный поток растворителя. Такой процесс в целом называют встречной диффузией. Он продолжается до полного выравнивания концентраций растворенного вещества в обеих частях сосуда.
Заменим мембрану на полупроницаемую. Полупроницаемой называют мелкопористую мембрану, пропускающую через свои поры растворитель и задерживающую растворенное вещество.
При замене полностью проницаемой мембраны полупроницаемой, например, путем уменьшения размеров пор в ней, диффузия растворенного вещества окажется невозможной и прекратится. В результате будет идти только один диффузионный процесс - перетекание растворителя в сосуд с растворенным веществом. Вследствие этого количество растворенного вещества в части сосуда, содержащей раствор, будет увеличиваться, уровень жидкости в ней будет возрастать, а вместе с ней будет возрастать и гидростатическое давление. Этот появившийся избыток давления в растворе называют осмотическим давлением.
Явление
осмоса иллюстрируется классическим
опытом, выполняемым с помощью прибора,
изображенного на рисунке 2.7. В этом опыте
сосуд с высокой пьезометрической
трубкой, пористая часть которого закрыта
полупроницаемой мембраной, размещен в
другом сосуде. В сосуде с мембраной
находится раствор, а в охватывающем
его сосуде - растворитель. В результате
осмоса давление во внутреннем сосуде
повышается, а величина этого повышения
может быть измерена высотой столба
жидкости h
в пьезометрической трубке. Гидростатическое
давление (Па) равно в данном случае
осмотическому
![]() (Па):
(Па):
![]()
где
![]() -плотность
раствора, кг/м3; g-ускорение
свободного падения; g
=9,81 м/с2.
-плотность
раствора, кг/м3; g-ускорение
свободного падения; g
=9,81 м/с2.
Осмос - это одна из причин, вызывающих подъем растворов по стеблю растения (они поднимаются так же, как раствор в пьезометрической трубке, см. рис. 2.7.), обеспечивающих питание клеток, упругость клеток и листьев растений.
В соответствии с законами гидравлики осмотическое давление вызывает течение растворителя через пористую мембрану в сторону сосуда с раствором. По мере его разбавления растворителем осмотическое давление уменьшается. Именно поэтому концентрация внутриклеточного раствора в высоких растениях должна быть больше, чем в низких.
Если
в этой же системе мы захотим фильтровать
раствор путем организации перетекания
растворителя в сосуд с ним, необходимо
создать в сосуде с раствором давление
р, превосходящее
осмотическое на величину![]() :
:
![]() .
.
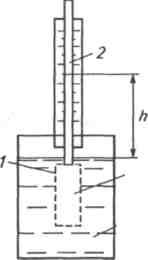
Раствор
Растворитель
Рис. 2.7. Схема прибора для иллюстрации явления осмоса и измерения осмотического давления:
1-пористый сосуд с полупроницаемой мембраной на стенках; 2-пьезометрическая трубка
Под действием разности давлений происходит разделение раствора на полупроницаемой мембране. Такой процесс называют обратным осмосом.
Вследствие высокого значения осмотического давления для разделения растворов необходимы относительно высокие давления.
Осмотическое давление зависит от концентрации раствора и его температуры, но не зависит, от природы растворенного вещества и растворителя. Голландский физикохимик Вант-Гофф показал, что для растворов неэлектролитов невысоких концентраций зависимость осмотического давления (Па) от концентрации и температуры выражается уравнением
![]()
где С- мольно-объемная концентрация раствора (молярностъ), моль/м3; R- универсальная газовая постоянная, Дж/(моль К); R=8,314кДж/(моль К); Т- абсолютная температура, К.
Как правило, оценку осмотического давления по этой формуле применяют для любых растворов, признавая ее приближенность.
Молярность раствора С - это отношение числа молей растворенного вещества п к объему раствора V (м3). Число молей растворенного вещества равно его массе m (кг), деленной на массу одного грамм-моля М (кг/моль), т. е.
![]()
С учетом последнего выражения формула для осмотического давления принимает вид
![]()
Осмотическое давление, реализующееся в жидкости, подчиняется зависимости, характерной для идеальных газов, т. е. зависимости, совпадающей с уравнением состояния идеальных газов: Клапейрона-Менделеева. Это можно интерпретировать так, что редко распределенные в жидкости молекулы растворенного вещества обладают свойствами газа, т. е. такими же свойствами, как молекулы этого вещества, редко распределенные в газовой среде. Парциальное давление такого газа как раз и является осмотическим.
Осмотическое давление может достигать больших значений. Предельно высокие его значения соответствуют предельно высоким концентрациям растворов. Для их оценки используем следующие данные.
Для поваренной соли NaCl растворимость (предельная концентрация) в воде при 50° С (338 К) составляет 370 кг/м3, а молекулярная масса М= 58,5 кг/моль. При этих данных получим
![]()
Хотя такая величина осмотического давления относительно высока, в реальных условиях она уменьшается вследствие меньших фактических концентраций растворов. Кроме того, данная оценка имеет погрешность, вызванную невыполнением условий Вант-Гоффа, принятых при выводе расчетного выражения.
На основании оценок осмотического давления можно утверждать также, что по мере повышения концентрации раствора при его разделении на полупроницаемой мембране производительность процесса заметно уменьшается. Несмотря на это, разделение на мембранах - энергетически выгодный процесс. Так, при опреснении воды методом разделения на мембранах затраты энергии составляют около 13 МДж/м3, методом вымораживания - 28, методом выпаривания - 30 МДж/м3.
