- •IV. Ферменты – регуляторы биологических процессов
- •§4.1. Классификация ферментов
- •§4.2. Структура ферментов
- •4.2.1. Первичная, вторичная и третичная структуры
- •4.2.2. Активный центр
- •4.2.3. Кофакторы
- •§4.3. Ферментативный катализ
- •4.3.1. Общая схема механизма химических реакций.
- •4.3.2. Скорость некаталитических реакций
- •4.3.3. Химический катализ. Катализаторы
- •4.3.4. Основные особенности ферментативного катализа
- •4.3.5. Пример простейшей реакции
- •4.3.6. Принцип индуцированного соответствия
- •4.3.7. Комплекс Михаэлиса
- •4.3.8. Уравнение Михаэлиса–Ментен
- •Зависимость от температуры
- •§4.4. Многостадийная модель ферментативных реакций
- •4.4.1.Реакция превращение l-аланина в d-аланин
- •Реакция с участием кофермента
- •Ферментативная реакция
- •4.4.2. Расщепление пептидной связи
- •Неферментативный процесс
- •Ферментативная реакция
- •Активный центр гидролитического фермента
- •Модель ферментативного гидролиза
- •§4.5. Ферменты с несколькими активными центрами Двухцентровые ферменты
- •§4.6. Каскады ферментативных реакций
4.3.8. Уравнение Михаэлиса–Ментен
Максимальная скорость характеризует эффективность ферментативной реакции. Наличие предельной скорости объясняется тем, что при высоких концентрациях субстрата [S] активные центры практически всех молекул фермента оказываются насыщенными. Новые комплексы могут образоваться лишь через время, необходимое для диссоциации уже имеющихся фермент – субстратных комплексов. Уравнение (4.32) в форме
![]() (4.34)
(4.34)
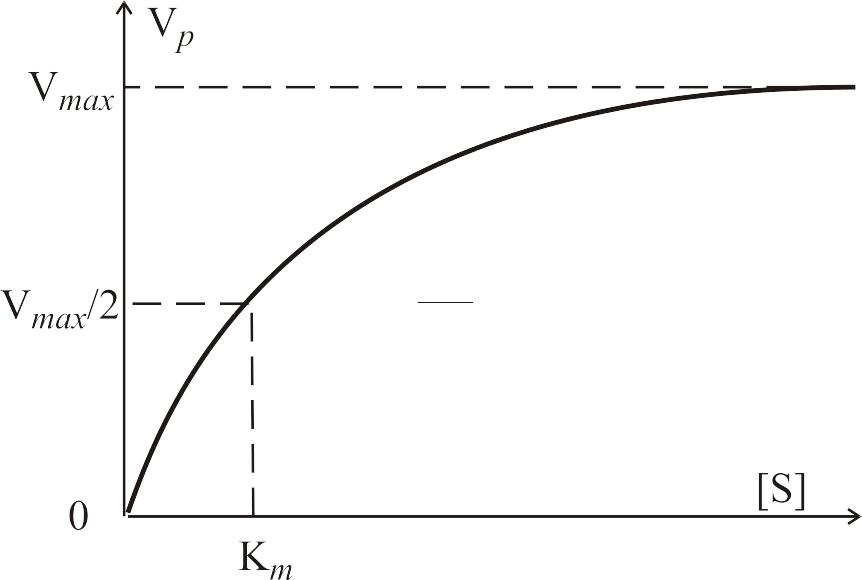
носит название уравнения Михаэлиса–Ментен. Зависимость (4.34) скорости ферментативной реакции Михаэлиса–Ментен (4.21) от концентрации субстрата [S] представлена на рис. 4–7.
|
Рис. 4–7. Зависимость скорости каталитической реакции (4.21)
|
Константа Михаэлиса
![]() численно равна той концентрации субстрата
[S], при которой скорость
достигает половины от максимальной
величины
численно равна той концентрации субстрата
[S], при которой скорость
достигает половины от максимальной
величины
![]() :
:
![]() .
Константа Михаэлиса характеризует
сродство фермента к субстрату. Чем
меньше
,
тем больше скорость Vmax,
выше сродство, то есть наблюдается более
быстрый рост скорости реакции с
увеличением концентрации субстрата
.
Константа Михаэлиса характеризует
сродство фермента к субстрату. Чем
меньше
,
тем больше скорость Vmax,
выше сродство, то есть наблюдается более
быстрый рост скорости реакции с
увеличением концентрации субстрата
![]() ,
чем при больших значениях константы
.
,
чем при больших значениях константы
.
По такой схеме, когда фермент может находиться в двух состояниях (свободном F и в виде комплекса FS) и имеется только один субстрат S, идет реакция гидролиза АТФ. Например, мышечный белок миозин (фермент) катализирует переход избытка химической энергии пирофосфатной связи АТФ в механическую энергию мышечного сокращения.
Зависимость от температуры
Скорость реакции зависит от температуры. С повышением температуры скорость реакции возрастает, так как увеличивается конформационная подвижность и скорость образования фермент – субстратного комплекса. Однако при достаточно высоких температурах, вследствие разрушения (денатурации) вторичной и третичной структур фермента, скорость ферментативной реакции снова уменьшается. Она также мала и при температурах вблизи замерзания, когда ферменты инактивируются. Поэтому возможно достаточно длительное хранение замороженных продуктов, в которых значительно снижается рост и размножение микроорганизмов, так как происходит инактивация их пищеварительных ферментов.
§4.4. Многостадийная модель ферментативных реакций
Для бимолекулярных реакций, в которых участвуют субстраты двух типов А и В:
А + В С + D,
где С и D – продукты реакции, простейший двухстадийный процесс реакции может быть осуществлен по схеме:
А + F АF и АF + В F + С + D.
В общем случае снижение потенциальных барьеров связано с тем, что каталитические реакции протекают по новому механизму, складывающемуся из последовательности элементарных реакций с меньшими значениями энергии активации, чем при не каталитических реакциях. Кроме того, происходит заимствование части энергии при многоточечном связывании. При этом в процессе реакции образуется большое число лабильных соединений Хn, времена жизни которых варьируются от нано- до миллисекунд. Формула каталитической реакции в этом случае имеет вид
![]() ,
,
где kn – константы скоростей отдельных промежуточных элементарных стадий реакции.
Появление лабильных соединений Хn
является следствием последовательных
конформационных изменений в фермент –
субстратном комплексе, вызванных
первичным изменением электронного
состояния активного центра фермента.
При изменении электронного состояния
в течение времени
![]() ,
возбуждаются колебательные степени
свободы лишь небольшого числа выделенных
химических связей субстрата и
функциональных групп фермента, не
затрагивающие основную часть белковой
глобулы. Возникающее конформационно
неравновесное состояние значительно
более медленно релаксирует к равновесному
исходному состоянию. В процессе релаксации
поэтапно синтезируются промежуточные
соединения Хn.
При этом ось ферментативной реакции и
ось конформационной релаксации совпадают.
,
возбуждаются колебательные степени
свободы лишь небольшого числа выделенных
химических связей субстрата и
функциональных групп фермента, не
затрагивающие основную часть белковой
глобулы. Возникающее конформационно
неравновесное состояние значительно
более медленно релаксирует к равновесному
исходному состоянию. В процессе релаксации
поэтапно синтезируются промежуточные
соединения Хn.
При этом ось ферментативной реакции и
ось конформационной релаксации совпадают.