- •IV. Ферменты – регуляторы биологических процессов
- •§4.1. Классификация ферментов
- •§4.2. Структура ферментов
- •4.2.1. Первичная, вторичная и третичная структуры
- •4.2.2. Активный центр
- •4.2.3. Кофакторы
- •§4.3. Ферментативный катализ
- •4.3.1. Общая схема механизма химических реакций.
- •4.3.2. Скорость некаталитических реакций
- •4.3.3. Химический катализ. Катализаторы
- •4.3.4. Основные особенности ферментативного катализа
- •4.3.5. Пример простейшей реакции
- •4.3.6. Принцип индуцированного соответствия
- •4.3.7. Комплекс Михаэлиса
- •4.3.8. Уравнение Михаэлиса–Ментен
- •Зависимость от температуры
- •§4.4. Многостадийная модель ферментативных реакций
- •4.4.1.Реакция превращение l-аланина в d-аланин
- •Реакция с участием кофермента
- •Ферментативная реакция
- •4.4.2. Расщепление пептидной связи
- •Неферментативный процесс
- •Ферментативная реакция
- •Активный центр гидролитического фермента
- •Модель ферментативного гидролиза
- •§4.5. Ферменты с несколькими активными центрами Двухцентровые ферменты
- •§4.6. Каскады ферментативных реакций
§4.5. Ферменты с несколькими активными центрами Двухцентровые ферменты
Существуют белки, от которых требуется высокая надежность работы. Такая надежность достигается наличием в одном белке нескольких активных центров. К таким белкам относятся аминоацил-тРНК синтетазы, которые присоединяют к тРНК нужные аминокислоты. От точности их работы зависит точность синтеза белков.
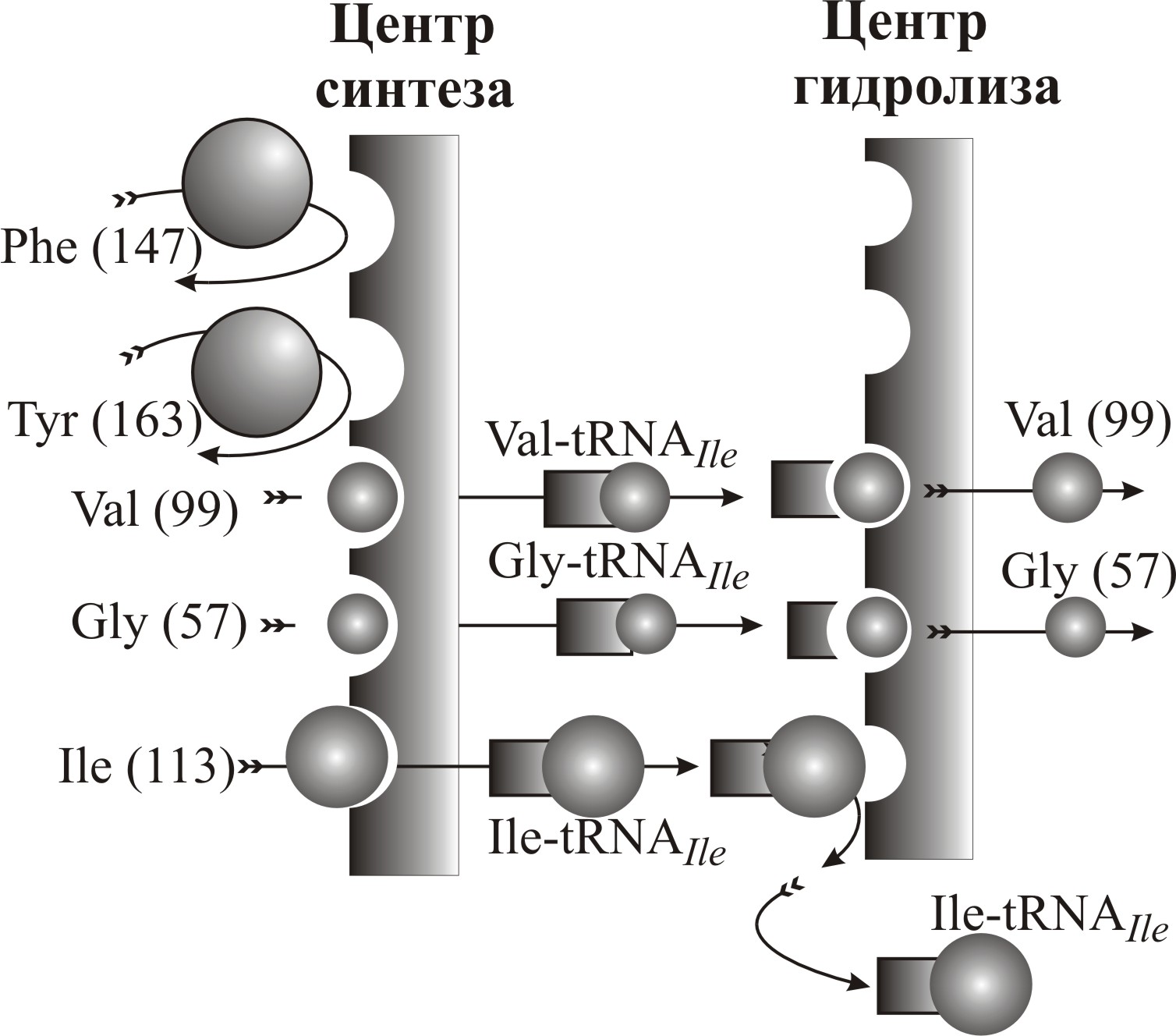
Первый активный центр – центр синтеза, второй – центр гидролиза (рис. 4–17).
На рис. 4–17 представлена схема синтеза изолейциновой тРНК, то есть зарядка tRNAIle изолейцином. Субстрат–связывающий карман работает, как сито и не пропускает частицы размером больше, чем ячейки сита. На первом сите происходит синтез аминоацил-тРНК, когда аминокислотой заряжается тРНК. Первое сито осуществляет синтез, как изолейциновой тРНК (Ile-tRNAIle), так и синтез тРНК с неправильными (более мелкими) аминокислотами: валином (Val-tRNAIle) и глицином (Gly-tRNAIle). Более крупные аминокислоты (фенилаланин Phe и тирозин Tyr) ситом не допускаются к синтезу.
|
Рис. 4–17. Схема механизма работы изолейцил-тРНК синтетазы с двумя активными центрами («двойным ситом»): центром синтеза, где к изолейциновой тРНК (tRNAIle) присоединяются аминокислоты, и центром гидролиза, где «неправильно заряженные » tRNAIle подвергаются гидролизу и распадаются. В скобках указана молекулярная масса аминокислотных остатков в дальтонах
|
Все «заряженные» тРНК поступают на второе сито, где осуществляется гидролиз – распад комплекса аминокислоты с тРНК. Поскольку размер гидролизного сита меньше, чем сита на синтезе, то гидролизу подвергаются только аминоацил-тРНК, заряженные более мелкими, чем изолейцин, аминокислотами (валинол и глицином). Аминоацил-тРНК с этими кислотами распадаются. Правильная кислота отвергается карманом гидролизного центра, и Ile-tRNAIle отделяется от фермента изолейциновой тРНК синтетазы.
§4.6. Каскады ферментативных реакций
Каскад состоит из нескольких однотипных ферментативных реакций. На каждой стадии каскада субстратами являются однотипные белки (рис. 4–18, белые овалы слева), которые в результате реакции фосфорилирования превращаются в активные ферменты (затемненные овалы справа). Эти ферменты, в свою очередь, превращают другие белки в активные ферменты и т.д. Таким образом, каскадную реакцию можно представить в виде цепочки:
белок I → активация → фермент I → белки II → ферменты II → белки III → ферменты III → и т.д.
Р ассмотрим
в качестве примера МАР – киназный каскад
(рис. 4–18), в который включено несколько
протеинкиназ.
ассмотрим
в качестве примера МАР – киназный каскад
(рис. 4–18), в который включено несколько
протеинкиназ.
Рис. 4–18. а – схема МАР-киназного ферментативного каскада, который активируется внеклеточным сигналом, вызывая изменение концентрации кальция Са и активацию С-киназы (протеинкиназы). Показана только одна линия синтеза. Белые овалы обозначают неактивные формы ферментов, серые – активные. Широкие стрелки изображают каталитическое действие ферментов, тонкие – протекающие реакции. Остаток фосфорной кислоты (фосфат, фосфатный остаток), присоединенный к молекуле белка обозначен буквой Ф в кружке
С-киназы (протеинкиназы) – ферменты, катализирующие реакцию присоединения фосфата к остатку серина, треонина или треозина в молекуле белка, что приводит к образованию фосфорилированной формы белка. В результате фосфорилирования изменяется конформация молекулы и белок или активируется, или ингибируется. Фосфорилирование является одним из главных способов регуляции внутриклеточных процессов, в частности, считывания генетической информации. По разным оценкам существует от 2 000 до 10 000 разных протеинкиназ.
На последней стадии МАР-киназного каскада образуется киназа, называемая МАР-киназой. МАР-киназа активируется путем присоединения фосфата. Этот процесс осуществляется специальной киназой, существующей в клетке, которая называется киназой МАР-киназы. Активная МАР-киназа фосфорилирует и меняет активность нескольких белков–мишеней. Исходно фермент киназа МАР-киназа не активен (как и МАР–киназа) и также активируется присоединением фосфата. Процесс фосфорилирования киназы МАР-киназы осуществляет еще одна клеточная специализированная протеинкиназа: киназа киназы МАР-киназы. Она исходно также не активна, но активируется иначе: сигналом, поступающим в клетку извне.
МАР-киназный каскад в клетке регулирует транскрипцию генов в ответ на изменения в окружающей среде.
Другой тип ферментов, участвующих в каскадных ферментативных реакциях, – протеазы.
Протеазы – протеолитические ферменты, катализирующие расщепление пептидных связей в белках и пептидах. Протеазные каскады обеспечивают свертывание крови, участвуют в апоптозе (запрограммированной гибели клеток, см. с.730). В протеолитических каскадах участвуют высокоспециализированные ферменты, избирательно расщепляющие только одну связь и только в одном определенном белке – мишени, в результате чего меняется конформация фермента и его активность.
Каскадная реакция запускается сигналом, активирующим первый фермент каскада, и заканчивается синтезом активной формы какого–либо белка, наиболее часто, тоже фермента.
Каковы преимущества каскадных реакций? Во-первых, каскад является усилителем сигнала, поступающего в клетку. Активация одной молекулы фермента приводит к образованию множества молекул активных белков. Если эти белки являются ферментами, то они производят множество молекул своего продукта.
Первая активная молекула фермента киназа киназы киназы МАР-киназы фосфорилирует несколько молекул киназы киназы МАР-киназы, каждая из которых – несколько следующих и т.д. Реакция имеет цепной характер. Концентрация продукта быстро растет во времени (см. рис. 4–18, справа). Аналогичным способом происходит мобилизация энергетических резервов в мышечной клетке.
Таким образом, одна молекула входного сигнала вызывает каскадную реакцию, в результате которой образуется множество молекул "сигнального" продукта. Ферментативный каскад является мощным усилителем. Он похож на цепную реакцию в атомной бомбе.
Каскад – типичный самоускоряющийся процесс. Достаточно появления сколь угодно слабого активирующего сигнала, чтобы все ферменты каскада были активизированы.
Казалось бы, в такой ситуации исходное состояние является неустойчивым. В действительности существуют дополнительные связи и реакции, позволяющие каскаду устойчиво существовать в неактивированном виде.