- •III. Химические компоненты живой материи
- •§3.1. Принцип изолобальной аналогии
- •§3.2. Углеводы
- •3.2.1. Классификация
- •3.2.2. Моносахариды
- •3.2.3. Оптические изомеры
- •3.2.4. Циклические моносахариды
- •3.2.5. Дисахариды и олигосахариды
- •3.2.6. Полисахариды
- •§3.3. Липиды
- •3.3.1. Неомыляемые липиды
- •3.3.2. Омыляемые липиды
- •Сложные эфиры
- •Нейтральные жиры
- •3.3.3. Фосфолипиды
- •Сфинголипиды – разновидность фосфолипидов
- •3.3.4. Гликолипиды
- •3.3.5. Кофермент а
- •§3.4. Аминокислоты и белки
- •3.4.1. Аминокислоты Структура аминокислот
- •3.4.2. Зарядовое состояние аминокислот
- •3.4.3. Хиральность
- •3.4.4. Пептидная связь
- •3.4.5. Полипептидные цепи
- •3.4.6. Классификация белков
- •§3.5. Пространственная структура белков
- •3.5.1. Классификация структур белковых молекул
- •3.5.2. Уровни пространственного строения глобулярных белков
- •3.5.3. Первичная структура
- •3.5.4. Вторичная структура
- •Спиральные структуры
- •3.5.5. Третичная структура
- •Домены в третичной структуре глобулярных белков
- •Основные типы третичных структур
- •3.5.6. Четвертичная структура белков
- •3.5.7. Некоторые общие особенности белковых структур
- •3.5.8. Зарядовое состояние белков
- •3.5.8. Энергетический спектр пептидных цепей
- •§3.6. Нуклеотиды и нуклеиновые кислоты
3.5.8. Энергетический спектр пептидных цепей
Благодаря плоскостному расположению
атомов в пептидной группе
(рис. 3–40), достигается хорошее
перекрытие рz-орбиталей,
образующих систему -связей.
На рис. 3–67 показана схема
энергетических уровней, соответствующих
электронам, образующим -
и -связи между
атомами (указаны в скобках), входящими
в состав пептидной группы. Энергетический
уровень электронов, образующих
неподеленную пару (е2) у атома
кислорода, находится выше энергетических
уровней связывающих σ- и π-орбиталей.
Стрелками показаны возможные переходы
электронов при возбуждении пептидной
группы (![]() создают полосу поглощения в области
190 нм;
создают полосу поглощения в области
190 нм;
![]() – полосу поглощения в области 225 нм).
– полосу поглощения в области 225 нм).
Рис. 3–67. Схема
энергетических уровней электронов,
образующих
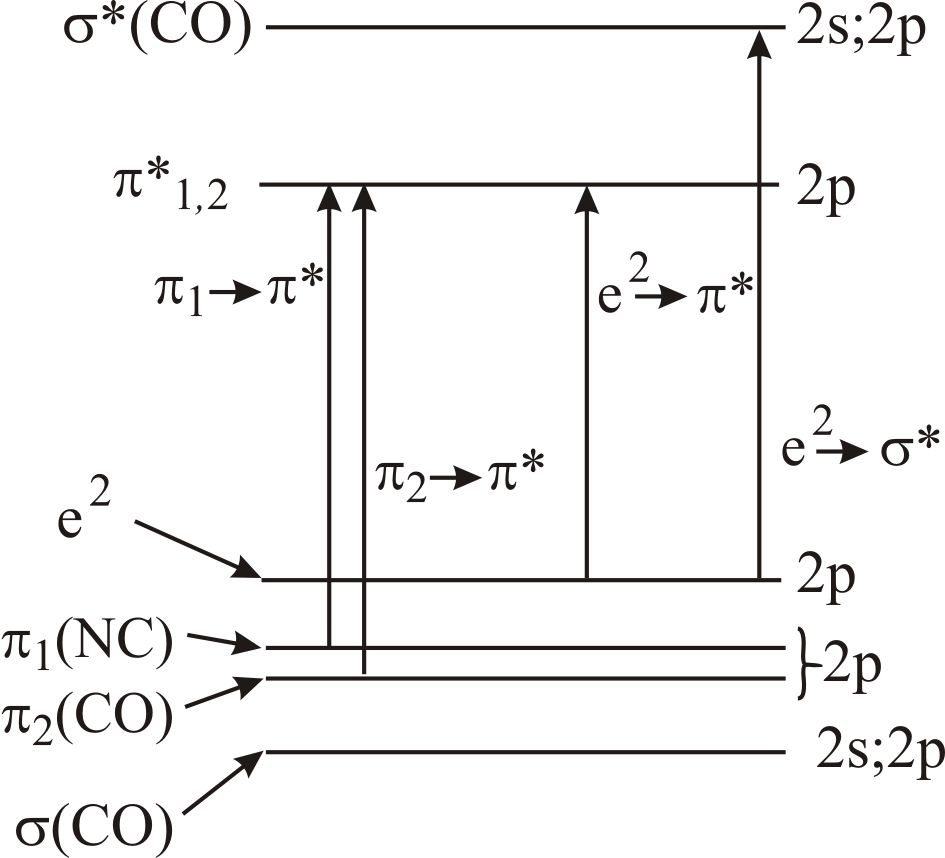
![]() -связи
между атомами углерода и кислорода
(СО) и
-связи
между атомами углерода и кислорода
(СО) и
![]() -связи
также между атомами (СО) и между атомами
азота и углерода (NС)
в пептидной группе. Уровень неподеленной
пары (е2)
2р-электронов у атома кислорода находится
по энергии выше уровней связывающих
молекулярных
-
и
-связи
также между атомами (СО) и между атомами
азота и углерода (NС)
в пептидной группе. Уровень неподеленной
пары (е2)
2р-электронов у атома кислорода находится
по энергии выше уровней связывающих
молекулярных
-
и
![]() -орбиталей.
Энергии разрыхляющих
-орбиталей.
Энергии разрыхляющих
![]() и
и
![]() орбиталей практически совпадают.
Стрелками показаны возможные переходы
электронов при возбуждении пептидной
группы
орбиталей практически совпадают.
Стрелками показаны возможные переходы
электронов при возбуждении пептидной
группы
В результате поглощения энергии возбуждения молекулы могут переходить из основного в возбужденное электронное состояние. Электронный переход из возбужденного состояния в нормальное в этих молекулах сопровождается собственным излучением – люминесценцией (свечением вещества).
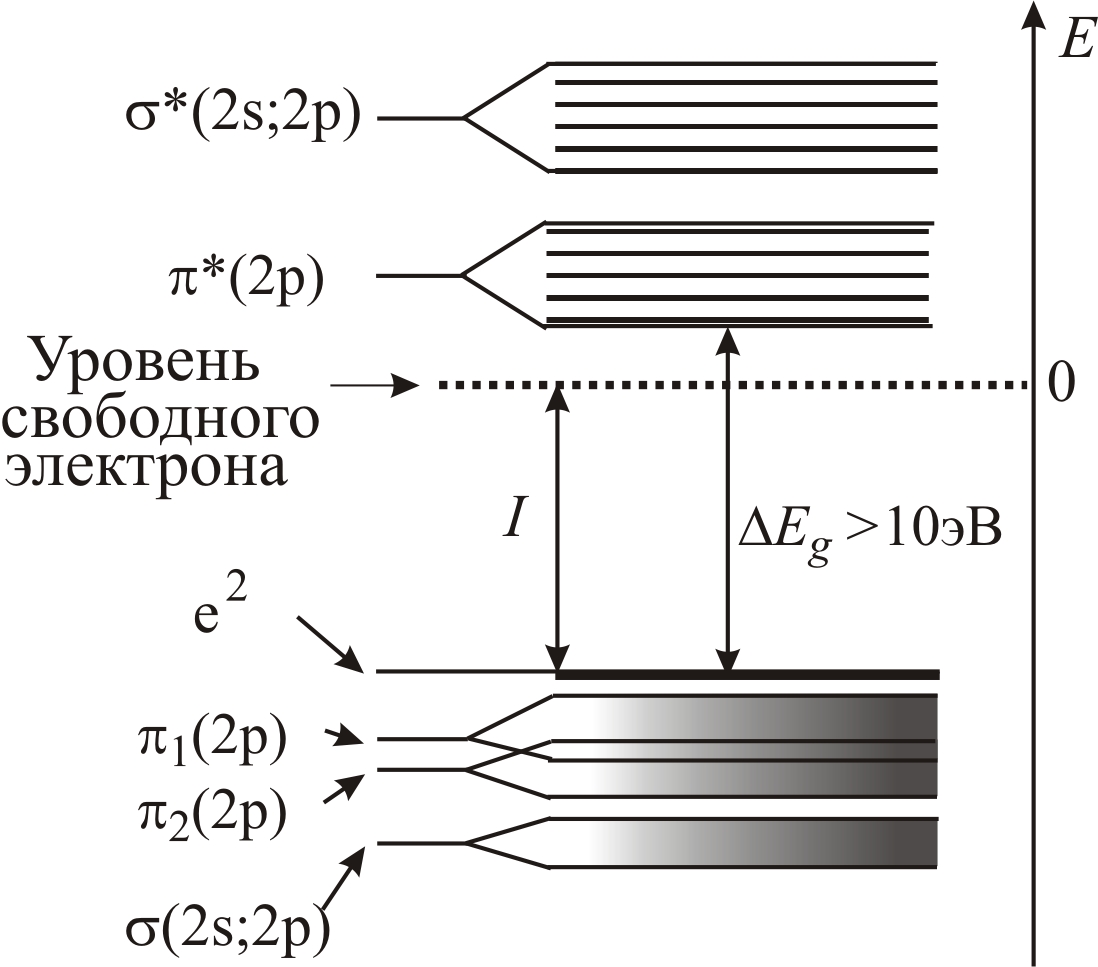
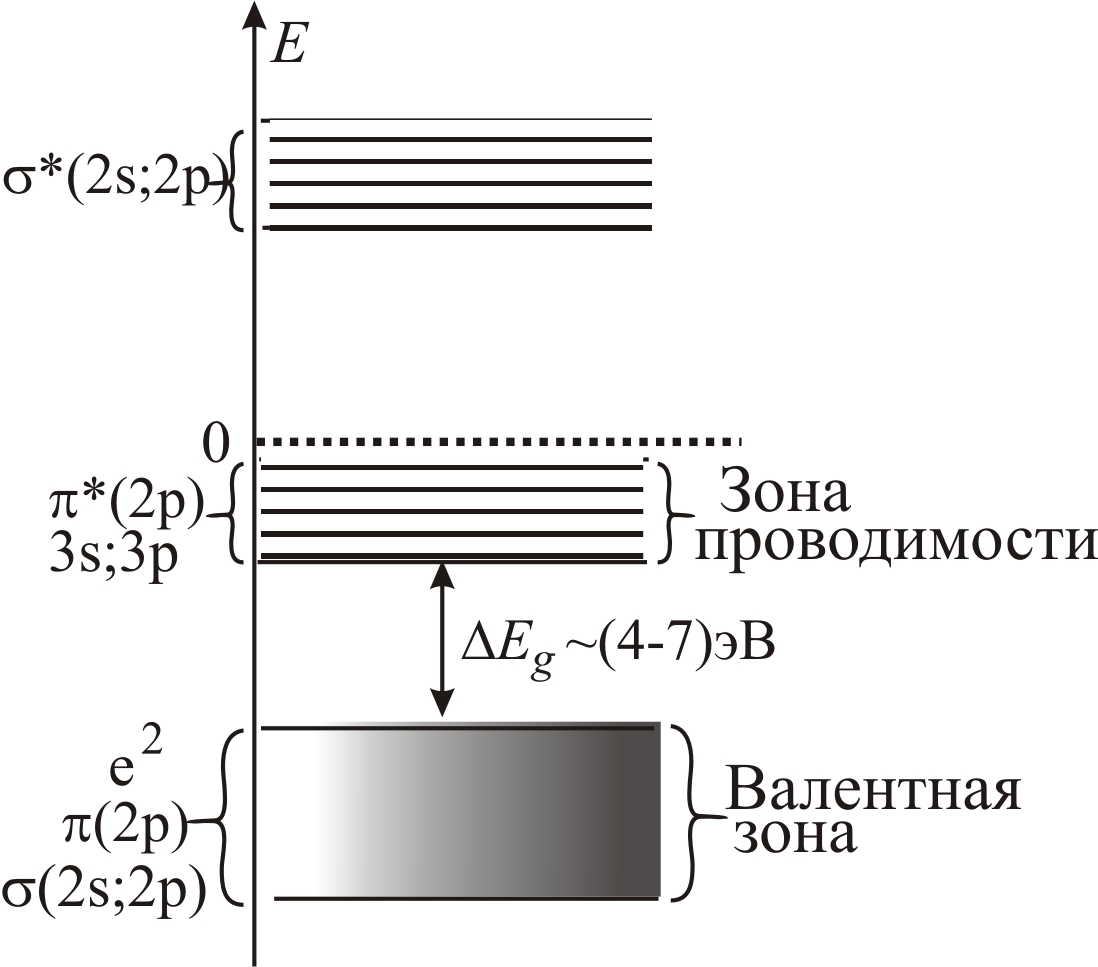
В белках водородные связи формируют периодическую укладку пептидных связей, обладающую трансляционной симметрией, как в кристаллических твердых телах. Перекрытие 2s- и 2р-орбиталей у близко расположенных пептидных групп приводит к расщеплению отдельных энергетических уровней (см. т. 1, с. 418) и образованию квазинепрерывных энергетических зон (рис. 3–68 а). Вследствие большой ширины запрещен-
|
|
(а) |
(б) |
Рис. 3–68. Схема энергетических зон полипептидной цепи, рассчитанная с учетом 1s-состояний атомов H, 1s, 2s, 2p-состояний атомов C, N, O (а) и дополнительно 3s и 3p-состояний атомов С, N и О (б). I – первый потенциал ионизации (9,7 эВ) |
|
ной зоны (~10 эВ) прямой термический переход из валентной зоны, полученной в результате перекрытия 1 и 2-зон, в зону проводимости оказывается невозможным. Таким образом, белок в обычных условиях является диэлектриком. Однако, учет незаполненных 3s- и 3р-состояний, также входящих в зону проводимости, сокращает величину запрещенной зоны до (4÷7) эВ (рис. 3–68 б).