
- •III. Химические компоненты живой материи
- •§3.1. Принцип изолобальной аналогии
- •§3.2. Углеводы
- •3.2.1. Классификация
- •3.2.2. Моносахариды
- •3.2.3. Оптические изомеры
- •3.2.4. Циклические моносахариды
- •3.2.5. Дисахариды и олигосахариды
- •3.2.6. Полисахариды
- •§3.3. Липиды
- •3.3.1. Неомыляемые липиды
- •3.3.2. Омыляемые липиды
- •Сложные эфиры
- •Нейтральные жиры
- •3.3.3. Фосфолипиды
- •Сфинголипиды – разновидность фосфолипидов
- •3.3.4. Гликолипиды
- •3.3.5. Кофермент а
- •§3.4. Аминокислоты и белки
- •3.4.1. Аминокислоты Структура аминокислот
- •3.4.2. Зарядовое состояние аминокислот
- •3.4.3. Хиральность
- •3.4.4. Пептидная связь
- •3.4.5. Полипептидные цепи
- •3.4.6. Классификация белков
- •§3.5. Пространственная структура белков
- •3.5.1. Классификация структур белковых молекул
- •3.5.2. Уровни пространственного строения глобулярных белков
- •3.5.3. Первичная структура
- •3.5.4. Вторичная структура
- •Спиральные структуры
- •3.5.5. Третичная структура
- •Домены в третичной структуре глобулярных белков
- •Основные типы третичных структур
- •3.5.6. Четвертичная структура белков
- •3.5.7. Некоторые общие особенности белковых структур
- •3.5.8. Зарядовое состояние белков
- •3.5.8. Энергетический спектр пептидных цепей
- •§3.6. Нуклеотиды и нуклеиновые кислоты
3.5.7. Некоторые общие особенности белковых структур
В основе четвертичной структуры всех белковых комплексов лежит спирализация, включающая как одинарные спирали, так и многоцепочечные (например, микротрубки).
Все белки с четвертичной структурой являются более высокой стадией эволюции, так как они лучше приспособлены к выполнению своих функций в результате более высокой чувствительности к регулирующему действию среды. Кроме того, при их биосинтезе экономится генетический материал и уменьшается вероятность ошибок.
У четвертичных структур, так же как и у третичных, гидрофобные остатки группируются внутри структур, а заряженные гидрофильные остатки – снаружи, что обеспечивает их стабильность в воде и водных растворах солей.
Третичные и четвертичные структуры очень компактны. Внутрь их могут проникать только отдельные ионы.
Заметим, что некоторые белки при физиологических условиях не имеют собственной стабильной пространственной структуры, подобно денатурированным белковым цепям. Они приобретают ее только при связывании лиганда или при соединении с другим белком, ДНК или РНК.
Другие – матриксные белки, относящиеся к фибриллярным белкам, примером которых является эластин, образуют огромные агрегаты, не имеющие внутри них определенной структуры. Эластин играет важную роль в формировании стенок артерий, легких и связок. Длинные цепи эластина образуют неупорядоченные клубки. Клубки сшиваются в сетку ферментно-модифицированными лизинами (по четыре в каждом узле сетки). Образуется матрикс наподобие резины. Нарушение в работе фермента, модифицирующего лизины в эластине, приводит к потере эластичности связок и сосудов.
Модели формирования вторичной и третичной структур белковых глобул будут рассмотрены ниже (с. 690–697).
3.5.8. Зарядовое состояние белков
При описании зарядового состояния
белков их, в первом приближении, можно
рассматривать как однородное вещество.
Относительная диэлектрическая
проницаемость
![]() вещества (общая диэлектрическая
проницаемость равна
вещества (общая диэлектрическая
проницаемость равна
![]() ,
где
,
где
![]() – диэлектрическая проницаемость вакуума
в системе СИ) белка лежит в пределах от
2 до 4 (будем полагать равной 3), как у
пластмасс, в то время как у водной среды,
в которой белок находится – около 80.
Поэтому заряд е=1,6∙10–19 Кул.,
моделируемый шариком с радиусом
r0 = 1,5Å,
находясь внутри белка, имеет энергию
– диэлектрическая проницаемость вакуума
в системе СИ) белка лежит в пределах от
2 до 4 (будем полагать равной 3), как у
пластмасс, в то время как у водной среды,
в которой белок находится – около 80.
Поэтому заряд е=1,6∙10–19 Кул.,
моделируемый шариком с радиусом
r0 = 1,5Å,
находясь внутри белка, имеет энергию
 , (3.10)
, (3.10)
а в водной среде –
 (3.11)
(3.11)
Запас стабильности белковой структуры,
равный разности свободных энергий белка
в нативном состоянии и в денатурированном,
составляет около ≈40кДж/моль (что в
расчете на одну молекулу белка
![]() ).
Энергия, превышающая этот предел (
).
Энергия, превышающая этот предел (![]() ),
разрушает нативную структуру, «взрывает»
белок. Из сравнения энергии разрушения
белка с (3.10) и (3.11) следует, что заряды не
могут находиться внутри белка, так как
их энергия превышает энергию деструкции
белка, а только снаружи, на его поверхности.
Поэтому погружаемая вглубь белка
заряженная группа разряжается, так
чтобы ее энергия была меньше
),
разрушает нативную структуру, «взрывает»
белок. Из сравнения энергии разрушения
белка с (3.10) и (3.11) следует, что заряды не
могут находиться внутри белка, так как
их энергия превышает энергию деструкции
белка, а только снаружи, на его поверхности.
Поэтому погружаемая вглубь белка
заряженная группа разряжается, так
чтобы ее энергия была меньше
![]() .
Если она была заряжена положительно,
то она отдает воде избыточные протоны
Н+, а если – отрицательно, то
присоединяет протоны Н+, находящиеся
в воде. Поэтому заряды внутри белка
встречаются, только при определенных
условиях и только тогда, когда они играют
важную функциональную роль.
.
Если она была заряжена положительно,
то она отдает воде избыточные протоны
Н+, а если – отрицательно, то
присоединяет протоны Н+, находящиеся
в воде. Поэтому заряды внутри белка
встречаются, только при определенных
условиях и только тогда, когда они играют
важную функциональную роль.
Для разбавленных растворов сильных
электролитов используется теория
Дебая-Хюккеля, в основе которой лежит
предположение непрерывности и
однородности среды и полной диссоциации
электролита. В этих условиях вокруг
иона одного сорта образуется, так
называемая, ионная атмосфера из
ионов другого знака. Потенциал
электрического поля на расстоянии r
от центрального иона при условии
непрерывного распределения заряда в
ионной атмосфере с плотностью
![]() описывается уравнением Пуассона (в
системе СИ):
описывается уравнением Пуассона (в
системе СИ):
![]() , (3.12)
, (3.12)
где
![]() – оператор Лапласа,
– относительная диэлектрическая
проницаемость растворителя (
– диэлектрическая проницаемость
вакуума).
– оператор Лапласа,
– относительная диэлектрическая
проницаемость растворителя (
– диэлектрическая проницаемость
вакуума).
При использовании для функции распределения Больцмана, решение (3.12) получается в виде:
![]() , (3.13)
, (3.13)
где ze — заряд
центрального иона (е – заряд
электрона),
![]() — радиус экранирования Дебая,
соответствующий эффективному радиусу
противоионного облака, заряд которого
равен заряду центрального иона.
— радиус экранирования Дебая,
соответствующий эффективному радиусу
противоионного облака, заряд которого
равен заряду центрального иона.
Радиус Дебая зависит от концентраций ионов (ni – концентрация i-го сорта ионов) и величины их зарядов qi = ezi:
![]() . (3.14)
. (3.14)
Теория Дебая–Хюккеля хорошо описывает свойства разбавленных растворов: в области концентраций до 0,01М. Однако с учетом поправок (конечного размера ионов и уменьшения вблизи ионов) позволяет использовать теорию в широком диапазоне концентраций.
Оценки показывают, что для зарядов,
находящихся на расстоянии ≈3Å, можно
использовать εeff ≈ 40.
При этом энергия их взаимодействия с
учетом экранировки составляет![]() ,
то есть меньше энергии денатурации
белка. Возможность использования (в
первом приближении) макроскопической
модели описания среды для зарядов,
находящихся на близком расстоянии,
объясняется сильной экранировкой
зарядов полярными молекулами воды.
,
то есть меньше энергии денатурации
белка. Возможность использования (в
первом приближении) макроскопической
модели описания среды для зарядов,
находящихся на близком расстоянии,
объясняется сильной экранировкой
зарядов полярными молекулами воды.
Опыт показывает, что макроскопическая
модель может использоваться и при
электростатическом взаимодействии
заряженных белковых групп. При этом
эффективное значение диэлектрической
проницаемости среды лежит в пределах
от
![]() до
до
![]() .
.
Верхнее значение
оказывается даже больше
![]() для воды. Оно соответствует точке С,
находящейся вблизи поверхности белковой
глобулы, наиболее удаленной от заряда
(рис. 3–66). Действительно, в точке С
потенциал складывается из потенциала
заряда q:
для воды. Оно соответствует точке С,
находящейся вблизи поверхности белковой
глобулы, наиболее удаленной от заряда
(рис. 3–66). Действительно, в точке С
потенциал складывается из потенциала
заряда q:
![]() ,
где r – расстояние от
заряда q до точки С,
и потенциалов поляризационных зарядов
,
где r – расстояние от
заряда q до точки С,
и потенциалов поляризационных зарядов
![]() и
и
![]() .
Поляризационные заряды
.
Поляризационные заряды
![]() (на более удаленной от точки С поверхности)
и
(на более удаленной от точки С поверхности)
и
![]() (на ближней к точке С поверхности)
образуются на поверхности белковой
глобулы из-за разности диэлектрических
проницаемостей внутри и снаружи глобулы.
Поскольку отрицательные поляризационные
заряды расположены ближе к точке С, чем
положительные, и
(на ближней к точке С поверхности)
образуются на поверхности белковой
глобулы из-за разности диэлектрических
проницаемостей внутри и снаружи глобулы.
Поскольку отрицательные поляризационные
заряды расположены ближе к точке С, чем
положительные, и
![]() ,
то их влияние оказывается преобладающим,
и потенциал в точке С (
,
то их влияние оказывается преобладающим,
и потенциал в точке С (![]() )
меньше
)
меньше
![]() ,
а
,
а
![]() ,
соответственно, – больше 80.
,
соответственно, – больше 80.
В точке А, наоборот, потенциал
![]() больше
,
и эффективное значение диэлектрической
проницаемости уменьшается примерно в
два раза:
.
больше
,
и эффективное значение диэлектрической
проницаемости уменьшается примерно в
два раза:
.
Внутри белка, в точке В
![]() .
.
Рис. 3–66.
Иллюстрация образования поляризационных
зарядов на поверхности белковой молекулы
(ε2),
находящейся в водной среде (ε1),
в присутствие заряда +q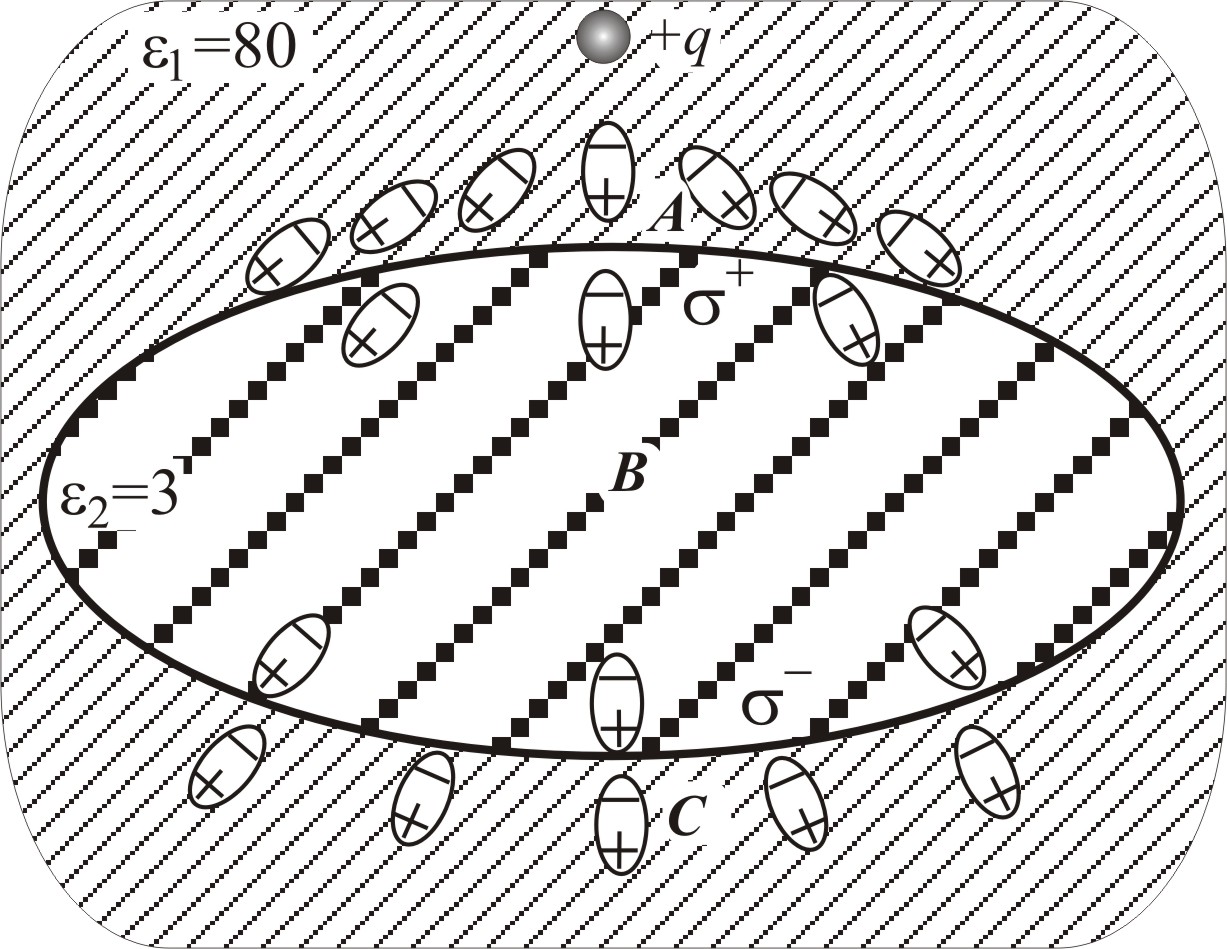
![]() )
в растворе уменьшается, и молекулы
приобретают избыточный отрицательный
заряд, так как экранировка ионами Н+
(
)
отрицательно заряженных групп ослабевает.
Наоборот, при значениях рН ниже
изоэлектрической точки, концентрация
ионов Н+ (
)
увеличивается, соответственно усиливается
экранировка групп, несущих отрицательные
заряды. У макромолекул образуется
избыточный положительный заряд. Таким
образом, в зависимости от величины рН
раствора молекулы белка, так же как
молекулы аминокислот, обладают амфотерными
свойствами (от греч.amphóteros
– и тот и другой; способность проявлять
как кислотные, так и основные свойства
в зависимости от природы второго
компонента, участвующего в кислотно-основном
взаимодействии).
)
в растворе уменьшается, и молекулы
приобретают избыточный отрицательный
заряд, так как экранировка ионами Н+
(
)
отрицательно заряженных групп ослабевает.
Наоборот, при значениях рН ниже
изоэлектрической точки, концентрация
ионов Н+ (
)
увеличивается, соответственно усиливается
экранировка групп, несущих отрицательные
заряды. У макромолекул образуется
избыточный положительный заряд. Таким
образом, в зависимости от величины рН
раствора молекулы белка, так же как
молекулы аминокислот, обладают амфотерными
свойствами (от греч.amphóteros
– и тот и другой; способность проявлять
как кислотные, так и основные свойства
в зависимости от природы второго
компонента, участвующего в кислотно-основном
взаимодействии).
Обратим внимание на то, что независимо от величины рН все молекулы одного и того же сорта имеют одинаковый (положительный или отрицательный) заряд. Поэтому между белками одного сорта действуют силы электростатического отталкивания, которые препятствуют слипанию (агглютинации) белковых молекул. Исключение составляет случай, когда рН соответствует изоэлектрической точке. В этом случае силы, способствующие разъединению молекул белков, отсутствуют. В изоэлектрической точке нет препятствий сближению молекул под воздействием сил Ван-дер-Ваальса и их агглютинации. Поэтому растворимость белков в изоэлектрической точке минимальна.
Например, у свежего молока значение рН значительно выше рН изоэлектрической точки казеина (от лат. caseus – сыр) – сложного белка, образующегося при створаживании молока. При подкислении молока продуктами попавших в него бактерий, концентрация ионов Н+ ( ) увеличивается, что приводит к снижению рН. Когда рН молока достигает значения рН изоэлектрической точки казеина (рН=4,7), белок (казеин) молока агглютинирует и выпадает в осадок в виде белых хлопьев. Таким образом молоко створаживается.
В цитоплазме клеток у большинства белков изоэлектрические точки несколько превышают значение рН=6, в то время как у цитоплазмы рН≈7. Таким образом, в реальных условиях концентрация ионов Н+ ( ) в цитоплазме меньше концентраций, соответствующих изоэлектрическим точкам белков. Поэтому белки в цитоплазме имеют отрицательные заряды.
