
- •III. Химические компоненты живой материи
- •§3.1. Принцип изолобальной аналогии
- •§3.2. Углеводы
- •3.2.1. Классификация
- •3.2.2. Моносахариды
- •3.2.3. Оптические изомеры
- •3.2.4. Циклические моносахариды
- •3.2.5. Дисахариды и олигосахариды
- •3.2.6. Полисахариды
- •§3.3. Липиды
- •3.3.1. Неомыляемые липиды
- •3.3.2. Омыляемые липиды
- •Сложные эфиры
- •Нейтральные жиры
- •3.3.3. Фосфолипиды
- •Сфинголипиды – разновидность фосфолипидов
- •3.3.4. Гликолипиды
- •3.3.5. Кофермент а
- •§3.4. Аминокислоты и белки
- •3.4.1. Аминокислоты Структура аминокислот
- •3.4.2. Зарядовое состояние аминокислот
- •3.4.3. Хиральность
- •3.4.4. Пептидная связь
- •3.4.5. Полипептидные цепи
- •3.4.6. Классификация белков
- •§3.5. Пространственная структура белков
- •3.5.1. Классификация структур белковых молекул
- •3.5.2. Уровни пространственного строения глобулярных белков
- •3.5.3. Первичная структура
- •3.5.4. Вторичная структура
- •Спиральные структуры
- •3.5.5. Третичная структура
- •Домены в третичной структуре глобулярных белков
- •Основные типы третичных структур
- •3.5.6. Четвертичная структура белков
- •3.5.7. Некоторые общие особенности белковых структур
- •3.5.8. Зарядовое состояние белков
- •3.5.8. Энергетический спектр пептидных цепей
- •§3.6. Нуклеотиды и нуклеиновые кислоты
3.4.5. Полипептидные цепи
При конденсации двух, трех и нескольких молекул аминокислот получаются дипептиды, трипептиды и т.д. Полипептиды, полученные конденсацией 100 и более аминокислот называются белками, а то, что остается от аминокислоты после встраивания ее в белковую цепь называется аминокислотным остатком. Белок может состоять из одного полипептида или нескольких полипептидов, образующих в результате нековалентных взаимодействий единый комплекс. Пептидная цепь имеет два разных конца – N-конец, несущей свободную аминную группу и С-конец, несущий карбоксильную группу. В пептидах аминокислотные остатки соединены последовательно в цепочку. Чтобы назвать конкретный пептид, достаточно перечислить последовательность входящих в его состав аминокислотных остатков, начиная с N-конца и заканчивая С-концом.
Общий вид полипептидной цепи изображен на рис. 3–41. В полипептидной цепи чередуются жесткая пептидная связь и две одинарные (N–C–C). Принципиально важно, что плоскости, в которых расположены пептидные связи, обозначенные на рисунке штриховыми линиями, могут свободно вращаться вокруг одинарных связей. Однако, наличие взаимодействий между атомами и молекулярными группами в самой цепи и взаимодействие цепи с окружающей средой, накладывает ряд ограничений на свободное вращение.
К взаимодействиям
внутри цепи
(рис. 3–42) относятся: ограничения,
связанные с пространственной конструкцией
и размерами боковых групп R,
диполь-дипольные взаимодействия
плоскостей с пептидными связями, наличие
водородных связей между ними,
электростатические и гидрофобные
взаимодействия между боковыми группами,
а также дополнительные ковалентные
дисульфидные связи (сшивки) (рис. 3–43).
взаимодействиям
внутри цепи
(рис. 3–42) относятся: ограничения,
связанные с пространственной конструкцией
и размерами боковых групп R,
диполь-дипольные взаимодействия
плоскостей с пептидными связями, наличие
водородных связей между ними,
электростатические и гидрофобные
взаимодействия между боковыми группами,
а также дополнительные ковалентные
дисульфидные связи (сшивки) (рис. 3–43).
Рис. 3–41. Чередование «жестких» пептидных связей в плоскостях, границы которых обозначены на рисунке штриховыми линиями, и одинарных связей, вращение вокруг которых задается углами и

Рис. 3–42. Связи, стабилизирующие вторичную и третичную структуры белков. В водородных связях С=О группа участвует, как донор неподеленной пары, а N–H и О–Н группы – как доноры протонов
С помощью водородных связей между карбонильным (связанным с атомом С) атомом кислорода i–го пептидного фрагмента и амидным атомом водорода (i+4)-го пептидного фрагмента полипептиды могут образовывать спиральную структуру.
Электростатическое ионное взаимодействие между H3N+ и СОО– определяется величиной эффективного заряда этих групп, и поэтому зависит от рН среды. Оно максимально в определенной области рН, а при отклонениях в обе стороны от этого интервала может отсутствовать (см., например, рис. 3–31).
Р еакция
окисления с образованием дисульфидных
сшивок между пространственно сближенными
SН–группами цистеинов
(серосодержащих моноаминомонокарбоновых
аминокислот) полипептидных цепей
показана на рис. 3–43.
еакция
окисления с образованием дисульфидных
сшивок между пространственно сближенными
SН–группами цистеинов
(серосодержащих моноаминомонокарбоновых
аминокислот) полипептидных цепей
показана на рис. 3–43.
Рис. 3–43.
Образование дисульфидных сшивок в
полипептидных цепях
Таблица III–4
Взаимодействие между атомами |
u0, кДж/моль |
r0, Å |
a, Å |
Ван-дер-Ваальсовский радиус, Å |
H - - H |
0,50 |
2,4 |
2,0 |
H: 1,0 |
H - - C |
0,46 |
2,9 |
2,4 |
C: 1,5 |
C - - C |
0,50 |
3,4 |
3,0 |
|
O - - O |
0,96 |
3,0 |
2,7 |
O: 1,35 |
N - - N |
0,84 |
3,1 |
2,7 |
N: 1,35 |
CH2 - - CH2 |
|
≈4,0 |
≈3,0 |
CH2: ≈1,5 |
Очень важное значение имеет гидрофобное взаимодействие, когда белок, составленный из полипептидных цепей, свертывается в водной среде таким образом, чтобы его гидрофобные боковые цепи были скрыты внутри молекулы, то есть – защищены от соприкосновения с водой, а гидрофильные боковые цепи – находились с внешней стороны структуры молекулы.
В результате этих ограничений полипептидная цепь принимает только одну нативную (естественную для данных условий) конформацию.
Сравнительный вклад в энергию макромолекулы основных видов взаимодействий, участвующих в формировании нативной структуры, приведен на рис. 3–44. Наибольшее понижение энергии соответствует образованию ковалентной связи, наименьшее – взаимодействию Ван-дер-Ваальса.
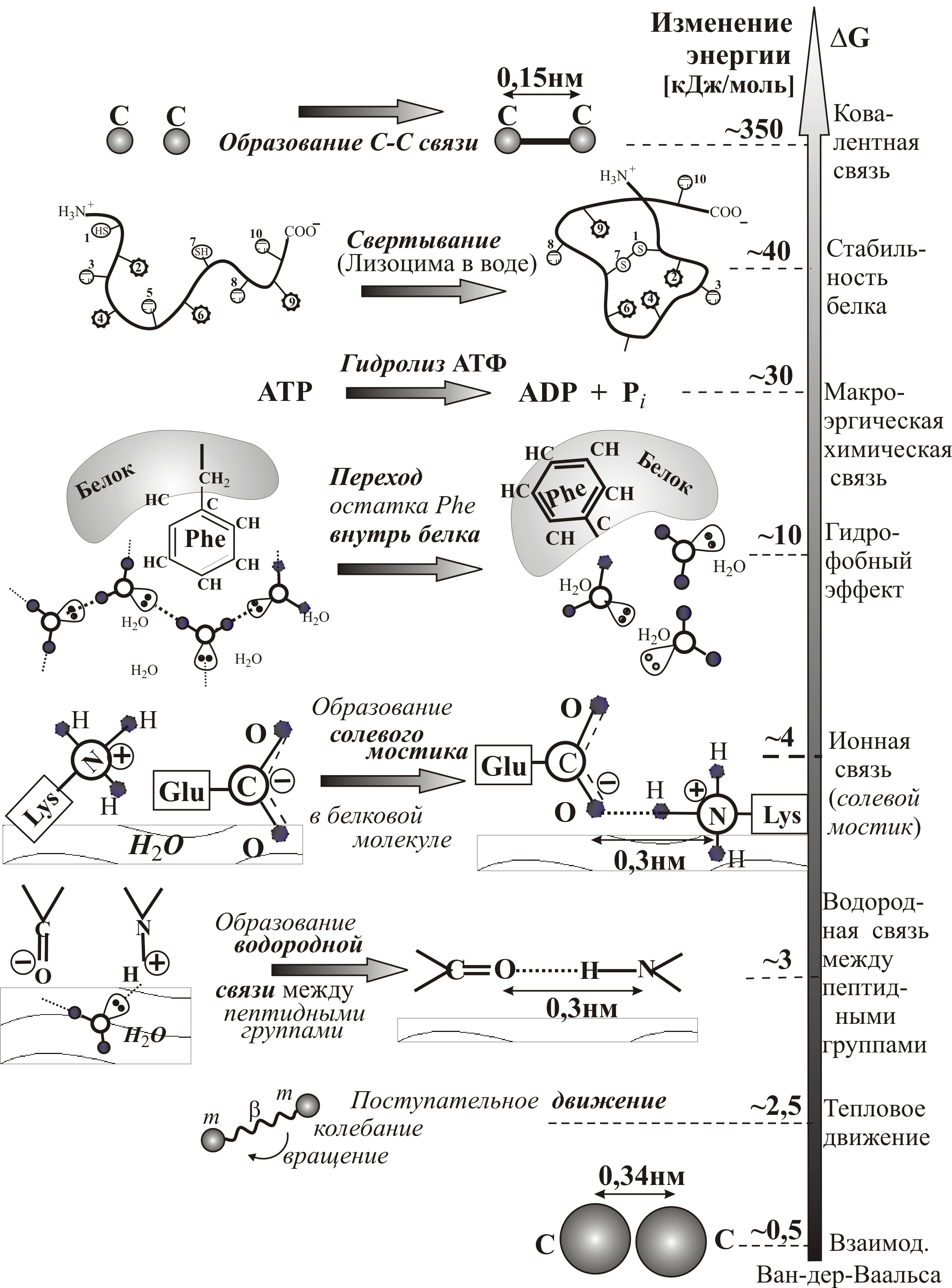
Рис. 3–44. Сравнительный вклад в энергию макромолекулы основных видов взаимодействий, участвующих в формировании нативной структуры белка. Шкала изменения свободной энергии ∆G (кДж/моль) дана без соблюдения масштаба
Следует подчеркнуть огромное влияние среды на структуру и функционирование белковой молекулы. В щелочной среде с низкой концентрацией Н3О+ пептидная гидрофильная группа —HN—CO— может депротонироваться (отдать протон Н+ молекуле воды), становясь высокоэлектрофильной. При этом молекулы воды атакуют пептидную группу, что приводит к разрушению пептидной связи и деструкции белка. Таким образом, высокие значения рН являются смертельно опасными для живых организмов.
Белки плазмы крови вместе с гемоглобином и солями (бикарбонатами, фосфатами) поддерживают строгое постоянство концентрации водородных ионов в крови человека на слабощелочном уровне (рН = 7,39) (см. рис. 3–30), что жизненно важно для обеспечения нормального протекания большинства биохимических реакций в организме.
