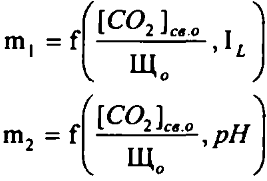- •8. Определение потерь напора в трубопроводах. Формулы, таблицы и графики для гидравлического расчета водопроводных сетей. Задачи гидравлического расчета водопроводных сетей.
- •9. Подготовка водопроводной сети к гидравлическому расчету. Гидравлический расчет разветвленных водопроводных сетей.
- •Гидравлическая увязка водопроводных сетей методами андрияшева и лобачева.
- •Использование эвм для расчета водопроводных сетей.
- •Инженерная постановка задачи.
- •Создание математической модели.
- •Выбор численного метода.
- •Основные требования, предъявляемые к конструкции водопроводных сетей.
- •Области применения труб, различных по материалу.
- •Основания под трубопровод
- •Правила расположения сетей
- •Пересечение сетей
- •Технологическая схема
- •Закономерности процесса осветления воды в слое взвешенного осадка.
- •Минимальной мутности при минимальном зимнем расходе воды
- •Наибольшей мутности при наибольшем, ей соответствующем, летнем расходе воды.
- •17. Технологическая схема водоподготовки с контактными осветлителями и область ее применения. Контактные осветлители: устройство и закономерности работы.
- •18. Технологическая схема водоподготовки с контактными префильтрами и скорыми фильтрами и область ее применения. Конструктивные схемы скорых фильтров.
- •19. Технологическая схема водоподготовки с напорными флотаторами и скорыми фильтрами и область ее применения. Закономерности процесса флотации. Схема флотации и основы расчета.
- •21. Реагентные хозяйства с мокрым и сухим хранением сульфата аммония (технологическая схема и состав оборудования). Известковые хозяйства. Определение объемов складов реагентов и расходных баков.
- •М окрого хранения с баками совмещенными с баками хранилища. (7)
- •22. Дозирование реагентов в воду. Классификация дозаторов. Смешение реагентов с водой. Смесительные устройства: классификация, схемы и основы расчета.
- •23. Камеры хлопьеобразования станций водоподготовки: классификация, устройство и основы расчета. Конструкции и область применения в водоподготовке барабанных фильтров и микрофильтров.
- •25. Осветление воды фильтрованием, типы фильтров. Медленные и скорые фильтры: применение, типы, устройство. Распредсистемы скорых фильтров.
- •26. Расчет скорых фильтров и контактных осветлителей станций водоподготовки. Применяемые фильтрующие материалы. Промывка фильтров и контактных осветлителей.
- •Расчёт контактного префильтра:
- •27. Хлорирование воды с преаммонизацией. Схема получения гипохлорита натрия электролизом. Обеззараживание воды прямым электролизом.
- •Второй этап обработки:
- •Обработка порошкообразным активным углем
- •Окислительно-сорбционный метод.
- •30. Обезжелезивание воды: классификация методов и область их применения. Схемы установок.
27. Хлорирование воды с преаммонизацией. Схема получения гипохлорита натрия электролизом. Обеззараживание воды прямым электролизом.
Виды и преимущества видов гипохлорита натрия.
Самый распространенный продукт – гипохлорид натрия, бывает 2х видов:
Химический гипохлорид натрия, он изготавливается на химимческих предприятиях, где готовят хлор. Концентрация его 160-200 г активного хлора/л. Он быстро разлагается и его транспортировка целесообразна на расстояние не более 300км от места изготовления.
Более распространенный вид: электролитический. Получают на месте потребления электролизом в электролизере из растворов поваренной соли или из сильно минерализованных подземных вод. Концентрация обычно около 8-10г/л. До 2000г. применяли электролизеры на небольших водопроводах. Но потом построили в Питере очень крупный завод по изготовлению электролитического гипохлорита натрия.
Недостатки:
высокая стоимость оборудования для получения гипохлорида натрия,
сложность и высокая стоимость эксплуатации оборудования, очень высокий расход электроэнергии на электролиз. По стоимости это в десятки раз выше, чем применение обычных схем применения газообразного хлора, но зато нет проблем с безопасностью, что значительно снижает затраты на безопасность.
Схема получения гипохлорита натрия: Гипохлорит натрия получают путем электролиза поваренной соли (рис 3). Насосами раствор перекачивают в электролизер, где подвергают электродиализу. Готовый раствор дозируется в воду.
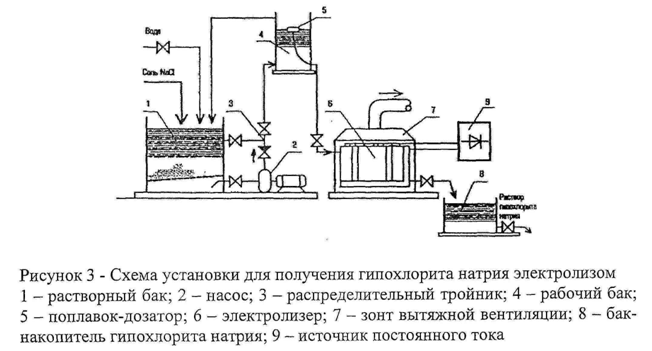 Схема
установки для получения гипохлорита
натрия электролизом. 1-растворный бак,
2-насос, 3-распределительный тройник,
4-рабочий бак, 5-поплавок-дозатор,
6-электролизер, 7-зонт вытяжной вентиляции,
8-бак-накопитель гипохлорита натрия,
9-источник постоянного тока.
Схема
установки для получения гипохлорита
натрия электролизом. 1-растворный бак,
2-насос, 3-распределительный тройник,
4-рабочий бак, 5-поплавок-дозатор,
6-электролизер, 7-зонт вытяжной вентиляции,
8-бак-накопитель гипохлорита натрия,
9-источник постоянного тока.
Гипохлорит натрия получают электролизом раствора хлорида натрия с образованием гидроксида натрия NaOH и Cl2 с последующим его гидролизом в установке: H3O+2e=H+H2O - на катоде На аноде 2Cl-=Cl-+2e
Cl2+2H2O=H3O++Cl-+HOCl HOCl+H2O=H3O++OCl-
Хлорирование с аммонизацией.
При наличие в воде аммонийного азота:
Образуется моно и дихлорамин, обладающие более низким бактерицидным действием-в 25раз ниже, но у них преимущество перед хлорноватистой кислотой: повышенная длительная устойчивость и сохранность в воде при ее хранении и транспортировке. Хлорноватистая кислота и гипохлорид ион максимум держится в течении 2часов, хлорамины м. сохраняться в воде(последействие) до нескольких суток. Поэтому аммонизация целесообразна для применения в больших городах. Иногда для преднамеренного образования хлораминов в воду вводят кроме хлора азотсодержащие реагенты. М. вводить аммиак газообразный, сульфат аммония и тд. Расход хлора снижается на 60%. Содержащийся хлор в хлораминах называется связанным, сумма свободного и связанного называется активным хлором.
Введение аммиака или другого азотсодержащго реагента за 2 мин до вторичного ввода хлора – преамонизация. При преаммонизации доза аммиака принимается равной 30-50% от дозы хлора. или Дк/4-10
Применяется:
для предотвращения образования хлорфенольных запахов
для предотвращения хлорорганических соединений. Хлорамины не могут вступить в реакцию с органикой и нет побочных продуктов. При хлорировании с амонизацией снижается содержание побочных продуктов до нескольких раз.
Введение аммиака после хлора, как правило производится перед РЧВ. Называется хлорированием с постамонизацией. Применяют с постамонизацией:
для увеличения продолжительности бактерицидного действия хлора, при длительной транспортировке по сетям или при длительном хранении воды.
Постамонизация используется в Москве. Широко применяют и постамонизацию и преамонизацию.
Схема с преамонизацией:
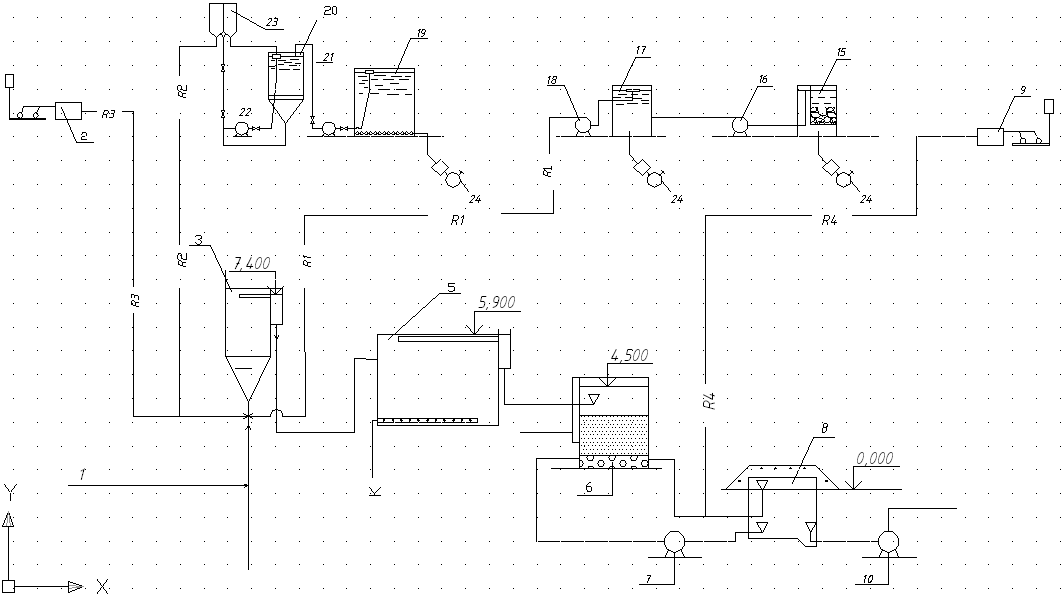
R1 - |
Трубопровод подачи коагулянта |
R2 - |
Грубопровод подачи извести |
R3 - " |
Грубопровод подачи аммиака |
R4 - " |
Грубопровод подачи хлора |
Если аммонизацию проводят аммиачной водой, применяют установку, состоящую из двух работающих попеременно баков, оборудованных по типу сосуда Мариотта и соединенных с мерником. Аммиачную воду из газообразного аммиака приготовляют в баке-абсорбере.
3 -промежуточный
баллон для выделения капелек воды.после
того, как хлорпроводы выходили в ремонт,
их промывают -40град азотом. 4-запорный
вентиль для выключения, 5-фильтр для
задержки технических примесей,
6-редукционный клапан, кот поддерживает
постоянное давление после себя=>поддерж
постоянный расход 7-манометры,
8-регулировочный вентиль для регулировки
дозы, 9-ротаметр и поплавок 10 в нем,
11-эжектор со встроенными внутри 12 и 13.
12-обратный клапан-для предотвращения
попадения воды в хлорпровод13-клапан
для охраны системы подачи от сбоя при
понижении давления на водопроводной
сети.-для избежания подсоса реагента в
систему.
-промежуточный
баллон для выделения капелек воды.после
того, как хлорпроводы выходили в ремонт,
их промывают -40град азотом. 4-запорный
вентиль для выключения, 5-фильтр для
задержки технических примесей,
6-редукционный клапан, кот поддерживает
постоянное давление после себя=>поддерж
постоянный расход 7-манометры,
8-регулировочный вентиль для регулировки
дозы, 9-ротаметр и поплавок 10 в нем,
11-эжектор со встроенными внутри 12 и 13.
12-обратный клапан-для предотвращения
попадения воды в хлорпровод13-клапан
для охраны системы подачи от сбоя при
понижении давления на водопроводной
сети.-для избежания подсоса реагента в
систему.
Д ля смешения аммиака с водой применяют часто шайбовые смесители:
Шайбовый смеситель. Шайба – сужающаяся часть трубопровода.
28
Стабильной называют воду, не вызывающую коррозии поверхностей, с которыми она соприкасается, и не выделяющую на этих поверхностях осадка карбоната кальция. Понятие «агрессивности» воды связано с содержанием в ней соединений угольной кислоты, присутствующей в форме недиссоциированных молекул Н2СО3 (незначительные концентрации), молекулярно растворенного углекислого газа СО2, бикарбонатных ионов НСОз и карбонатных ионов СОз2- (при рН > 8,4).

Соотношение между соединениями угольной кислоты в растворе при данной температуре зависит от величины рН (рис. 15.8). Между различными формами угольной кислоты в их водных растворах существует динамическое равновесие(при нарушении равновесия вода становится нестабильной):

О стабильности воды судят по показателю стабильности. Для определения показателя стабильности используют метод встряхивания воды в сосуде с порошком карбоната кальция в течение двух часов.

где Щ0 - щелочность воды до контакта с порошком карбоната кальция, мг-экв/л; Щs - щелочность воды после контакта, мг-экв/л. При Пст > 1 - вода пересыщена карбонатом кальция и способна создавать на поверхности труб защитную пленку. При Пст < 1 - вода является агрессивной и способна растворять карбонат кальция. При Пст = 1 - вода считается стабильной.
Одним из широко распространенных расчетных критериев оценки стабильности воды является индекс насыщения Ланжелье, который определяется из выражения:

где рН - величина рН исходной воды; pHs - рН равновесного насыщения воды карбонатом кальция.
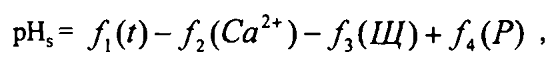
где f1(t) - функция температуры воды; f2(Ca) - функция концентрации в воде кальция; f3(Щ) - функция общей щелочности воды; f4(Р) - функция общего солесодержания.
При IL = 0- вода стабильна, при IL < О - агрессивна, при IL > О - пересыщена по карбонату кальция.
Расчетным критерием стабильности воды является индекс Ризнера:

Вода считается стабильной в области значений Ir , равных 6-7, при Ir > 7 агрессивна, при Ir < 6 - вода способна к осаждению СаСОз.
Стабилизация воды при IL <0.
Реагентную обработку агрессивной воды проводят в два этапа: в начальный период путем введения в воду реагента с расчетной дозой (Дщ1) обеспечивают наращивание на внутренних стенках труб защитной карбонатной пленки, при этом создают IL~+0,7. После формирования защитной пленки обработка воды с целью ее сохранения ведется дозами реагента (Дщ2)при условии поддержания IL ~= 0. Расчет требуемой дозы подщелачивающего реагента, для каждого конкретного случая производится по формулам: Первый этап обработки:
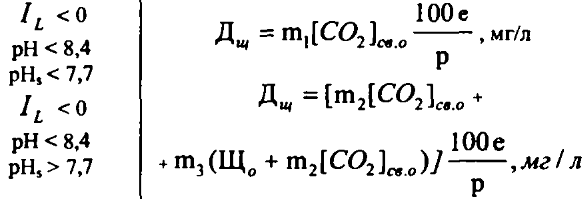
[CO2]св.о – концентрация свободной углекислоты в исходной воде; Щ0 – щелочность исходной воды; р – содержание активного вещества в техническом продукте; е – эквивалентный вес щелочи (едкий натр 40, известь 28); m3 = f(pHs)