
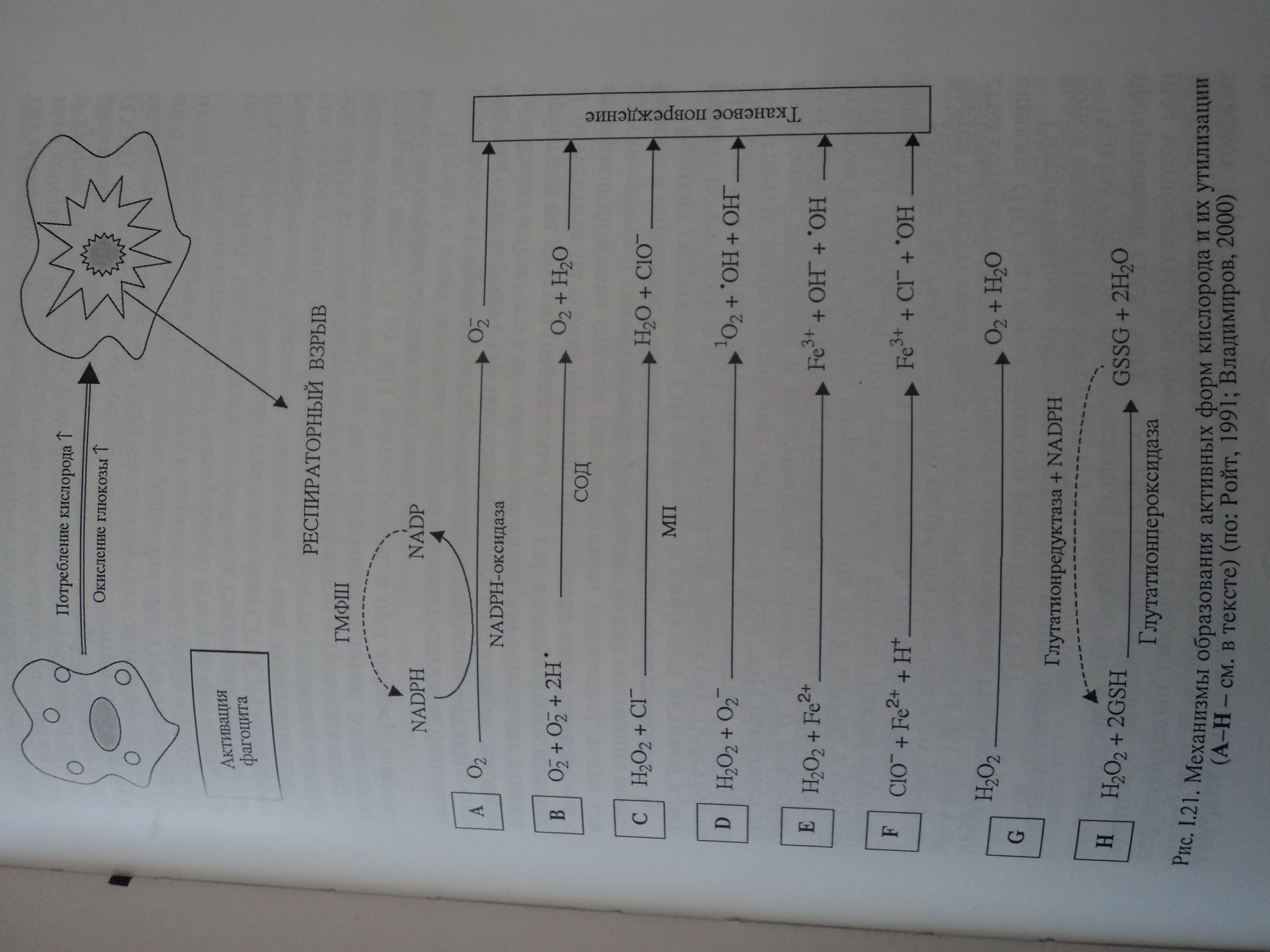
3.Нарушение микроциркуляции в очаге воспаления
Микроциркуляторная система выполняет роль материального обеспечения тканей и органов в соответствии с морфофизиологическими особенностями и конкретным состоянием их функции. Компоненты этой системы перестраиваются соответственно потребностям организма в процессе заболевания, эти изменения часто сохраняются и в периоде ремиссии патологического процесса.
А. Ж. Чернух и соавторы в (1975) находят, что наиболее частой причиной нарушений микроциркуляции является патологическое повышение проницаемости кровеносных сосудов. Нарушения микроциркуляции при пневмонии во многом определяют характер воспалительных изменений в легких, нормальное разрешение пневмонии или развитие осложнений. В остром периоде крупозной и менее резко при очаговой пневмонии в зоне воспаления происходят выраженные нарушения микроциркуляции. Наблюдаются повышение коагулирующих свойств крови, образование особого вида фибрина (стабилизированный фибрин), не поддающегося ферментативному фибринолизу, действию протеиназ, который в дальнейшем расходуется на образование склеротической ткани. Кроме того, отмечается высокая активность ингибиторов фибринолиза: антитрипсина, макроглобулина. Одновременно обнаруживается резкое угнетение ферментного и неферментного фибринолиза. Обращают на себя внимание и другие изменения. В этом периоде болезни в связи с нарушением микроциркуляции в очаге воспаления происходят внутрисосудистое свертывание крови, образование местных микротромбов и микроэмболов. Эти реакции направлены на отграничение очага воспаления от здоровых участков легочной ткани. По мере стабилизации и разрешения пневмонии в большинстве случаев уже к концу первой недели заболевания повышенная свертываемость крови сменяется кратковременным усилением процессов ферментного и неферментного фибринолиза и при благоприятном течении болезни нормализацией активности свертывающей системы. Эти изменения направлены на полное восстановление структуры легочной ткани на месте бывшего очага поражения. В отличие от этого при затяжной пневмонии процессы фибринолиза протекают менее благоприятно, возможно развитие склеротической ткани, деформирующей структуру легких (пневмосклероз). Микроциркуляторные нарушения могут способствовать легочной деструкции. В некоторых случаях микроциркуляторные нарушения не ограничиваются очагом воспаления, и тогда они могут играть важную роль в патогенезе осложнений пневмонии (острая дыхательная недостаточность, шоковое легкое, инфекционно - токсический шок).
Механизмы артериальной гиперемии. Значение артериальной гиперемии для организма
В развитии артериальной гиперемии выделяют несколько механизмов. Артериальное полнокровие может возникать рефлекторно при раздражении разнообразных интеро- и экстерорецепторов, стимуляции соответствующих центральных нейронов и возбуждении сосудорасширяющих, например парасимпатических, нервов. Артериальная гиперемия данной природы возникает на лице и шее при воспалении легких, зубной боли, сильных эмоциональных напряжениях (нейротоническая гиперемия); она формируется при повреждении сосудосуживающих нервов (нейропаралитическая гиперемия). Например, Клод Бернар описал триаду, возникающую при повреждении звездчатого ганглия у кролика, — артериальная гиперемия на ухе, западение глазного яблока (энофтальм) и сужение зрачка (миоз) на одноименной стороне. Подобное же явление может возникать у человека при травматическом или инфекционном поражении звездчатого ганглия.
Данный механизм принимает участие в формировании артериальной гиперемии при воспалении, действии ультрафиолетового излучения и других состояниях. Нейропаралитическая артериальная гиперемия обеспечивает положительный эффект при хирургическом лечении облитерирующего эндартериита. С целью расширения артерий и улучшения кровоснабжения нижних конечностей у больных удаляют адвентициальный слой сосудов, где проходят сосудосуживающие нервные волокна.
При воспалении, постишемических и других состояниях артериальная гиперемия развивается вследствие действия гуморального механизма. Данный механизм включается при усиленном высвобождении кининов (брадикинин, каллидин), гистамина, некоторых простагландинов. Определенное значение в развитии такой гиперемии могут иметь аденозин, АДФ, молочная кислота, ионы Н+ и К+, которые расширяют мелкие артерии.
Ее проявления хорошо видны на поверхности кожи или слизистых оболочек: наблюдается покраснение ткани, связанное с возрастанием притока оксигемоглобина, имеющего розовый цвет, и артериализацией венозной крови. Хорошо видны расширенные артериальные сосуды разного калибра, создающие яркую сосудистую сеть. Температура ткани увеличивается вследствие перераспределения крови, если эта зона находится в коже, но главным образом вследствие усиления в ткани окислительных процессов.
Для артериальной гиперемии характерно увеличение тургора (напряжения) тканей вследствие переполнения сосудов кровью и усиленного выхода жидкости из микрососудов в ткань. Возникает усиленная пульсация артерий. При микроскопии участка ткани наблюдаются расширение артериол и увеличение скорости кровотока в капиллярах. Гидродинамическое давление в артериолах и капиллярах возрастает, увеличивается число истинных капилляров.
Обычно артериальная гиперемия имеет положительное значение как в нормальных, так и в патологических условиях. Она обеспечивает органы большим количеством кислорода, разнообразных субстратов, витаминов и других небходимых веществ. При усиленных эндокринных реакциях артериальная гиперемия определяет повышенный приток предшественников гормонов, а также регуляторов их синтеза и высвобождения. В случае возбуждения центральных нейронов она обеспечивает высокий уровень кровоснабжения мозга и т.п. Артериальная гиперемия, возникающая после ишемии, устраняет ее неблагоприятные последствия. В этой связи в медицинской практике широко используются грелки, горчичники, скипидар, банки, лекарственные спазмолитики и т.п.
Вместе с тем артериальная гиперемия в условиях патологии может иметь негативные последствия. При патологической артериальной гиперемии вследствие избыточного расширения артериальных сосудов и повышения давления возможны их разрывы и кровоизлияния. Она может стать причиной распространения инфекционных агентов и развития сепсиса, усиленного образования и чрезмерного выхода из эндокринных желез большого количества гормонов (например, тиреотоксический криз), избыточной активации свободнорадикальных процессов и повреждения мембран паренхиматозных клеток. Иначе говоря, неадекватная артериальная гиперемия может стать причиной других патологических процессов в организме.
По мере нарастания воспалительного процесса артериальная гиперемия сменяется венозной. Венозная гиперемия характеризуется дальнейшим расширением сосудов, замедлением кровотока, феноменом краевого стояния лейкоцитов и их эмиграцией, развитием экссудации, нарушением реологических свойств крови. Факторы, влияющие на переход артериальной гиперемии в венозную можно разделить на две группы – внутрисосудистые и внесосудистые. К внутрисосудистым факторам относятся сгущение крови вследствие перехода жидкой части плазмы из крови в воспаленную ткань, набухание эндотелия в кислой среде, пристеночное стояние лейкоцитов, образование микротромбов вследствие агрегации тромбоцитов и увеличения свертываемости крови. Внесосудистые факторы – это избыточное накопление в очаге воспаления медиаторов воспаления с сосудорасширяющим действием, ионов водорода, сдавление экссудатом стенок вен и лимфатических сосудов.
ВЕНОЗНЫЙ ЗАСТОЙ КРОВИ (ВЕНОЗНАЯ ГИПЕРЕМИЯ)
Венозный застой крови (или венозная гиперемия) - увеличение кровенаполнения органа или ткани вследствие нарушения оттока крови в венозную систему.
Причины венозного застоя крови
Венозный застой крови возникает вследствие механических препятствий для оттока крови из микроциркуляторного русла в венозную систему. Это бывает только при условии, когда отток крови по коллатеральным венозным путям недостаточен.
Увеличение сопротивления кровотоку в венах может быть вызвано следующими причинами: 1) тромбозом и эмболией вен, препятствующими оттоку крови; 2)повышением давления в крупных венах (например, вследствие правожелудочковой сердечной недостаточности), что приводит к недостаточной артериовенозной разности давлений; 3) сдавлением вен, которое происходит относительно легко ввиду тонкости их стенок и сравнительно низкого внутрисосудистого давления (например, сдавление вен разросшейся опухолью, увеличенной маткой при беременности, рубцом, экссудатом, отеком ткани, спайкой, лигатурой, жгутом).
В венозной системе коллатеральный отток крови происходит сравнительно легко благодаря тому, что она содержит во многих органах большое количество анастомозов. При длительном венозном застое коллатеральные пути венозного оттока могут подвергаться дальнейшему развитию. Например, при сдавлении или сужении просвета воротной вены или при циррозе печени отток венозной крови в нижнюю полую вену происходит по развившимся коллатералям вен в нижней части пищевода, вен брюшной стенки и т.д.
Благодаря быстрому оттоку крови по коллатералям закупорка основных вен часто не сопровождается венозным застоем крови или же он бывает незначительным и держится недолго. Лишь при недостаточном коллатеральном оттоке крови препятствия для кровотока в венах приводят к значительному венозному застою крови.
Микроциркуляция в области венозного застоя крови
Кровяное давление в венах повышается непосредственно перед препятствием кровотоку. Это ведет к уменьшению артериовенозной разности давлений и к замедлению кровотока в мелких артериях, капиллярах и венах. Если отток крови в венозную систему полностью прекращается, то давление перед препятствием возрастает настолько, что достигает диастолического давления в артериях, приносящих кровь в данный орган. В этих случаях кровоток в сосудах останавливается во время диастолы сердца и опять начинается во время каждой систолы. Такое течение крови называется толчкообразным. Если же давление в венах перед препятствием повышается еще больше, превышая диастолическое давление в при-
водящих артериях, то ортоградный ток крови (имеющий нормальное направление) наблюдается только во время систол сердца, а во время диастол из-за извращения градиента давления в сосудах (вблизи вен оно становится выше, чем вблизи артерий) наступает ретроградный, т.е. обратный, ток крови. Такой кровоток в органах называется маятникообразным. Маятникообразное движение крови обычно завершается развитием стаза в сосудах, который называется венозным (застойным).
Повышенное внутрисосудистое давление растягивает сосуды и вызывает их расширение. Больше всего расширяются вены там, где повышение давления наиболее выражено, радиус относительно велик и стенки сравнительно тонки. При венозном застое становятся шире все функционирующие вены, а также раскрываются те венозные сосуды, которые до этого не функционировали. Капилляры также расширяются, преимущественно в венозных отделах, так как степень повышения давления здесь больше и стенка более растяжима, чем вблизи артериол.
Хотя площадь поперечного сечения сосудистого русла органа при венозном застое увеличивается, линейная скорость кровотока падает значительно больше и поэтому объемная скорость кровотока оказывается закономерно уменьшенной. Таким образом, микроциркуляция в органе и кровоснабжение тканей при венозном застое крови ослабляются, несмотря на расширение капиллярного русла и повышение внутрисосудистого давления.
Зависимость разных параметров микроциркуляции при венозном застое крови представлена на рис. 9-4.
Симптомы венозного застоя крови
Симптомы венозного застоя крови зависят главным образом от уменьшения интенсивности кровотока в микроциркуляторном русле, а также от увеличения его кровенаполнения.
Уменьшение объемной скорости кровотока при венозном застое означает, что меньшее количество кислорода и питательных веществ приносится с кровью в орган, а продукты обмена веществ не удаляются полностью. Поэтому ткани испытывают дефицит кровоснабжения и прежде всего кислородную недостаточность, т.е. гипоксию (циркуляторного характера). Это, в свою очередь, ведет к нарушению нормального функционирования тканей. Вследствие уменьшения интенсивности кровотока в органе к нему приносится
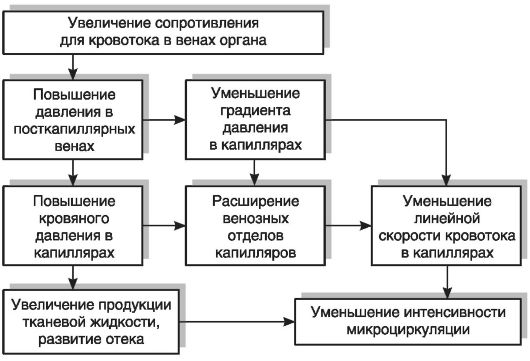 Рис.
9-4. Изменения
микроциркуляции при венозном застое
меньше тепла, чем обычно. В поверхностно
расположенных органах это вызывает
нарушение баланса между количеством
тепла, приносимого с кровью и отдаваемого
в окружающую среду. Поэтому температура их
при венозном застое понижается. Во
внутренних же органах этого не происходит,
так как теплоотдача из них в окружающую
среду отсутствует.
Рис.
9-4. Изменения
микроциркуляции при венозном застое
меньше тепла, чем обычно. В поверхностно
расположенных органах это вызывает
нарушение баланса между количеством
тепла, приносимого с кровью и отдаваемого
в окружающую среду. Поэтому температура их
при венозном застое понижается. Во
внутренних же органах этого не происходит,
так как теплоотдача из них в окружающую
среду отсутствует.
Повышение кровяного давления внутри капилляров обусловливает усиление фильтрации жидкости через стенки капилляров в тканевые щели и уменьшение ее резорбции обратно в кровеносную систему, что означает усиление транссудации. Проницаемость стенок капилляров увеличивается, также способствуя усиленной транссудации жидкости в тканевые щели. Механические свойства соединительной ткани при этом изменяются таким образом, что ее растяжимость растет, а упругость падает. В результате этого вышедший из капилляров транссудат легко растягивает щели и, накапливаясь в них в значительном количестве, вызывает отек тканей. Объем органа при венозном застое увеличивается как за счет увеличения его кровенаполнения, так и вследствие образования отека. Непосредственным результатом венозной гиперемии, кроме отеков, может быть развитие водянок (например, асцита).
Так как кровоток в капиллярах при венозном застое резко замедляется, кислород крови максимально используется тканями, артериоло-венулярная разница по кислороду увеличивается, и большая часть гемоглобина крови оказывается восстановленной. Поэтому орган или ткань приобретает синюшный оттенок (цианоз), так как темно-вишневый цвет восстановленного гемоглобина, просвечивая через тонкий слой эпидермиса, приобретает голубоватый оттенок.
Венозная гиперемия приводит к развитию гипоксии тканей с последующим некрозом морфологических элементов ткани. При длительной венозной гиперемии высока вероятность замещения морфологических элементов органа или ткани соединительной тканью. При заболеваниях печени хроническая венозная гиперемия формирует картину «мускатной» печени. Хроническая венозная гиперемия легких ведет к их бурой индурации. Венозная гиперемия селезенки при портальной гипертензии вследствие цирроза печени проявляется спленомегалией.
5.











6.Механизмы развития пролиферации в очаге воспаления
Пролиферация является завершающей фазой развития воспаления, обеспечивающей репаративную регенерацию тканей на месте очага альтерации. Пролиферация развивается с самого начала воспаления наряду с явлениями альтерации и экссудации.
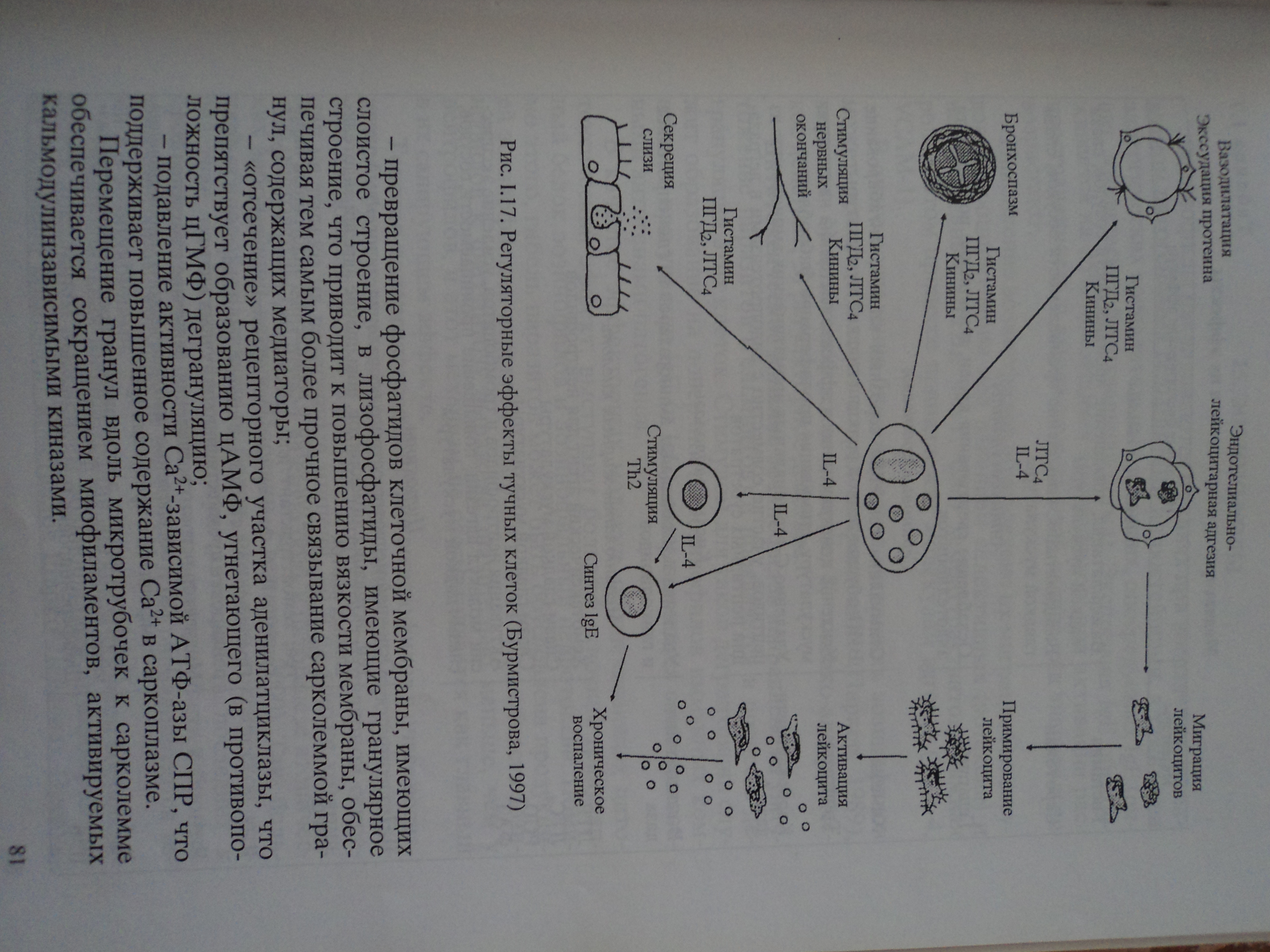
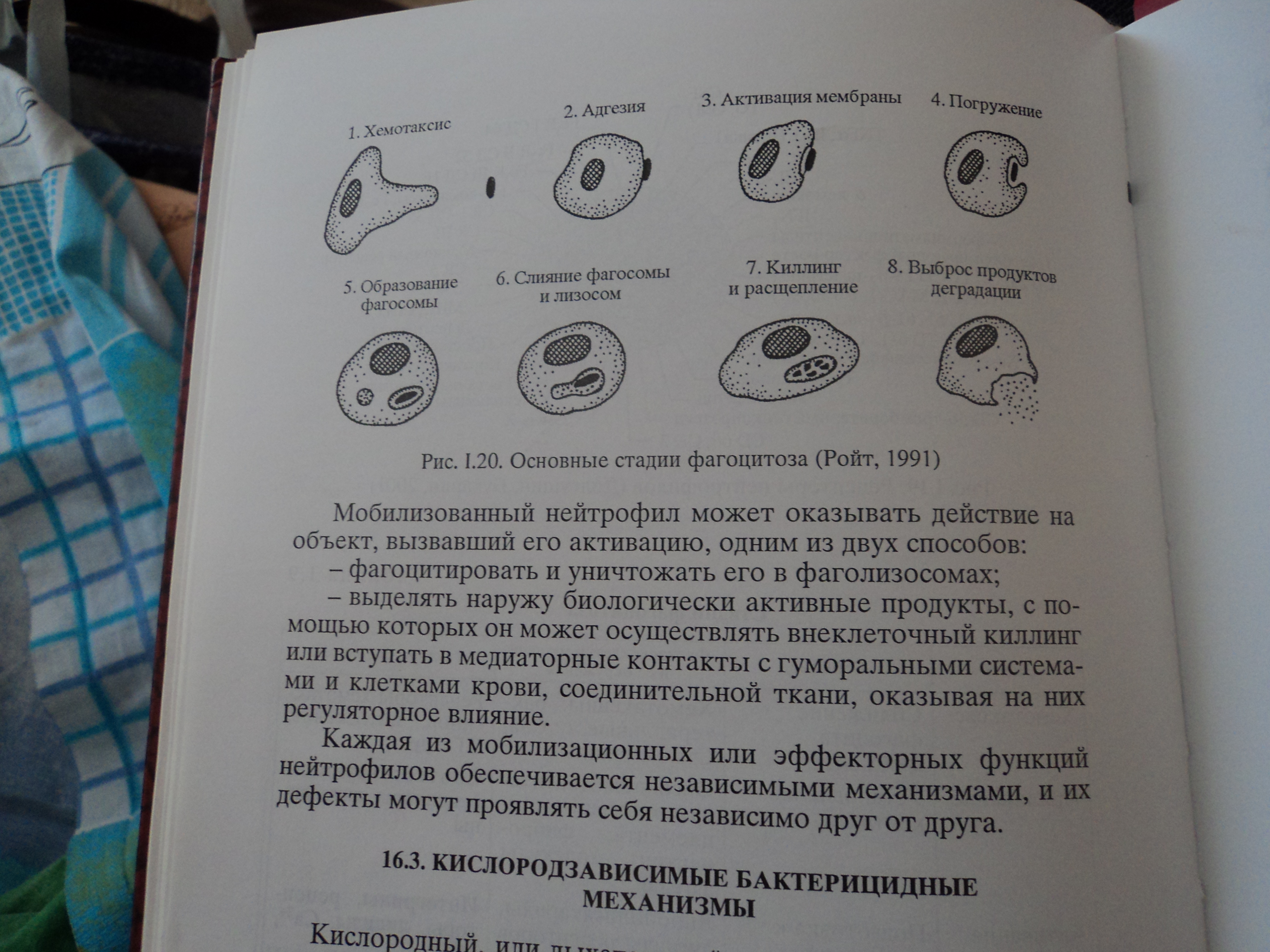
При репаративных процессах в очаге воспаления регенерация клеток и фиброплазия достигаются как активацией процессов пролиферации, так и ограничением апоптоза клеток. Размножение клеточных элементов начинается по периферии зоны воспаления, в то время как в центре очага могут еще прогрессировать явления альтерации и некроза. Полного развития пролиферация соединительнотканных и органоспецифических клеточных элементов достигает после «очистки» зоны повреждения от клеточного детрита и инфекционных возбудителей воспаления тканевыми макрофагами и нейтрофилами. В связи с этим следует отметить, что процессу пролиферации предшествует формирование нейтрофильного и моноцитарного барьеров, которые формируются по периферии зоны альтерации.
Восстановление и замещение поврежденных тканей начинается с выхода из сосудов молекул фибриногена и образования фибрина, который формирует своеобразную сетку, каркас для последующего клеточного размножения. Уже по этому каркасу распределяются в очаге репарации быстро образующиеся фибробласты. Деление, рост и перемещение фибробластов возможны только после их связывания с фибрином или коллагеновыми волокнами. Эта связь обеспечивается особым белком – фибронектином. Размножение фибробластов начинается по периферии зоны воспаления, обеспечивая формирование фибробластического барьера. Хемотаксис, активация и пролиферация фибробластов осуществляются под воздействием:
1. Факторов роста фибробластов.
2. Тромбоцитарного фактора роста.
3. Цитокинов - ФНО, ИЛ-1.
4. Кининов.
5. Тромбина.
6. Трансформирующего фактора роста b.
Сначала фибробласты не зрелые и не обладают достаточной синтетической активностью. Созреванию предшествует внутренняя структурно-функциональная перестройка фибробластов: гипертрофия ядра и ядрышка, гиперплазия ЭПС, повышение содержания ферментов, особенно щелочной фосфатазы, неспецифической эстеразы, b-глюкуронидазы. Только после перестройки фибробласты начинают синтезировать коллаген, эластин, коллагенассоциированные белки и протеогликаны. Коллагеногенез стимулируется следующими биологически активными веществами - ФНО, ИЛ-1, ИЛ-4, фактором роста фибробластов, тромбоцитарным фактором роста.
Интенсивно размножающиеся фибробласты продуцируют кислые мукополисахариды – основной компонент межклеточного вещества соединительной ткани (гиалуроновую кислоту, хондроитинсерную кислоту, глюкозамин, галактозамин). При этом зона воспаления не только инкапсулируется, но и начинаются постепенная миграция клеточных и бесклеточных компонентов соединительной ткани от периферии к центру, формирование соединительнотканного остова на месте первичной и вторичной альтерации.
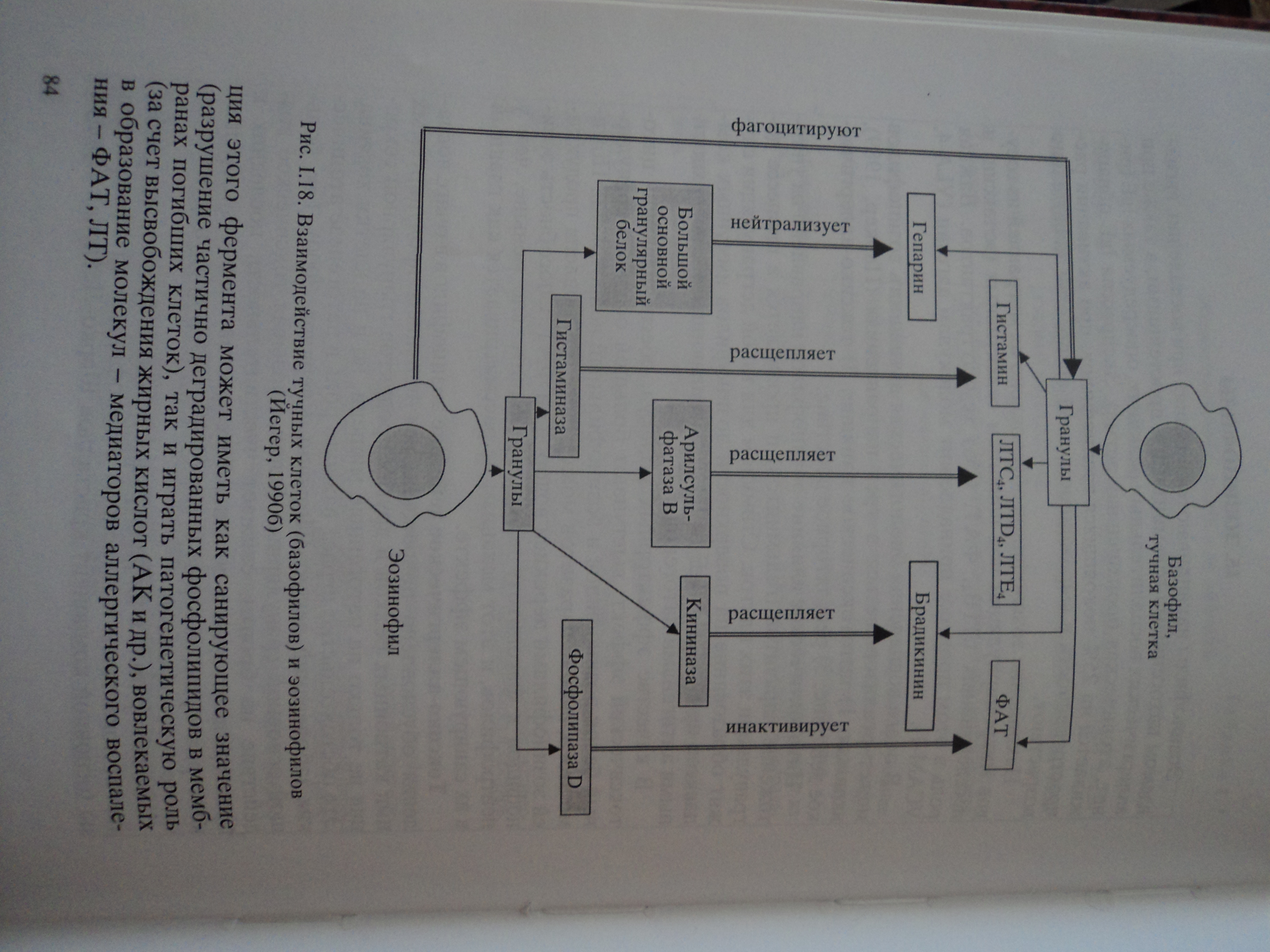
Наряду с фибробластами размножаются и другие тканевые и гематогенные клетки. При разрушении базальных мембран сосудов в зоне альтерации происходит миграция клеток эндотелия по градиенту ангиогенных факторов. Просвет новообразующегося капилляра формируется путем слияния внеклеточных пространств соседних эндотелиоцитов. Вокруг новообразующихся капилляров концентрируются тучные клетки, макрофаги, нейтрофилы, которые освобождают биологически активные вещества, способствующие пролиферации капилляров.
Важнейшими факторами, стимулирующими ангиогенез, являются:
1. Факторы роста фибробластов (основной и кислый).
2. Сосудистый эндотелиальный фактор роста.
3. Трансформирующие факторы роста
4. Эпидермальный фактор роста.
Фибробласты вместе с вновь образованными сосудами создают грануляционную ткань. Это, по существу, молодая соединительная ткань, богатая клетками и тонкостенными капиллярами, петли которых выступают над поверхностью ткани в виде гранул.
Основными функциями грануляционной ткани являются: защитная – предотвращение влияния факторов окружающей среды на очаг воспаления и репаративная – заполнение дефекта и восстановление анатомической и функциональной полноценности поврежденных тканей.
Формирование грануляционной ткани не строго обязательно. Это зависит от величины и глубины повреждения. Грануляционная ткань обычно не развивается при заживлении ушибленных кожных ранок или мелких повреждений слизистой оболочки. Грануляционная ткань постепенно превращается в волокнистую ткань, называемую рубцом. В рубцовой ткани уменьшается количество сосудов, они запустевают, уменьшается количество макрофагов, тучных клеток, снижается активность фибробластов. Небольшая часть клеточных элементов, располагающаяся среди коллагеновых нитей, сохраняет активность. Предполагают, что сохранившие активность тканевые макрофаги принимают участие в рассасывании рубцовой ткани и обеспечивают формирование более мягких рубцов.
Параллельно с созреванием грануляций происходит эпителизация раны. Она начинается в первые часы после повреждения, и уже в течение первых суток образуются 2-4 слоя клеток базального эпителия. Скорость эпителизации обеспечивается следующими процессами: миграцией, делением и дифференцировкой клеток. Эпителизация небольших ран осуществляется, в основном, за счет миграции клеток из базального слоя. Раны более крупные эпителизируются за счет миграции и митотического деления клеток базального слоя, а также дифференцировки регенерирующего эпидермиса. Новый эпителий образует границу между поврежденным и подлежащим слоем, он препятствует обезвоживанию тканей раны, уменьшению в ней электролитов и белков, а также предупреждает инвазию микроорганизмов.
В процессе пролиферации участвуют и органоспецифические клеточные элементы органов и тканей. С точки зрения возможностей пролиферации органоспецифических клеточных элементов все органы и ткани могут быть рас-классифицированы на три группы:
К первой группе могут быть отнесены органы и ткани, клеточные элементы которых обладают активной или практически неограниченной пролиферацией, достаточной для полного восполнения дефекта структуры в зоне воспаления (эпителий кожи, слизистых оболочек дыхательных путей, слизистой желудочно-кишечного тракта, мочеполовой системы; гемопоэтическая ткань и др.).
Ко второй группе относятся ткани с ограниченными регенерационными способностями (сухожилия, хрящи, связки, костная ткань, периферические нервные волокна).
К третьей группе относятся те органы и ткани, где органоспецифические клеточные элементы не способны к пролиферации (сердечная мышца, клетки ЦНС). Основными факторами, регулирующими процессы пролиферации и дифференцировки клеток в очаге воспаления, являются:
1. Факторы роста, продуцируемые макрофагами, лимфоцитами, тромбоцитами, фибробластами и другими клетками, стимулированными в зоне воспаления. К ним относятся:
- факторы роста эпидермиса (стимулятор пролиферации и созревания эпителия, стимулятор ангиогенеза);
(стимулятор ангиогенеза);- трансформирующий фактор роста-
(хемоаттрактант фибробластов, стимулятор синтеза коллагена, фибронектина, ангиогенеза, ингибитор протеолиза);- трансформирующий фактор роста-
- тромбоцитарный фактор роста (стимулятор миграции, пролиферации и синтеза белка в клетках-мишенях, обладает провоспалительным эффектом);
- фактор роста эндотелиоцитов;
- фактор роста фибробластов кислый и основной (стимуляторы пролиферации всех клеток сосудистой стенки);
- колониестимулирующие факторы (гранулоцитарный и макрофагальный стимуляторы дифференцировки, пролиферации и функциональной активности клеток гранулоцитарного и моноцитарного ряда) - цитокины (ФНО, ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-- интерферон (Зайчик А.Ш., Чурилов Л.П., 1999); и 5, ИЛ-6, ИЛ-7) , продуцируемые Т- и В-лимфоцитами, мононуклеарами, тучными клетками, фибробластами, эндотелиоцитами, обеспечивают хемотаксис, фиброгенез, ингибируют апоптоз, стимулируют процессы пролиферации в очаге воспаления. Ингибиторами роста для некоторых клеток служат те же цитокины, которые стимулируют пролиферацию других – это ФНО, трансформирующий фактор роста
- фактор роста нервов (стимулятор пролиферации, роста, морфогенеза симпатических нейронов, эпителиальных клеток). Ростовые факторы, взаимодействуя с рецепторами на клетках- мишенях, могут непосредственно стимулировать синтез ДНК в клетках или подготавливать внутриклеточные рецепторы и ферменты к митотической деятельности.
2. Пептид гена, родственного кальцитонину, стимулирует пролиферацию эндотелиальных клеток, а субстанция Р индуцирует выработку ФНО в макрофагах.
3. Простагландины группы Е потенцируют регенерацию путем усиления кровоснабжения.
4. Кейлоны и антикейлоны, продуцируемые различными клетками, действуя по принципу обратной связи, могут активировать и угнетать митотические процессы в очаге воспаления.
5. Полиамины (путресцин, спермидин, спермин), обнаруживаемые во всех клетках млекопитающих, жизненно необходимы для роста и деления клеток.
Они обеспечивают стабилизацию плазматических мембран и суперспиральной структуры ДНК, защиту ДНК от действия нуклеаз, стимуляцию транскрипции, метилирование РНК и связывание ее с рибосомами, активацию ДНК-лигаз, эндонуклеаз, протеинкиназ и многие другие клеточные процессы. Усиленный синтез полиаминов, способствующих пролиферативным процессам, отмечается в очаге альтерации .
6. Циклические нуклеотиды: цАМФ ингибирует, а цГМФ активирует процессы пролиферации.
Заживление раны.
Морфологически процесс заживления раны может протекать различно, в зависимости от анатомического субстрата поражения, степени инфицированности, общего состояния организма, характера лечебных мероприятий. Однако в любом случае течение раневого процесса отражает один из классических типов заживления:
1. Заживление первичным натяжением.
2. Заживление вторичным натяжением.
3. Заживление под струпом.
Заживление раны первичным натяжением. Такой тип заживления характеризуется сращением краев раны без видимой промежуточной ткани, путем соединительнотканной организации раневого канала. Заживление первичным натяжением является наиболее экономичным видом заживления. Для заживления первичным натяжением необходимы следующие условия:
1. Небольшая зона повреждения.
2. Плотное соприкосновение краев раны.
3. Сохранение жизнеспособности краев раны.
4. Отсутствие очагов некроза и гематомы.
5. Асептичность раны.
Морфологическая картина заживления первичным натяжением проявляется умеренной гиперемией, отеком тканей в стенках раны, пролиферацией фибробластов и новообразованием капилляров путем эндотелизации каналов и щелей в сгущающемся фибрине (аутохтонный механизм) от одного края раны к противоположному. На 6-8-й день грануляционная ткань прочно соединяет стенки раны, и в этот период прекращается эпителизация. В хирургической практике заживление первичным натяжением возможно в двух случаях: при небольших размерах раны (края отстают не более 10 мм друг от друга), а также при хирургических вмешательствах, заканчивающихся наложением швов. Местные изменения в области раны выражены незначительно (отечность краев, гиперемия, инфильтрация, боль). К общим проявлениям относится повышение температуры тела, которая постепенно снижается к 3-м суткам после операции. Изменения морфологического состава крови выражены незначительно или отсутствуют. Иногда отмечаются нейтрофильный лейкоцитоз и увеличение СОЭ до 20 мм/ч. На 5-6-е сутки эти показатели обычно нормализуются.
Заживление раны вторичным натяжением происходит при обширных повреждениях тканей, при наличии в ране нежизнеспособных тканей, гематомы и при развитии инфекции в ране. Любой из этих факторов ведет к заживлению вторичным натяжением. При различных вариантах течения заживления вторичным натяжением речь идет о заживлении гнойной раны, то есть о заживлении через нагноение и гранулирование. На 5-6-е сутки после альтерации, после отторжения некротизированных клеток в ране появляются островки грануляций, которые, постепенно разрастаясь, заполняют всю полость раны. Изменения характера грануляций всегда объективно отражают осложнения заживления, которые могут наступить под влиянием местных и общих факторов. Реорганизация рубца проявляется активной эпителиизацией раны. Эпителий нарастает на поверхность грануляций в виде голубовато-белой каймы очень медленно. Помимо эпителизации заживлению способствует феномен раневой контракции - равномерного концентрического сокращения краев и стенок раны. Этот феномен объясняется появлением в грануляционной ткани в период регенерации фибробластов, обладающих способностью к сокращению.
Заживление раны под струпом характерно для незначительных повреждений (ссадины, царапины, небольшие по площади ожоги 1-й и 2-й степени). Раневой процесс начинается свертыванием излившейся крови или только лимфы, которая подсыхает с образованием струпа. Под ним происходит быстрая регенерация эпидермиса, и струп затем отторгается. Весь процесс длится 3-7 дней. Если заживление под струпом происходит без осложнений, то рана заживает первичным натяжением; если под струпом начинается нагноение, то заживление идет по типу вторичного натяжения. В ряде случаев может развиться вялотекущее флегмонозное поражение жировой клетчатки, окружающей рану. В такой ситуации необходимы хирургическая обработка раны и удаление струпа
