- •1 Основные понятия о кристаллическом
- •1.1 Кристаллические и аморфные тела
- •1.2 Основные типы межатомных связей
- •1.3 Наиболее распространенные типы пространственных кристаллических решеток металлов
- •2 Краткие сведения о напряжениях и деформациях в твердом теле
- •2.1. Нормальные и касательные напряжения
- •2.2 Напряженное состояние
- •2.3 Деформация и деформированное состояние
- •2.4. Основные механизмы деформации
- •3 Теоретическая и реальная прочность
- •3.1. Теоретическая прочность кристаллов
- •3.2. Дефекты строения реальных кристаллических тел
- •4. Точечные дефекты
- •4.1. Разновидности точечных дефектов
- •4.2. Упругие искажения вокруг точечных дефектов
- •4.3 Подвижность точечных дефектов
- •4.4. Точечные дефекты и пластическая деформация
- •5 Линейные дефекты (дислокации)
- •5.1 Краевая дислокация
- •5.2 Подвижность краевой дислокации
- •5.3 Винтовая дислокация
- •5.4 Поперечное скольжение винтовой дислокации
- •5.5 Плотность дислокаций
- •5.6 Источники дислокаций Франка-Рида или генераторы
- •5.7 Ограничение подвижности дислокаций
- •5.8 Дислокационные реакции
- •6 Плоские дефекты
- •7 Наклеп и рекристаллизация металлов
- •6.1 Наклеп
- •7.2 Рекристаллизация
- •7.3 Формирование геометрически необходимых дислокаций при наклепе
- •8 Механизмы зарождения микротрещин в металлах и сплавах
- •8.1 Дислокационные схемы образования трещин.
- •8.2. Роль границ зерен в разрушении
- •9 Ползучесть металлов
- •10 Хладноломкость
- •11 Взаимодействие различных дефектов
1 Основные понятия о кристаллическом
строении металлов
1.1 Кристаллические и аморфные тела
"Металлы суть светлые тела, которые ковать можно" - такое определение дано великим русским ученым М.В.Ломоносовым, и оно не потеряло своего смысла до наших дней. Это свойство металлов хорошо известно из повседневной жизни. Например, медный провод блестит и расплющивается от удара молотком. Пластинка из золота прокатывается в "тончайшую фольгу. Металлы не только пластичны, но теплопроводны и электропроводны.
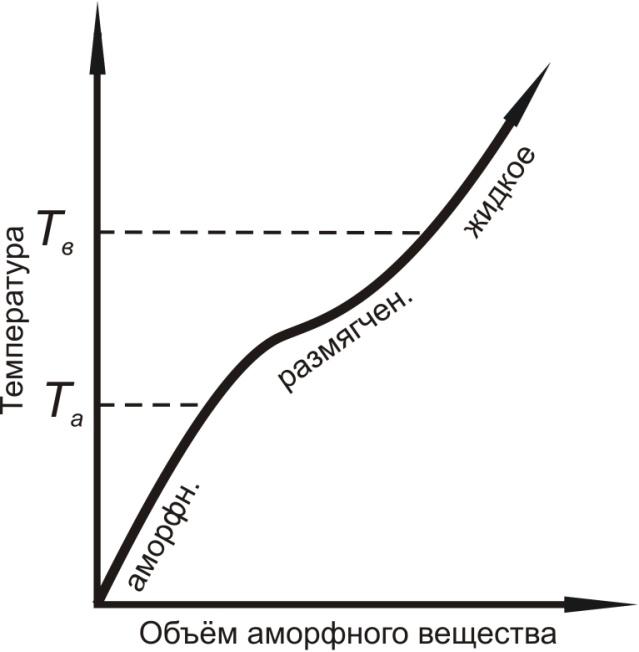
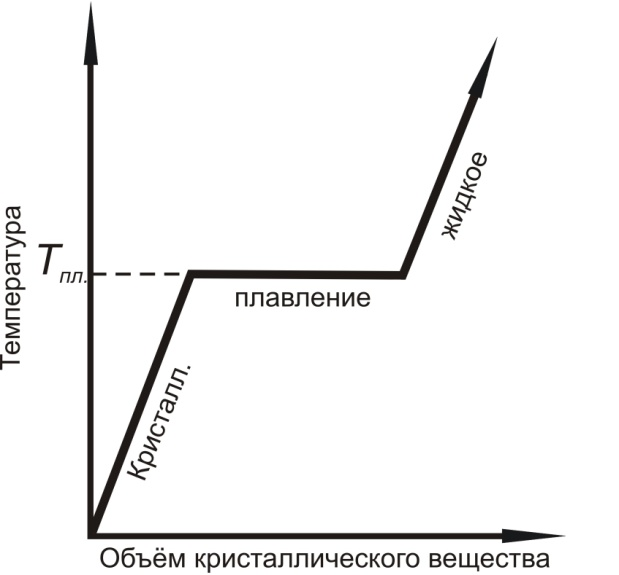
Чем объяснить эти особые свойства металлов, отличающиеся от свойств других твердых тел? Все вещества в твердом состоянии имеют либо кристаллическое, либо аморфное строение. Для аморфного вещества (стекло, смола, канифоль и др.) характерно беспорядочное расположение слагающих его материальных частиц (атомы, молекулы, ионы). В лучшем случае в нем наблюдается лишь ближний порядок в расположении материальных частиц. В кристаллическом веществе, наоборот, частицы (атомы) расположены на жестко определенных расстояниях друг от друга. В таком веществе наблюдается строгий ближний и дальний порядок в расположении атомов. Поэтому переход аморфного вещества из твердого состояния в жидкое и обратно не сопровождается скачкообразным изменением свойств, что является важным, признаком, отличающим аморфное состояние твердого вещества от кристаллического. Аморфное вещество характеризуется интервалом размягчения Та-Тв и непрерывным изменением свойств (рис.1.1 а) в отличие от кристаллического вещества, имеющего строго определенную температуру плавления Тпл, при которой происходит скачкообразное изменение свойств (рис.1.1 б).
|
|
Рис.1.1. Характер перехода аморфного (а) и кристаллического (б) вещества из твердого состояния в жидкое. |
|
1.2 Основные типы межатомных связей
Все металлы и их сплавы имеют кристаллическое строение. При затвердевании атомы металлов располагаются в определенном порядке, образуя геометрически правильные системы, называемые кристаллическими решетками. Правильное расположение атомов в металлах соответствует минимальному запасу свободной энергии и является, согласно второму закону термодинамики, более устойчивым и для конкретного кристаллического тела энергетически выгодным состоянием, чем аморфное.
Важным для оценки кристаллического строения веществ является вопрос о связи атомов и особенностях межатомного взаимодействия в кристаллической решетке. Основными типами межатомных связей в веществах являются: ионная, ковалентная и металлическая. Для рассмотрения физической природы связи следует вспомнить, что атомы сами по себе электронейтральны, т.е. число положительных зарядов ядра равно числу электронов в атоме и порядковому номеру элемента в периодической, системе Д.И.Менделеева.
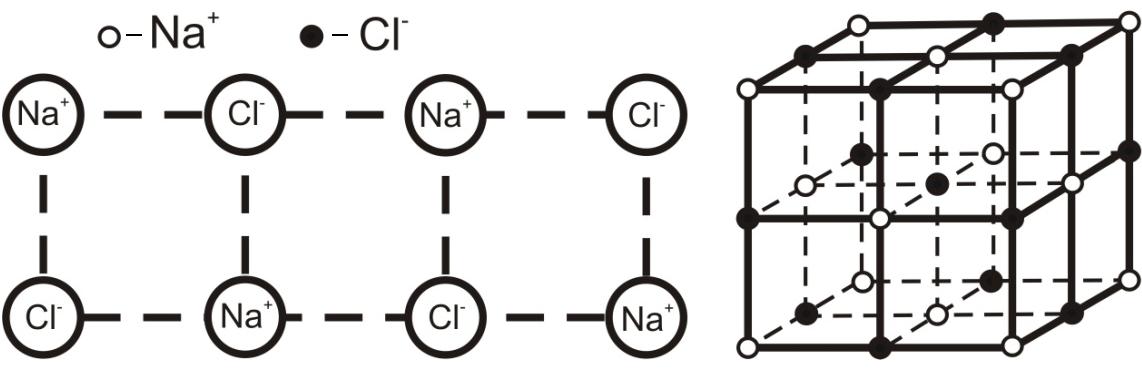
Возникновение ионной межатомной связи определяется переходом электронов от одного атома к другому и образованием положительно и отрицательно заряженных ионов (вместо прежде нейтральных атомов). Например, при взаимодействии натрия и хлора внешний электрон атома натрия переходит на электронную оболочку атома хлора. Вследствие этого равенство положительных и отрицательных зарядов в атомах натрия и хлора нарушается. Атом натрия превращается в положительно заряженный ион натрия, а атом хлора - в отрицательно заряженный ион хлора. Между разноименно заряженными ионами возникают силы электростатического взаимодействия, обуславливающие образование молекулы поваренной соли NaCl (рис 1.2) и устойчивость характерной для каменной соли кубической кристаллической решетки. Ковалентная связь определяется взаимным перекрытием внешних электронных оболочек атомов и осуществляется спаренными электронами определенных атомов, образующих данную молекулу (например, Cl2 ,O2 т.д.).
|
Рис.1.2. Формирование кубической кристаллической решетки каменной соли |
Металлическая связь, характерная для металлов и сплавов, возникает благодаря слабой связанности внешних электронов с атомами металлических элементов. Поэтому при взаимодействии атомов металлов внешние электроны "отрываются" от атомов и образуют свободный электронный газ, достаточно легко перемещающийся между положительно ионизированными атомами металла. Следовательно, металлический кристалл следует рассматривать, как состоящий из положительно заряженных ионов, располагающихся в узлах решетки, окруженных своеобразной плазмой из электронного газа.
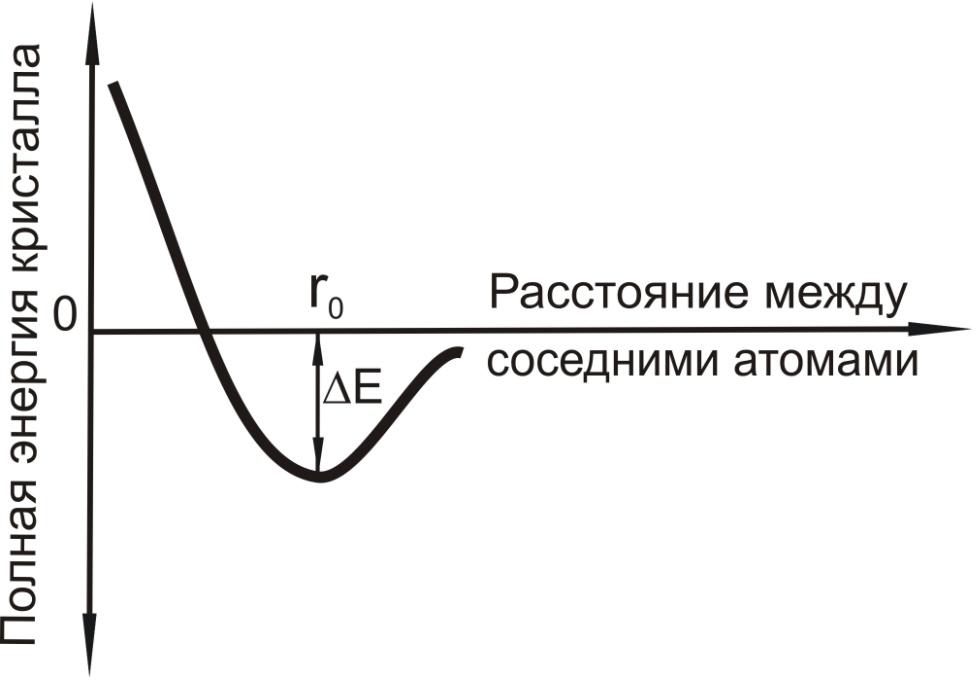
Ионы в металлах совершают непрерывные колебания высокой частоты (1013 – 1014 с-1); средняя амплитуда колебаний зависит от температуры. Металлическая связь обуславливается взаимодействием ионов и электронов. Свободные электроны притягиваются одновременно к нескольким положительно заряженным ионам, и обеспечивают связь между ними. Общая сила связи в металлах определяется силами отталкивания между ионами и электронами и силами притяжения между ионами и свободными электронами. Атомы стремятся расположиться на таком расстоянии друг от друга, чтобы энергия их взаимодействия была минимальной (рис.1.3). Этому положению соответствует расстояние r0, где величина
|
энергии кристалла ∆E минимальная. Чтобы сблизить атомы (ионы) на расстояние меньше r0, или удалить на расстояние больше равновесного r0, необходимо совершить определенную работу против сил отталкивания или притяжения, что приведет к повышению уровня внутренней энергии кристалла. Согласно второ- |
Рис.1.3. Зависимость энергии связи между двумя атомами от расстояния между ними |
му началу термодинамики такая система будет самопроизвольно удерживать атомы в положении r0. Поэтому в условиях равновесия атомы (ионы) располагаются закономерно, образуя правильную кристаллическую решетку, что соответствует минимальной энергии взаимодействия атомов. Важно отметить, что средние расстояния между атомами в кристаллической решетке весьма строго выдерживаются для каждого вещества.