
- •Кислотно-основное состояние
- •Внутриклеточные и внеклеточные буферные системы
- •Бикарбонатная буферная система
- •Фосфатная буферная система.
- •Гемоглобиновая буферная система
- •Органная регуляция кос
- •2. Почечные контрольные механизмы
- •Выведение ионов водорода и обмен их на ионы натрия
- •Ацидогенез
- •Аммониогенез
- •Основные показатели кос крови
- •Формы нарушений кос
- •Ацидоз негазовый ацидоз Метаболический ацидоз
- •Алгоритм лабораторной диагностики ацидоза
- •Алкалоз
- •Sb 39,3 ммоль/л
- •Алгоритм лабораторной диагностики алкалоза
- •Алгоритм лабораторной диагностики кос при нормальном рН крови
Кислотно-основное состояние
Кислотно-основное состояние является одним из важнейших компонентов гомеостаза.
Метаболическая активность организма обеспечивается четкой регуляцией кислотно-основного равновесия, отражением которого является рН внеклеточных жидкостей. Возбудимость мембран, активность ферментных систем, течение химических реакциий зависят от баланса кислот и оснований. Оптимальный режим функционирования физиологических процессов реализуется только в ограниченном диапазоне колебаний значений рН. Многие факторы, в том числе и патологические, могут изменять концентрацию ионов Н+ во внеклеточных жидкостях.
Взаимодействие кислот и оснований и их влияние на рН крови описывает уравнение Гендерсона-Гассельбаха:
![]()
где К – константа диссоциации, которая определяет способность отдавать протоны.
Так как К и соответственно рК постоянны при определенной температуре, то
![]()
рН – один из самых «жестких» параметров крови. Его колебания крайне незначительны: от 7,36 до 7, 44; рН артериальной крови составляет 7,35-7,45; венозной – 7,32 – 7,42. Отклонение рН за эти границы рассматривается как нарушение КОС. Даже слабо выраженные изменения этого показателя приводят к существенным сдвигам окислительно-восстановительных процессов, изменению активности ферментов, проницаемости клеточных мембран и другим нарушениям, опасным для нормального функционирования организма. Жизнеспособность человека сохраняется при рН крови от 6,8 до 7,7.
Концентрация ионов водорода поддается влиянию многочисленных факторов:
экзогенных (пищевые продукты);
эндогенному образованию физиологических продуктов обмена веществ, как результат жизнедеятельности клетки или образования молочной кислоты при мышечной деятельности;
эндогенному образованию нефизиологических кислот, например, при хроническом брожении в кишечнике вследствие дисбактериоза, или в результате постоянного патологического образования кислоты при дисфункции органов, например, при диабете;
выведению кислот и щелочей в результате обменной деятельности почек и кишечника;
выделению углекислоты через легкие;
эндогенному физиологическому образованию большого количества соляной кислоты в обкладочных клетках желудка, что оказывает доминирующее влияние на КОС организма;
уровеню оксигенации крови и состоянию гемодинамики;
интенсивности метаболических процессов и др.
Химия кислот и оснований
Понятие кислоты и основания было введено в медицинскую практику Bronsted в 1923 году. В соответствии с предложенным им определением кислотой является вещество, способное отдавать ион водорода, а основанием – вещество, способное присоединять ион водорода. При добавлении кислоты к воде, она обратимо диссоциирует, образуя Н+ и анионы (Аˉ); например, Н+ + Аˉ. Степень до которой диссоциирует кислота и действует как донор иона Н+ определяется силой или слабостью кислоты. Сильные кислоты, такие как серная кислота, диссоциируют полностью; слабые кислоты, такие как уксусная кислота, диссоциируют только в ограниченных пределах. Вышесказанное верно и для оснований и их способности диссоциировать и акцептировать ион водорода. Большинство кислот и оснований организма - слабые кислоты и основания; наиболее значимые - угольная кислота (Н2СО3), которая является слабой кислотой, образующейся из двуокиси углерода (СО2), и бикарбонат (НСО3ˉ ), который является слабым основанием.
Кислотность или щелочность раствора зависит от концентрации в нем протонов, причем концентрация может изменяться на несколько порядков величин. Концентрация Н+ ионов в жидкостях организма не сопоставима с таковой для других ионов. Например, концентрация ионов натрия (Na+) приблизительно в 1 миллион раз выше, чем концентрация Н+. Поскольку концентрация ионов водорода очень низка, (в норме концентрация водородных ионов в циркулирующей крови при рН=7,4 составляет 4010-9 ммоль/л), то ее обычно выражают в единицах рН (power Hydrogene – сила водорода). рН представляет собой отрицательный десятичный логарифм (р) концентрации ионов Н+ в миллиэквивалентах на литр; значение рН, равное 7,0 соответствует концентрации ионов Н+ в 10ˉ7 (0,0000001) эквивалентов на литр (mEq/L).
![]()
рН обратно связан с концентрацией ионов Н+; низкий рН свидетельствует о высоком содержании ионов Н+, высокий рН – о низком уровне ионов Н+.
Точно определить рН во внутриклеточной жидкости невозможно; по данным, полученным с помощью большинства существующих методов, эта величина в среднем составляет 6,9. Концентрация ионов водорода неравномерна не только в цитоплазме, но и в пределах органелл одной клетки.
Константа диссоциации (К) используется для описания степени, до которой кислота и основание диссоциируют. рКа - отрицательный десятичный логарифм константы диссоциации для кислоты. Он равен значению рН, при котором кислота диссоциирована на 50%. Использование отрицательного десятичного логарифма для констант диссоциации позволяет выражать рН в положительных значениях. Каждая кислота в водном растворе имеет определенный рК, незначительно варьирующий при изменении температуры и рН. При нормальной температуре тела, рКа для НСО3ˉ буферной системы внеклеточной жидкости составляет 6,1.
Все кислоты, основания и соли в растворах диссоциируют на разноименно заряженные ионы. Определенная группа веществ может диссоциировать в зависимости от рН среды. Эти вещества называют амфотерными электролитами или амфолитами. В щелочном растворе они ведут себя как кислоты и являются донорами Н+, в кислом растворе способны связывать Н+ и проявляют свойства оснований. К амфолитам относятся белки крови человека. Реакция крови человека слабощелочная, поэтому белки ведут себя как слабые кислоты.
Обмен кислот и оснований в организме тесно связан с обменом воды и электролитов. Все эти процессы объединены законом электронейтральности и изоосмолярности. Электронейтральность плазмы сохраняется благодаря постоянному равновесию катионов и анионов. Это означает, что изменение концентрации одного из ионов неизбежно влечет за собой адекватные сдвиги в концентрации других ионов (катионов или анионов). Например, уменьшение содержания хлора приводит либо к увеличению концентрации другого аниона (чаще бикарбоната), либо к соответствующему уменьшению (выведению из организма) катиона натрия.
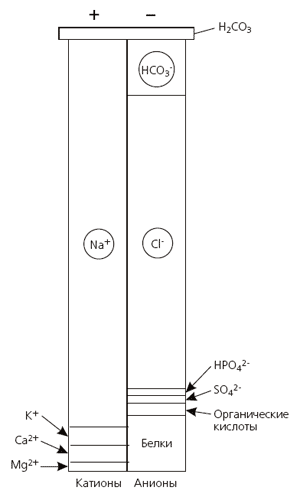
Рис.1. Ионный состав плазмы.
Для плазмы крови закон электронейтральности проявляется в том, что концентрация катионов и анионов равна, составляя соответственно по 155 ммоль/л. Следовательно, суммарно Росм плазмы равно 310 ммоль/л. Из общего количества катионов плазмы на долю натрия приходится 142 ммоль/л. В группе анионов 103 ммоль/л составляют ионы хлора (слабое основание). Бикарбонат и белки представляют собой сильные буферные основания. На их долю приходится соответственно 27 моль/л и 15 ммоль/л.
В норме концентрация бикарбоната (НСО3ˉ) в плазме крови в 20 раз выше, чем угольной кислоты (Н2СО3). Именно при таком соотношении НСО3ˉ и Н2СО3 сохраняется рН, равный 7,4. Если изменяется концентрация бикарбоната или углекислоты, меняется их соотношение и происходит сдвиг рН в кислую (ацидоз) или щелочную (алкалоз) сторону. В этих условиях нормализация рН происходит за счет действия ряда компенсаторных регуляторных механизмов, восстанавливающих прежнее соотношение кислот и оснований в плазме крови, а также в различных органах и тканях.
Разность между измеряемыми концентрациями основных катионов (натрий и калий) и анионов (хлор и бикарбонат) плазмы называется анионным интервалом (АИ). Анионный интервал – показатель, в значительной степени отражающий количество образованных и/или задержанных в организме нелетучих кислот.
![]()
В норме АИ составляет 164 мэкв/л. Увеличение АИ чаще всего связано с накоплением органических кислот (ацидоз) или с гиперпротеинемией. Уменьшение АИ происходит при гипопротеинемии. АИ – косвенная анионов в сыворотке, которые не изменяются при рутинном лабораторном анализе.
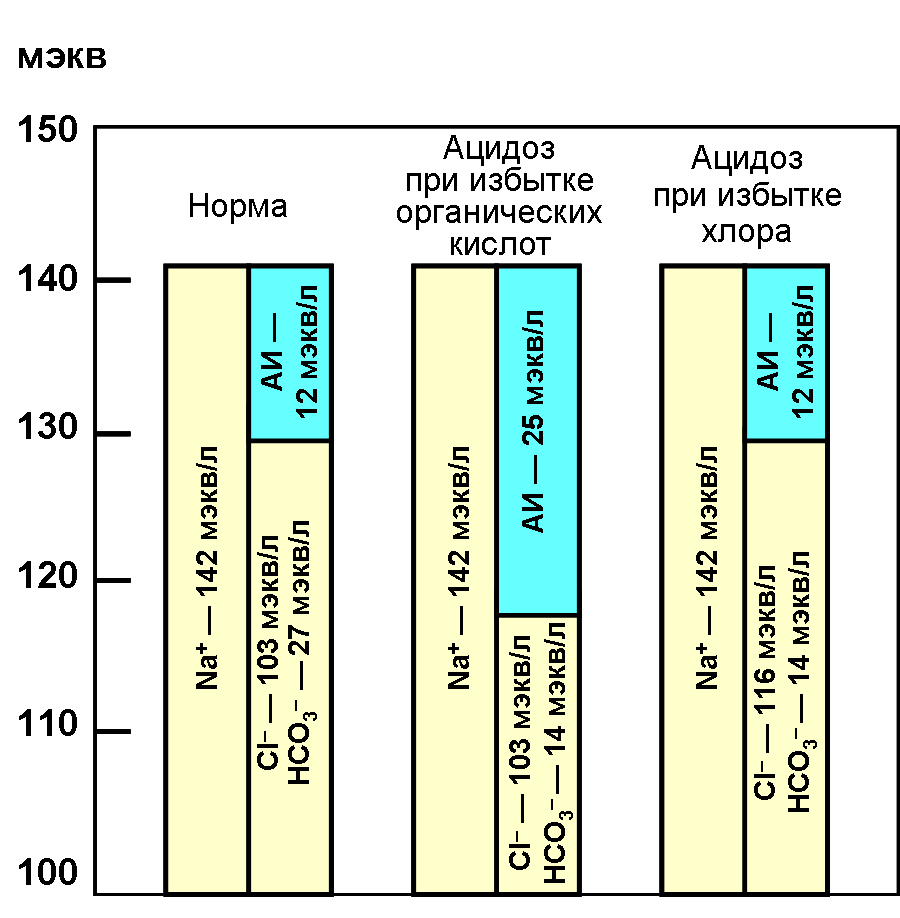
Рис.2. Анионный интервал при ацидозе вследствие избытка органических кислот и избытке хлора. Неизмеряемые анионы, такие как фосфаты, сульфаты и органические кислоты, увеличивают АИ вследствие замещения гидрокарбоната. Это подразумевает отсутствие изменения содержания Na+.

Существует несколько вариантов определения АИ, в частности, без добавления в формулу концентрации ионов калия. В этом случае АИ в норме будет равен 124 мэкв/л.
При метаболическом ацидозе органические анионы накапливаются одновременно с эквивалентным количеством ионов водорода. Так, при диабетическом кетоацидозе накапливаются ацетоацетат и -оксимасляная кислота, при лактоацидозе накапливается лактат. При этом электронейтральность поддерживается за счет снижения количества бикарбоната. Существенное увеличение АИ наблюдается при отравлениях метанолом, этиленгликолем. Большинство видов метаболического ацидоза возникает в результате снижения уровня бикарбоната плазмы без соответствующего повышения концентрации ионов хлора, что сопровождается повышением АИ.
В то же время при почечном канальцевом ацидозе, связанном с потерей бикарбоната, происходит повышение в плазме ионов хлора и АИ будет в пределах нормы. Поэтому расчет АИ имеет диагностическое значение. Хотя в клинических условиях причину метаболического ацидоза можно установить с помощью обычных анализов, тем не менее расчет АИ может быть полезен при анализе комплексных нарушений КОС.
Метаболические кислоты и продукция бикарбонатов
Кислоты постоянно образуются в организме как побочные продукты метаболических процессов. Физиологически эти кислоты подразделяются на две группы: летучая кислота Н2СО3 и все другие нелетучие кислоты.
Различие между двумя типами кислот связано с тем, что Н2СО3 находится в равновесии с летучим газом СО2, который выводится из организма через дыхательные пути. Концентрация Н2СО3, таким образом, определяется внешним дыханием. Нелетучие кислоты (например, серная, соляная, фосфорная) не элиминируются через легкие, амортизируются в организме белками или внеклеточными буферами, такими как НСО3ˉ , а затем экскретируются почками.
Двуокись углерода и продукция бикарбонатов
Обмен веществ в организме приводит к образованию приблизительно 15.000 ммоль СО2 ежедневно. Двуокись углерода транспортируется в циркуляции в трех формах: соединенной с гемоглобином, растворенной СО2 и ионов НСО3ˉ. Суммарно растворенная СО2 и ионы НСО3ˉ составляют примерно 77% двуокиси углерода, транспортируемой во внеклеточной жидкости (без учета СО2, переносимой гемоглобином). Сама СО2 не является кислотой, но очень небольшое ее количество взаимодействует с водой в плазме крови с образованием Н2СО3.
Реакция, в ходе которой образуется Н2СО3 из СО2 и воды, катализируется карбоангидразой - ферментом, содержащимся в больших количествах в эритроцитах, клетках эпителия почечных канальцев и ряде других тканей организма. Присутствие карбоангидразы приблизительно в 5000 раз увеличивает скорость реакции взаимодействия между СО2 и водой. При отсутствии этого фермента, реакция оказывается столь медленной, что не имеет для организма никакой значимости.
Поскольку практически невозможно измерить уровень Н2СО3, для расчета рН обычно используют определение растворенной СО2. Содержание Н2СО3 в крови можно вычислить, умножая парциальное давление СО2 (РСО2) на коэффициент ее растворимости, который составляет 0,03. Это означает, что концентрация Н2СО3 в артериальной крови, в норме имеющей РСО2 приблизительно 40 мм рт.ст., составляет 1,2 mEq/L (40×0,03=1,2).
Продукция некарбоновых кислот и оснований
Основными продуктами метаболизма в клетке являются кислоты, которые диссоциируют с освобождением ионов водорода, но благодаря включению буферных систем закисления внутриклеточной cреды не происходит. Результатом биохимических процессов в тканях является образование летучей угольной кислоты и ряда нелетучих кислот, таких, как серная кислота, мочевая кислота (при расщеплении нуклеопротеидов), свободные жирные кислоты различной молекулярной массы, неорганические фосфаты. Основным источником серной кислоты служит метаболизм метионина и цистина, входящих в состав белков пищи. В рационе питания количество готовых кислот или щелочей обычно невелико, но может содержаться достаточное количество потенциальных кислот (лизин) или щелочей (цитрат).
Метаболизм белков и других веществ, поступающих с пищей, приводит к образованию некарбоновых кислот и оснований. При окислении серосодержащих аминокислот (например, метионина, цистеина) образуется серная кислота. Окисление аргинина и лизина приводит к появлению соляной кислоты, окисление фосфор-содержащих нуклеиновых кислот – фосфорной кислоты. При неполном окислении глюкозы образуется молочная кислота, а при неполном окислении жиров - кетоновые кислоты. Основным источником оснований является обмен аминокислот, таких как аспартат и глутамат, и метаболизм некоторых органических анионов (например, цитрата, лактата, ацетата). Продукция кислот обычно превышает продукцию оснований, с ежедневным итоговым эффектом избытка, составляющим приблизительно 2 ммоль/кг веса нелетучих кислот. Результатом потребления вегетарианской пищи, содержащей большое количество органических анионов, является доминирующее образование оснований.
Расчет величины рН
Процесс диссоциации кислот в водных растворах согласно закону сохранения масс можно выразить следующим образом:
![]()
где К – константа диссоциации.
Зависимость рН от соотношения кислоты и основания определяется уравнением Гендерсона- Гессельбаха:
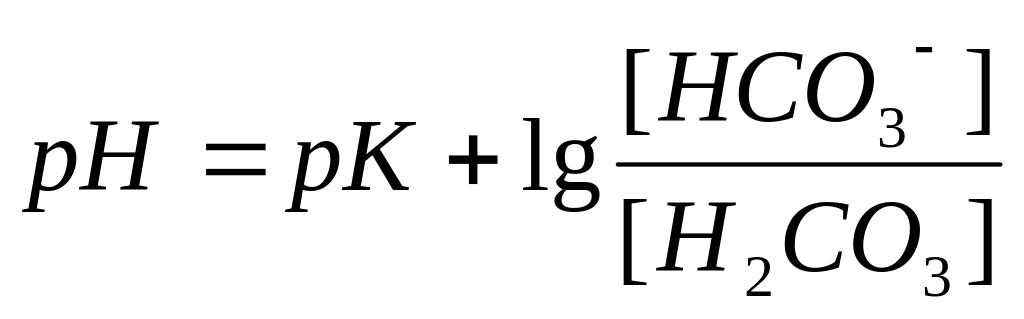
Величину рН плазмы можно рассчитать, используя уравнение Гендерсона-Гессельбаха. В этом уравнении для вычисления рН используется отрицательный логарифм константы диссоциации и логарифм отношения НСО3ˉ к СО2 (НСО3ˉ / СО2):

Следует отметить, что это отношение точнее, чем абсолютные значения для бикарбоната и растворенной СО2, определяющее рН (например, при отношении 20:1, рН=7,4). Значения рН в плазме уменьшаются, когда отношение меньше, чем 20:1, и возрастают, когда отношение больше, чем 20:1.
рН может сохраняться в относительно нормальных пределах до тех пор, пока изменения НСО3ˉ сопровождаются подобными изменениями СО2, или наоборот. Например, рН может оставаться на уровне 7,4 при повышении содержания НСО3ˉ в плазме от 24 до 48 mEq/L при соответствующем увеличении уровня СО2. рН может также оставаться равным 7,4 при снижении НСО3ˉ с 24 до 12 mEq/L при редукции уровня СО2 до половины от нормального.
