
Возрастает;
Уменьшается;
не меняется;
имеет периодический характер;
отсутствует;
$$$ 58
Условие образования осадка:
$$$ 59
Условие растворения осадка:
$$$ 60
Чему равен рН 0,01 М раствора гидроксида калия:
0,01
2
10
0
12
$$$ 61
Какое значение рН соответствует кислой среде:
pH>7
pH<7
pH=0
pH=5
pH=1
$$$ 62
Изотопы элемента различаются:
по числу нейтронов;
по атомному номеру;
по числу валентных электронов;
по числу протонов;
по числу электронов.
$$$ 63
Атом какого из элементов легче всего отдает один электрон:
№11, натрий;
№12, магний;
№13, алюминий;
№14, кремний;
№15, фосфор.
$$$ 64
Какая частица имеет большее число протонов, чем электронов:
атом натрия;
атом серы;
сульфид ион;
ион натрия;
сульфид натрия.
$$$ 65
γ– излучение представляет собой поток:
ядер гелия;
электронов с одинаковой энергией;
тепловых нейтронов
квантов электромагнитного излучения;
тепловых излучений.
$$$ 66
Энергия активации с увеличением температуры:
растет;
Уменьшается;
без изменений;
изменяется периодически;
растет до tkp , а затем резко падает;
$$$ 67
При удалении электронного облака на некоторое расстояние от ядра:
размеры электронного облака увеличивается;
параметры электронного облака не изменяются;
размеры электронного облака уменьшаются;
происходит образование новых электронных облаков;
не происходит каких-либо изменений;
$$$ 68
Корпускулярные свойства фотона выражаются уравнением:
$$$ 69
Электроотрицательность в зависимости от порядкового номера элемента:
растет в периоде с ростом номера;
уменьшается в периоде с ростом номера;
не зависит от положения элемента в таблице;
растет до середины, а затем уменьшается к концу
не изменяется как -либо;
$$$ 70
Чем больше электроотрицательность, тем электронное облако смещено более к:
электроотрицательному атому;
положительному атому;
нет взаимосвязи;
расположено симметрично;
изменяется в зависимости от условий;
$$$ 71
При нагревании
энтропия
![]() :
:
растет;
Уменьшается;
остается без изменений;
равна 0;
равна 100;
$$$ 72
Энтропия возрастает при процессе:
полимеризации;
сжатии;
испарении;
кристаллизации;
охлаждении;
$$$ 73
Скорость химической реакции с увеличением температуры:
Уменьшается;
увеличивается;
остается неизменной;
реакция останавливается;
изменяется скачкообразно;
$$$ 74
Если значение Еа (энергия активации) мало, значит:
скорость такой реакции велика;
скорость реакции мала;
скорость ни мала, ни велика;
скорость равна 0;
нет связи между скоростью и Еа
$$$ 75
Дипольный момент пропорционален:
заряду электрона;
напряженности поля;
не взаимосвязан с чем либо;
массе электрона;
плотности;
$$$ 76
У какого из элементов наибольшая электроотрицательность:
Li
Be
N2
F2
Na
$$$ 77
Мерой химического сродства является:
убыль потенциала G или ∆G
энтропия S;
полная энергия системы И
энтальпия химической реакции Н
значения массы элемента;
$$$ 78
Необходимое условие химического взаимодействия:
соударение частиц;
природа частиц;
присутствие катализатора;
концентрация частиц;
температура;
$$$ 79
Константа скорости не зависит от:
природы реагирующих веществ;
от температуры;
от присутствия катализатора;
концентрации веществ;
плотности;
$$$ 80
Фотон проявляет:
корпускулярные свойства;
волновые;
корпускулярно-волновые свойства;
не проявляет каких-либо свойств;
окислительные свойства;
$$$ 81
Устойчивое состояние электрона в атоме соответствует:
min значению его энергии;
max значению его энергии;
возбужденному состоянию;
min значению суммарного спина атома;
значению суммарного спина равного 0;
$$$ 82
Атомы, имеющие одинаковое массовое число отличающиеся числом протонов в ядре называются
А) изотопы
В) изобары
С) нуклоны
D) протоны
Е) нейтроны
$$$ 83
В результате химической реакции теплота выделяется:
∆H>0
∆H<0
∆H=0
∆H= Qp
∆H=-1
$$$ 84
Экзотермическая реакция, характеризуется:
A) ∆H<0 ∆Qp >0
B) ∆H>0 ∆ Qp <0
C) ∆H=0 ∆ Qp =0
D) ∆H=0 Qp >0
Е) ∆S >0
$$$ 85
Наибольшим поляризующим действием обладает:
ион Н+
Ba2+
Hg+
K+
O2-
$$$ 86
Суммарный заряд диполя равен:
-1
+1
0
2
5
$$$ 87
Согласно закона Гесса тепловой эффект реакции СН3ОН +3/2О2=СО2+2Н2О равен
∆ Hхр= ∆ H СО2 + 2 HН2О-(∆HСН3ОН+3/2∆ НО2)
∆ Hхр= ∆ H СО2 + 2 HН2О
∆ Hхр= ∆ H СН3ОН + 3/2 ∆НО2
∆ Hхр= ∆ H СО2 + 2 HН2О+ ∆HСН3 ОН+ 3/2∆ НО2
∆ Hхр= ∆ H СО2
$$$ 88
Укажите полярную молекулу:
А) ZnCI2
В) BH3
С) NH3
D) BeCI2
Е) CH4
$$$ 89
Эндотермическая реакция характеризуется:
A) ∆H<0 ∆Qp >0
B) ∆ Qp <0
C) ∆H=0 ∆ Qp =0
D) ∆H=0 Qp >0
Е) нет каких либо характеристик;
$$$ 90
Самопроизвольно реакция протекает при:
A) ∆G<0 ∆H>0 ∆S>0
B) ∆G>0
C) ∆G=0
D) ∆S<0 ∆H<0 ∆G>0
E) не протекает;
$$$ 91
Катализаторы -это:
вещества, не расходующие во время реакции, но влияющие на ее скорость;
вещества, влияющие на скорость реакции, но при этом расходующиеся;
вещества, расходующиеся в результате химической реакции и не влияющие на ее скорость;
вещества, являющиеся побочным продуктом химической реакции;
любое из веществ, влияющих на реакцию;
$$$ 92
Действие катализатора:
снижает энергию активизации (Еа);
повышает Еа;
не влияет на Еа;
останавливает химическую реакцию;
влияет по разному в зависимости от условий;
$$$ 93
Какая схема приводит к образованию кислоты:
$$$ 94
В ряду
![]()
электроотрицательность уменьшается;
окислительная способность возрастает;
металлические свойства убывают;
электроотрицательность увеличивается;
радиус атома уменьшается;
$$$ 95
С каким веществом хлор не соединяется:
CH4
O2
CH4
C
H2
$$$ 96
Сколько неспаренных
электронов в нормальном состоянии имеет
атом элемента с электронной конфигурацией
![]()
4
1
2
3
5
$$$ 97
Как меняется степень окисления у Cl:
[+1; -0]
[-1; -0];
[0; -1];
[0; +1];
[0; +7];
$$$ 98
Молекула аммиака имеет форму
A) изогнутую
B) линейную
C) плоскостную
D) пирамидальную
E) гексагональную
$$$ 99
Какое соединение- сложное вещество:
HBr
N2
H2
Cl2
S2
$$$ 100
Увеличение концентрации продукта реакции в равновесной системе приводит к смещению равновесия в сторону:
уменьшения числа молекул;
образования исходных веществ;
увеличения числа молекул газов;
расходования исходных веществ;
эндотермической реакции;
$$$ 101
Какие продукты
получаются при электролизе расплавы
![]()
H2, Cl2;
Na, Cl;
H2, O2;
Na, O2;
Cl2, O2;
$$$ 102
Найти процесс восстановления:
$$$ 103
Какая частица относится к анионам:
H3PO4;
Ca2+;
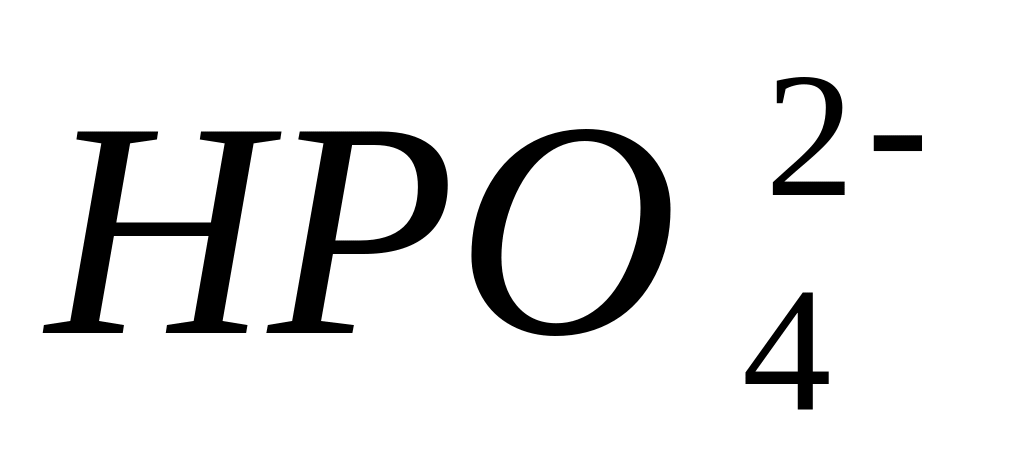
[CaOH]+;
H2S;
$$$ 104
Найти уравнение каталитического окисления NH3
$$$ 105
Химическая связь в MgO:
ионная;
металлическая;
ковалентная полярная;
ковалентная неполярная;
водородная;
$$$ 106
Для фтора возможна степень окисления:
0; +7
0; +2
0; -1
0; +1
0; +3
$$$ 107
Массовая доля K в KBr составляет:
32.4%
32.8%
33%
32.2%
32.6%
$$$ 108
В реакции
![]() ,
при увеличении концентрации NO2
в 4 раза приведет
,
при увеличении концентрации NO2
в 4 раза приведет
увеличению скорости реакции в 2 раза;
уменьшению скорости реакции в8 раз;
уменьшению скорости реакции в 4 раза;
увеличению скорости в 4 раза;
уменьшению скорости в 2 раза;
$$$ 109
Найти реакцию получения СО в лаборатории:
$$$ 110
Химическая связь в О3:
водородная;
ковалентная неполярная;
ковалентная полярная;
металлическая;
ионная;
$$$ 111
Как меняется радиус атомов элементов в малых периодах от первого к последующим элементам:
