
- •Ход работы
- •Справочные материалы Первичная статистическая обработка данных эксперимента
- •Коэффициент Стьюдента t для уровней значимости р
- •Алкан Алкен
- •Занятие IV-V. Водообмен клетки
- •Занятие IV-V. Водообмен клетки
- •Занятие IV-V. Водообмен клетки
- •Занятие IV-V. Водообмен клетки
- •Занятие IV-V. Водообмен клетки
- •Занятие IV-V. Водообмен клетки
- •Занятие VI. Движение воды в растении Работа 1. Определение поглощения воды потометрическим методом
- •Занятие VII. Физиология устьичного аппарата
- •Задачи:
- •Занятие IX. Физиология устойчивости растений
- •Оптическая плотность (д) инкубационной среды при разных температурах
- •Недостаток азота (n)
- •Недостаток фосфора (р)
- •Недостаток калия (к)
- •Недостаток кальция (Са)
- •Недостаток магния (Mg)
- •Недостаток серы (s)
- •Недостаток микроэлементов Недостаток железа (Fe)
- •Недостаток бора (в)
- •Содержание нитратов, фосфатов и калия в срезах стеблей и черешков листьев сельскохозяйственных культур при достаточной обеспеченности минеральными элементами
- •Определение нитратов
- •Определение неорганического фосфора
- •Определение калия
- •Содержание нитратов, фосфатов и калия у различных сельскохозяйственных культур
Занятие I. БИОМЕМБРАНЫ
Работа 1. Избирательная проницаемость клеточных мембран. Стойкий и временный плазмолиз
Контрольные вопросы:
1.Приведите уравнение водного потенциала клетки (Ψкл.), охарактеризуйте его составляющие.
2. Опишите растительную клетку как осмотическую систему. Рассмотрите случай, когда клетка находится в чистой воде. Какие явления наблюдаются при погружении клетки в раствор высокой осмолярности?
3. Как изменяется соотношение между водным потенциалом, потенциалом давления и осмотическим потенциалом клетки по мере увеличения концентрации осмотика?
4. Назовите формы плазмолиза. Объясните, почему в гипертонических растворах одних солей развивается стойкий плазмолиз, а в других – плазмолиз является временным.
5. Вспомните технику приготовления временных микропрепаратов в ботанических исследованиях. Используйте эти навыки в предложенной работе.
Растительную клетку можно рассматривать как осмотическую систему, в которой полупроницаемой мембраной являются плазмалемма и тонопласт, а осмотическим пространством – центральная вакуоль с большой концентрацией осмотически активных веществ (сахаров, органических кислот, солей). Клеточная стенка обладает определенной эластичностью и может растягиваться. Водный потенциал клетки (Ψкл. ) является алгебраической суммой двух составляющих – осмотического потенциала (Ψs) и потенциала давления (Ψр): Ψкл. = Ψs + Ψр.
Направление движения воды из наружной среды в клетку и обратно определяется направлением градиентов водного потенциала. При погружении клетки в гипертонический раствор (Ψкл. > Ψр-ра) вода выходит из клетки, при этом вакуоль уменьшается в объеме и протопласт отстает от клеточной стенки – наблюдается явление плазмолиза. При плазмолизе Ψр = 0 и Ψкл. = ΨS. Плазмолиз может иметь разные формы, сменяющие одна другую: уголковый, вогнутый, выпуклый. Погружение плазмолизированной клетки в воду приводит к осмотическому притоку воды в вакуоль – развивается деплазмолиз. При этом вода поступает в клетку до тех пор, пока Ψs кл. не будет уравновешен Ψр (-Ψs = Ψр и Ψкл. = 0).
Растительная клетка обладает избирательной проницаемостью и для растворенных веществ. Если вещества проходят через мембрану, но медленнее, чем молекулы воды, то плазмолиз с течением времени исчезает (временный плазмолиз). Растворенное вещество постепенно проникает в клетку, уменьшается Ψs вакуолярного сока, и вода начинает поступать в клетку – развивается деплазмолиз. Стойкий плазмолиз развивается в гипертонических растворах веществ, для которых клеточные мембраны непроницаемы (малопроницаемы).
Цель работы: сравнить проницаемость клеточных мембран для различных веществ; рассмотреть растительную клетку как осмотическую систему.
Объекты: побег элодеи, луковица репчатого лука.
Реактивы и оборудование: 1 M р-р сахарозы, 1 M р-р карбамида, дистиллированная вода в капельницах; препаровальный набор, микроскоп, секундомер.
Ход работы
Приготовить три микропрепарата листа элодеи (эпидермы с выпуклой стороны чешуи луковицы): один – в 1 M растворе сахарозы; другой – в 1 M растворе карбамида; третий, контрольный, – в воде.
При малом увеличении микроскопа (15ок. x 8об.) найти на микропрепаратах 1 и 2 участки листа (среза), в которых хорошо видны плазмолизированные клетки. Сравнить микроскопическую картину на всех трех микропрепаратах. Рассмотреть микропрепараты при большом увеличении (15ок. x 40об.), сделать рисунки.
Через 30-60 минут вновь рассмотреть препараты, зарисовать клетки.
В каком растворе плазмолиз сохранился (стойкий плазмолиз)? В каком растворе произошел деплазмолиз (и, следовательно, плазмолиз был временным)? Объяснить наблюдаемые явления.
Оформление работы:
рисунками (фотографиями) покажите динамику микроскопической картины на препаратах. Укажите, в каком растворе плазмолиз сохранился (стойкий плазмолиз), а в каком растворе произошел деплазмолиз (и, следовательно, плазмолиз был временным). Зарисуйте (или сфотографируйте) клетки с разными формами плазмолиза. Объясните наблюдаемые явления.
Результаты и обсуждение
Работа 2. Определение жизнеспособности растительных клеток
Контрольные вопросы:
Дайте общую характеристику клеточных мембран (Химический состав, функции, жидкостно-мозаичная модель строения).
Какими особенностями состава и структуры обладает плазматическая мембрана растительной клетки? В чем заключаются общие с другими мембранами функции плазмалеммы.
Назовите методы определения жизнеспособности растительных клеток, на чем они основаны?
Почему наличие плазмолиза у клеток в гипертонических растворах является надежным критерием их жизнеспособности?
Состояние клеток можно определить по их способности к плазмолизу в гипертонических растворах, по движению цитоплазмы, окрашиванием витальными (прижизненными) красителями, выявлением ферментативной активности.
Одним из способов изучения проницаемости клеточных мембран является окрашивание клеток катионными (основными) красителями. Так, нейтральный красный проникает в живую клетку в молекулярной форме, но под влиянием кислой среды вакуоли переходит в ионную форму и, поскольку мембраны непроницаемы для этих ионов, накапливается в вакуоли, окрашивая клеточный сок в малиновый цвет. В поврежденных и мертвых клетках мембраны утрачивают селективность – становятся идеально проницаемыми, повышается сродство к красителю у цитоплазмы и ядра, поэтому вся клетка диффузно окрашивается в желто-бурый цвет. Нейтральный красный – двухцветный индикатор: в кислой среде он имеет малиновую окраску, а в щелочной – желтую.
Цель работы: ознакомиться с методами выявления состояния растительных клеток.
Объекты: луковица лука репчатого, проростки пшеницы, кукурузы, почки с побегов
деревьев.
Реактивы и оборудование: 0,01% р-р нейтрального красного и 1 M р-р KNO3 в капельницах; препаровальный набор, микроскоп, бюксы, стакан с водой, спиртовка.
Ход работы
На вогнутой поверхности чешуи луковицы лезвием сделать надрезы в виде небольших квадратиков (0,5 x 0,5 см). 2-3 квадратика эпидермы снять с чешуи и поместить в бюкс с раствором нейтрального красного.
Через 10 минут срезы из бюкса перенести в стаканчик с водой.
Отмытые срезы поместить в каплю раствора KNO3 на предметном стекле, закрыть покровным стеклом и рассмотреть сначала при малом, а затем при большом увеличении микроскопа.
Зарисовать клетку. Обратить внимание на окраску клеточной стенки, цитоплазмы. вакуоли. Плазмолизируются ли клетки среза?
2-3 среза поместить в большую каплю воды на предметном стекле и осторожно нагреть над пламенем спиртовки до появления пузырьков. После этого с убитыми кипячением клетками провести операции, описанные в пунктах 1-4.
Сравнить и объяснить результаты обоих опытов.
Оформление работы:
Зарисуйте (или приложите фотографии) живые и мертвые клетки после окрашивания и пребывания в растворе осмотика. Сравните и объясните результаты обоих опытов.
Результаты и обсуждение
Работа 3. Выявление живых и мертвых клеток по ферментативной активности
Соли тетразолия в окисленном состоянии бесцветны, а в восстановленном имеют окраску – красную, синюю, фиолетовую. Восстановление солей тетразолия до окрашенных формазанов происходит с участием ферментов дегидрогеназ живых клеток. В мертвых клетках дегидрогеназы неактивны, поэтому соли тетразолия не восстанавливаются и окраска не развивается.
Цель работы: определить жизнеспособность клеток растительных тканей по активности ферментов дегидрогеназ в реакции восстановления ТТХ.
Объекты: наклюнувшиеся зерновки ячменя, кукурузы, пшеницы; проростки подсолнечника, фасоли, огурцов; почки древесных растений.
Реактивы и оборудование: 0,3% раствор трифенилтетразолия хлорида (ТТХ) в 0,87% растворе K2HPO4, дистиллированная вода; препаровальный набор, бюксы; микроскоп, термостат, спиртовка.
Ход работы
С выбранных объектов (зародыши наклюнувшихся семян, стеблевые апексы проростков, почки) сделать срезы. Можно использовать кончики корней длиной 2-3 мм.
Часть срезов положить на предметное стекло в воду и нагреть над пламенем спиртовки.
Живые и мертвые срезы поместить в бюксы с раствором ТТХ и выдержать в термостате при температуре 30 – 350С 20 – 30 минут.
Сравнить окраску срезов. В каких тканях развивается наиболее яркое окрашивание? Зарисовать и объяснить наблюдаемую картину.
Оформление работы:
сравните окраску срезов обоих вариантов, объясните. Отметьте, в каких тканях жизнеспособных объектов развивается наиболее яркое окрашивание. Используйте цветные карандаши при работе с приведенными ниже схематическими рисунками проростков различных растений.
Результаты и обсуждение
Вариант 1 (живые объекты):

Фасоль пшеница горох кукуруза корень (увел.) подсолнечник
ЗАНЯТИЕ II. «CВОЙСТВА ЦИТОПЛАЗМЫ»
Работа 1. Микрометр окулярный винтовой (МОВ-1-15x). Назначение, принцип действия. Измерение линейного увеличения объектива микроскопа
Окуляр-микрометр является принадлежность микроскопа и предназначается для измерения изображения объектов, рассматриваемых в микроскоп.
Окуляр-микрометр надевают на тубус микроскопа вместо окуляра и закрепляют винтом. В фокальной плоскости окуляра расположена подвижная шкала с делениями от 0 до 8 мм (цена деления шкалы 1 мм) и подвижные перекрестие и биштрих (рис. 1).

Рис. 1
При вращении микрометрического винта перекрестие и биштрих перемещаются в поле зрения относительно неподвижной шкалы. Шаг винта равен 1 мм. При повороте барабана микрометрического винта на один оборот биштрих и перекрестие в поле зрения окуляра переместятся на одно деление шкалы. Следовательно, неподвижная шкала в поле зрения окуляра служит для отсчета полных оборотов барабана винта, т.е. целых миллиметров перемещения перекрестия.
Барабан винта по окружности разделен на 100 частей, поворот барабана на одно деление соответствует перемещению перекрестия на 0,01 мм. Таким образом, шкала барабана служит для отсчета сотых долей миллиметра.
Полный отсчет по шкалам окулярного микрометра складывается из отсчета по барабану винта. Отсчет по неподвижной шкале в поле зрения определяется положением биштриха. Отсчет по барабану снимается определением соответствия деления шкалы барабана и индекса, нанесенного на неподвижном цилиндре.
Пример: Биштрих в поле зрения микроскопа расположен между делениями «3» и «4» неподвижной шкалы, а индекс приходится против деления «46» шкалы барабана. Следовательно, отсчет по шкале окуляра будет 3 мм, отсчет по барабану 0,01 х 46 = 0,46 мм. Полный отсчет равен 3 + 0,46 = 3,46 мм.
Оборудование: микроскоп, окуляр-микрометр, объект-микрометр.
Ход работы
Окуляр-микрометр надеть на тубус микроскопа, а объект-микрометр положить на предметный столик. Сфокусировать микроскоп на резкость изображения шкалы объект-микрометра. Работать при среднем увеличении объектива (40Х).
Объект-микрометр – круглая стеклянная пластинка с нанесенной на неё шкалой, вмонтированная в металлическую пластинку. Шкала имеет цену деления равную 0,01 мм.
Для удобства измерения шкалу окуляр-микромера подвести к делению «8» неподвижной шкалы.
Шкалу объект-микрометра установить в поле зрения микроскопа так, чтобы первое деление шкалы находилось перед центром перекрестия, а штрихи шкалы объект-микрометра были параллельны биштриху.
Наблюдая в окуляр, вращением барабана микрометрического винта совместить центр перекрестия с изображением первого деления шкалы объект-микрометра. Снять отсчет по шкалам окуляр-микрометра (II).
Продолжая наблюдать в окуляр, вращением барабана микрометрического винта совместить центр перекрестия с изображением произвольно выбранного деления шкалы объект-микрометра на противоположном краю поля зрения. Снять второй отсчет по шкалам окуляр-микрометра (I).
Подсчитать число делений шкалы объект-микрометра, принятых при измерении (z).
Данные подставить в формулу:
β
=
![]()
![]() где
β – линейное увеличение объектива;
где
β – линейное увеличение объектива;
а – цена деления шкалы объект-микрометра (0,01)
8. Повторить измерение ещё два раза (п. 1-6). Рассчитать βср..
Результаты и обсуждение
Измерение, №
|
II
|
I
|
Z
|
Линейное увеличение, β |
1.
2.
3. |
|
|
|
|
Работа 2. Определение скорости движения цитоплазмы в клетках листа элодеи
Контрольные вопросы:
Каково биологическое значение движения цитоплазмы в растительных клетках.
Назовите и опишите типы движения цитоплазмы в клетках растений, приведите конкретные примеры объектов с указанным типом движения цитоплазмы.
Укажите факты, свидетельствующие об энергозависимости процесса движения цитоплазмы.
Охарактеризуйте строение микрофиламентов и микротрубочек цитоскелета. Какие функции выполняет цитоскелет клетки?
Движение цитоплазмы – распространенное и легко обнаруживаемое в живых клетках явление. Оно играет важную роль в переносе и распределении веществ в клетке, в реакции раздражимости. Скорость движения можно использовать для оценки уровня жизнедеятельности клетки.
Различные химические агенты, механическое воздействие, свет, температура либо ускоряют, либо замедляют и останавливают движение. Источником энергии для движения цитоплазмы, как и для большинства других физиологических процессов, служит АТФ. Движение обычно усиливается с повышением концентрации АТФ до определенного уровня, высокая концентрация АТФ ведет к повышению вязкости цитоплазмы и к замедлению или остановке движения. Различные ингибиторы и разобщители дыхания (динитрофенол – ДНФ, антибиотик олигомицин) тормозят движение цитоплазмы, что также свидетельствует об энергозависимости процесса.
Скорость движения цитоплазмы можно измерить под микроскопом по перемещению хлоропластов.
Цель работ:
показать, что скорость движения цитоплазмы неразрывно связана с уровнем жизнедеятельности клетки, с затратой энергии.
Реактивы и оборудование: листья элодеи, микроскоп, окуляр-микрометр, предметные и покровные стекла, фильтровальная бумага, стаканчик на 50 мл с водой, биологический термостат, секундомер, настольная лампа мощностью 100 Вт, 5·10-3М АТФ, 5·10-4М ДНФ в капельницах.
Ход работы:
Отделить лист элодеи вблизи верхушечной почки, положить на предметное стекло в каплю воды, закрыть покровным стеклом.
Препарат рассмотреть при малом увеличении микроскопа, выбрать наиболее легко просматриваемые участки вблизи центральной жилки. Следить за движением цитоплазмы по перемещению хлоропластов сначала при малом, а затем при среднем увеличении объектива микроскопа (15ок.´40об.).
Определить скорость движения хлоропластов, измеряя путь (ℓ, мм), который проходит органелла в единицу времени (мин), окуляр-микрометром:
а) наблюдая в окуляр и вращая барабан винта, подвести центр перекрестия к точке начала наблюдений. По шкалам микрометра сделать первый отсчет.
б) включить секундомер в момент, когда изображение перемещающегося хлоропласта совместится с центром перекрестия. Вращением винта перемещать центр перекрестия по линейному отрезку измеряемого пути так, чтобы все время перед центром перекрестия находился выбранный хлоропласт. В конце пути выключить секундомер в момент совмещения изображения хлоропласта с центром перекрестия и сделать второй отсчет.
в) зная линейное увеличение объектива микроскопа βср., вычислить путь, пройденный органеллой (ℓ, мм), по формуле:
ℓ (мм)
=
![]() ,
где
II
- I
-
разность отсчетов, которая определяет
величину
,
где
II
- I
-
разность отсчетов, которая определяет
величину
изображения объекта (пути).
г) рассчитать скорость движения хлоропласта (V) в мм/мин, зная путь, пройденный органеллой за время t' (мин).
Подсчет провести для 10 хлоропластов в 10 клетках и полученные данные статистически обработать (Справочные материалы «Первичная статистическая обработка данных эксперимента»).
Поместить каплю раствора АТФ с одной стороны покровного стекла и одновременно оттянуть полоской фильтровальной бумаги воду из-под стекла с другой стороны. Когда лист окажется в растворе АТФ, определить скорость движения цитоплазмы (см. пункт 3).
В следующем опыте определить скорость движения цитоплазмы, сменив воду под покровным стеклом на раствор ДНФ.
Веточку элодеи опустить в стакан с водой, который находился в термостате при температуре 37°С, оставить там на 20 мин. Затем приготовить препарат и определить скорость движения цитоплазмы по принятой методике.
Для выяснения влияния света на скорость движения цитоплазмы в клетках листа элодеи, выдержать побег элодеи в течении 15-20 минут под светом электролампы. Лампа должна быть удалена от растения на 20 - 30 см, чтобы исключить перегрев.
Оформление работы:
данные занесите в таблицы. Рассчитайте достоверность разницы (используя критерий Стьюдента) по показателю между контрольным и опытными вариантами. Обсудите влияние различных факторов на скорость движения цитоплазмы в клетках.
Результаты и обсуждение.
Таблица 1
Определение скорости движения цитоплазмы в клетках листа элодеи
Вариант |
Пов-тор-ность |
II -I |
β |
Время |
ℓ
|
Скорость движения хлоропласта (V), мм/мин. |
|
сек. |
мин. |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
Таблица 2
Влияние внешних факторов на скорость движения цитоплазмы в клетках листа элодеи
Вариант опыта |
Скорость движения хлоропластов (V), мм/мин |
||||
|
S |
|
tф |
достоверность разницы |
|
1. Вода, 20°С (контроль) |
|
|
|
|
|
2. Вода, 37°С |
|
|
|
|
|
3. 5·10-3М АТФ |
|
|
|
|
|
4. 5·10-4М ДНФ |
|
|
|
|
|
5. Вода, 20°С, свет |
|
|
|
|
|
(приложение к занятию II)
ДВИЖЕНИЕ ЦИТОПЛАЗМЫ
Быстрое или почти незаметное движение цитоплазмы, которое происходит в клетках в естественных условиях, называют первичным. Движение же, индуцированное каким-либо фактором внешней среды (светом, температурой, химическим или механическим воздействием и т. п.),— вторичным. Скорость движения цитоплазмы увеличивается с повышением температуры до определенного предела последней (чаще 27—37°С). При дальнейшем увеличении температуры движение замедляется, а затем прекращается. Свет может либо ускорить движение (фотодинез), либо замедлить и остановить его. Характер реакции зависит от количества световой энергии и качественного состава света. Различные химические агенты, физические факторы также влияют на движение цитоплазмы.
Выделяют несколько типов движения цитоплазмы. Наиболее широко распространено колебательное движение. Его считают наименее упорядоченным, так как при этом одни частицы находятся в покое, другие скользят к периферии, третьи — к центру клетки. Движение имеет неустойчивый, случайный характер. Циркуляционное движение характерно для клеток, которые имеют цитоплазматические тяжи, пересекающие центральную вакуоль. Направление и скорость движения частиц, находящихся внутри или на поверхности слоя цитоплазмы, а также в цитоплазматических тяжах, непостоянны (рис. 1).
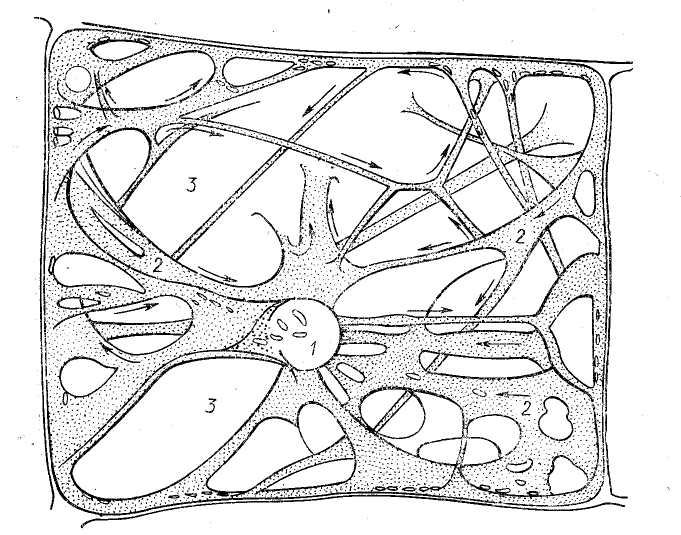
Рис. 1. Цитоплазматические потоки к клетке листового волоска Cucurbita реро (по W. Braune et al., 1971): 1 — ядро, 2 — цитоплазматические тяжи, 3 — вакуоль; направление потоков показано стрелками
При ротационном движении цитоплазма находится только на периферии клетки и движется подобно приводному ремню. Движение этого типа, в отличие от циркуляционного, имеет более или менее постоянный и упорядоченный характер, поэтому удобно для количественного изучения. Оно часто встречается в клетках листьев водных растений (элодея, валлиснерия и др.).
Помимо перечисленных выделяют еще ряд типов движения, например фонтанирующее и челночное. Типы движения различаются между собой условно и в одной и той же клетке могут переходить из одного в другой.
В организации движения цитоплазмы участвуют белки, образующие цитоскелет клетки. Структуры цитоскелета подразделяют на микротрубочки и микрофиламенты. Цитоскелет — очень лабильная, постоянно меняющаяся система. Его элементы способны быстро распадаться (деполимеризоваться) и вновь собираться в структуры (полимеризоваться).
Объектом многих исследований по движению цитоплазмы являются клетки междоузлий харовых водорослей, клетки листа элодеи, волоски тычиночных нитей традесканции, клетки морских сифоновых, зеленых водорослей и ксантофитов.
Источником энергии для движения протоплазмы является АТФ. Поэтому свет может влиять на скорость этого движения, изменяя уровень АТФ, образованной в процессе фотосинтетического фосфорилирования. Различные ингибиторы и разобщители дыхания тормозят движение цитоплазмы во многих растительных клетках, что также свидетельствует об энергозависимости процесса. Так, 2, 4-динитрофенол (ДНФ) — широко применяемый разобщитель дыхания и фосфорилирования — тормозит движение цитоплазмы в концентрациях 10-4— 10-3 М. Его действие обратимо: после удаления реагента скорость движения восстанавливается. Олигомицин — ингибитор окислительного фосфорилирования — заметно замедляет движение цитоплазмы и снимает ускоряющее действие АТФ и АДФ. Этот антибиотик ингибирует не только процесс образования АТФ, но и активность АТФазы, очевидно, подавляя таким образом деятельность сократительных белков.
Биологическое значение движения цитоплазмы состоит в том, что оно способствует переносу веществ от одной части клетки к другой. Помимо этого, у некоторых водорослей с процессом движения связано размножение, с движением связан у грибов рост гиф. У миксомицетов, амеб, диатомовых водорослей движение цитоплазмы и передвижение организма — два неразрывных процесса. Движение цитоплазмы имеет большое значение для поглощения и выделения веществ путем зндо- и экзоцитоза. Перемещения в клетке окруженных мембраной пузырьков, образованных в результате деятельности эндоплазматической сети и аппарата Гольджи, видимо, также осуществляется с помощью движения цитоплазмы.
Различные внешние воздействия способны изменять скорость движения цитоплазмы. Ускорение движения под влиянием химических веществ называют хемодинезом. Большой интерес представляет тот факт, что хемодинез возникает при действии минимальных физиологических концентраций метаболитов растительных клеток, гормонов, некоторых аминокислот. Следовательно, скорость передвижения цитоплазмы может регулироваться продуктами метаболизма клетки.
Несмотря на то что остается много неясного в понимании физиологического значения движения цитоплазмы, несомненно, оно играет важную роль в осуществлении обмена и распределения веществ клетки, в реакциях раздражимости. Движение цитоплазмы можно охарактеризовать, определив его скорость. Однако нельзя забывать о том, что последняя зависит не только от движущей силы, но и от вязкости цитоплазмы. Скорость движения цитоплазмы можно измерить под микроскопом, наблюдая за передвижением ее частиц.
