
Білки, які виконують каталітичну функцію (впливають на швидкість біохімічних реакцій), називаються ферменти або ензими.
Ферменти дуже специфічні, тобто впливають лише на окремі біохімічні процеси.
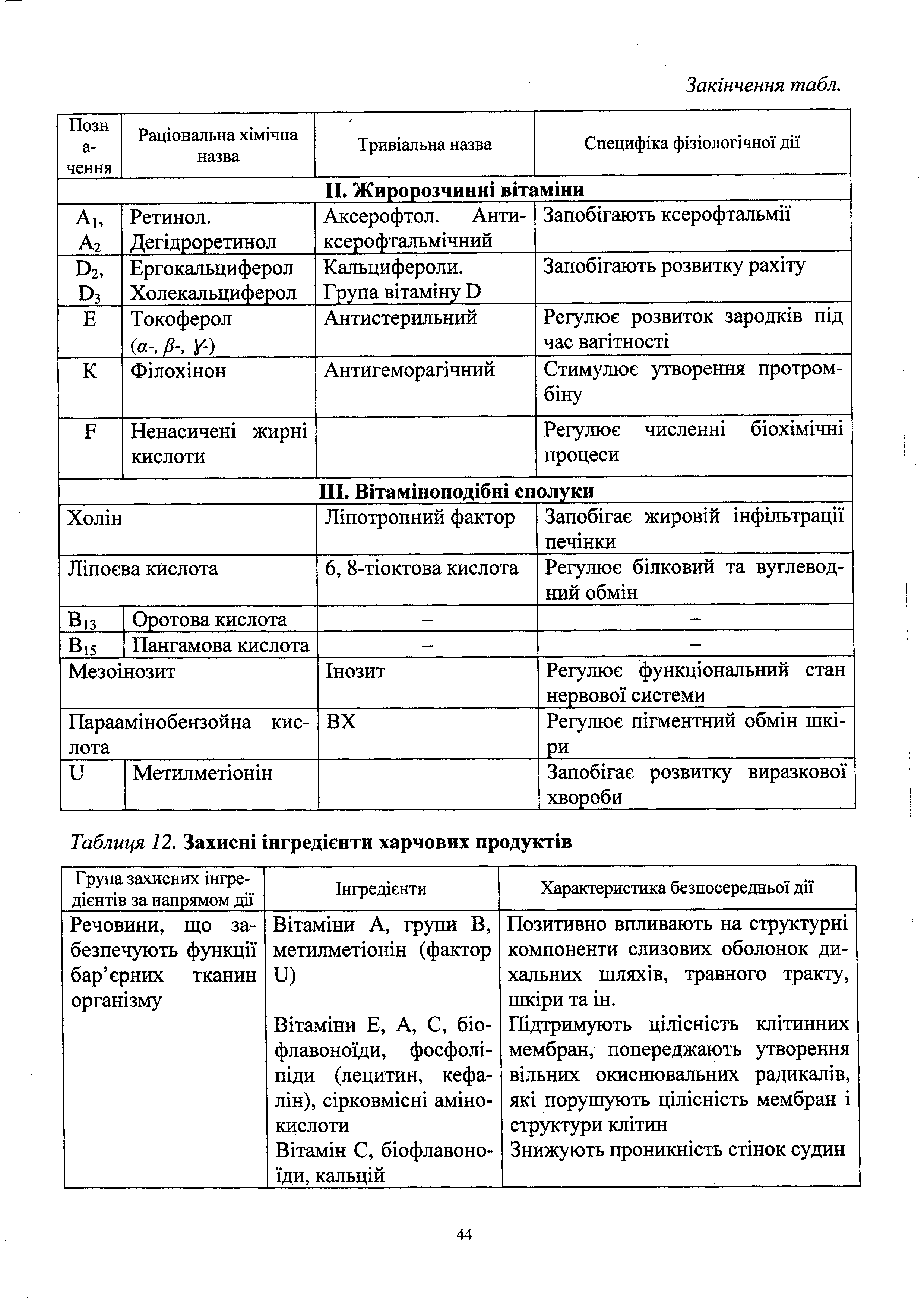
Класифікація ферментів
За будовою:
однокомпонентні (простий білок)
двокомпонентні (білок + небілковий компонент, який називається простетична група або кофактор, і який активує субстрат. Простетичними групами можуть бути вітаміни, нуклеотиди, атоми металів, фосфатні ефіри моносахаридів. Найпоширеніші кофактори – це НАД – нікотинамідаденіндинуклеотид, НАДФ – нікотинамідаденіндинуклеотидфосфат, ліпоєва кислота, коензим А КоА–SH, ФМН – флавінмононуклеотид, ФАД – флавінаденіндинуклеотид.).
За локалізацією:
екзоферменти (виділяються назовні)
ендоферменти (каталізують лише внутрішньоклітинні процеси)
За каталітичними властивостями:
оксидоредуктази (каталізують окислювально-відновлювальні реакції, наприклад при процесах дихання, бродіння)
трансферази (каталізують реакції переноса груп атомів від однієї сполуки до іншої, наприклад амінотрансферази переносять аміногрупи від амінокислот до інших речовин)
гідролази (каталізують реакції, які проходять з приєднанням чи відбиранням води)
ліази (каталізують перетворення речовин з розривом зв’язку між атомами вуглецю, або вуглецю та кисню)
ізомерази (каталізують взаємне перетворення ізомерів)
синтетази (каталізують реакції з’єднання молекул)
Механізм дії ферментів
Субстрат зв’язується не з усією молекулою ферменту, а з його окремою ділянкою – активним центром.
Б
|
|
Каталітична ділянка Контактує з тими ділянками субстрату, які підлягають зміні. |
Контактна (якірна) ділянка Контактує з тими ділянками субстрату, які не підлягають зміні, тобто слугує лише для закріплення субстрату в активному центрі. |
Не всі зіткнення молекул є продуктивними, а лише зіткнення тих молекул, які мають надлишок енергії, яка називається енергією активації – Еа. Механізм дії ферментів заснований на утворенні субстрат-ферментного комплексу, який дуже знижує енергію активації даної реакції, тобто субстратові стає потрібно надати меншу кількість енергії ззовні, щоб ініціювати протікання реакції.
УМОВИ ПРОХОДЖЕННЯ ФЕРМЕНТАТИВНОЇ РЕАКЦІЇ:
просторова відповідність між ферментом (Ф)і субстратом (S), тобто зв’язування субстрату з ферментом відбувається за типом «ключ-замок»:

утворення між ферментом і субстратом різних типів зв’язків, таких як іонні, ковалентні, водневі, гідрофобні, тощо.
Існують
активатори та інгібітори ферментів.
Активатори, відповідно, стимулюють
роботу ферментів, а інгібітори –
пригнічують. До активаторів ферментів
належать такі катіони і аніони, як
![]() ,
а також мінеральні кислоти (наприклад,
соляна кислота у шлунку), жовчні кислоти,
спеціальні ферменти (трипсин, ентерокіназа).
До інгібіторів ферментів відносяться
ізолейцин (амінокислота), фосфоенолпіруват,
аспартат, тощо.
,
а також мінеральні кислоти (наприклад,
соляна кислота у шлунку), жовчні кислоти,
спеціальні ферменти (трипсин, ентерокіназа).
До інгібіторів ферментів відносяться
ізолейцин (амінокислота), фосфоенолпіруват,
аспартат, тощо.
ВИКОРИСТАННЯ ФЕРМЕНТІВ
В хлібопекарському виробництві використовують препарати амілази для прискорення дозрівання тіста й зменшення витрат цукру.
В молочнокислому виробництві використовують мікробні ферменти для бродіння цукру до молочної кислоти.
В процесі сироваріння застосовують хімозин – фермент слизової оболонки сичугу (частина шлунку худоби), який викликає зсідання молока.
В м’ясній промисловості використовують ферменти, які розщеплюють білки і прискорюють процес дозрівання м’яса.
В інших галузях харчової промисловості застосовують глюкозооксидозу для зберігання м’яса, фруктових соків; пектинази використовують для підвищення виходу соку, тощо.
В медицині застосовують пепсин, трипсин (травні ферменти), лізоцим (бактерицидний ефект), фібринолізин (розсмоктування згустків крові).




 УДОВА
АКТИВНОГО ЦЕНТРУ
УДОВА
АКТИВНОГО ЦЕНТРУ