- •Гормоны
- •Гормоны человека
- •1.1. Классификация
- •Рецепторы
- •Цитозольный механизм действия гормонов
- •Активация g-белков при воздействии гормона на рецептор (по Sven Jähnichen).
- •Б) киназы рецепторов, связанных с g-белками (grk-киназы) — это протеинкиназы, фосфорилирующие лишь активированные рецепторы, связанные с g-белками. В результате в дальнейшем может происходить:
- •Три механизма передачи сигнала в зависимости от вида мембранных рецепторов
- •Вторичный мессенджер - циклический амф (цАмф).
- •Этапы передачи сигнала
- •Вторичные мессенджеры - инозитолтрифосфат и даг.
- •Этапы передачи сигнала
- •Вторичный мессенджер - циклический гмф (цГмф).
- •Иерархия гормонов.
- •Регуляция некоторых гормональных систем Гормоны гипоталамуса
- •- Рилизинг-гормоны.
- •Механизм действия
- •Мишени и эффекты
- •Патология Гипофункция
- •Гиперфункция
- •Липотропный гормон - представляет собой полипептид из 91 аминокислоты.
- •- Меланоцитстимулирующие гормоны
- •Функции
- •Рецепторы мсг
- •3. Сосудистая система
- •4. Гепатоциты
- •Патология Гипофункция
- •Синтез мелатонина (а также серотонина и ниацина) из триптофана.
- •Рецепторы мелатонина
- •Основные функции
- •Гормоны регулирующие обмен кальция.
- •1. Кальцитриол – активная форма витамина d3.
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Регуляция обмена кальция.
- •Регуляция синтеза паратирина.
- •Патология
- •Реакции синтеза катехоламинов
- •Регуляция синтеза и секреции
- •Катаболизм норадреналина.
- •Патология
- •Гормоны гипофизарно-надпочечниковой системы.
- •Адренокортикотропный гормон (актг, кортикотропин, кортикотропный гормон).
- •Регуляция синтеза и секреции
- •Механизм действия
- •Белковый обмен
- •3. Углеводный обмен
- •Гиперфункция коры надпочечников также может быть первичного и вторичного характера.
- •- Минералокортикоиды
- •Строение - минералокортикоиды являются производными холестерола. Основным гормоном у человека является альдостерон.
- •Синтез - осуществляется в клубочковой зоне коры надпочечников (схема синтеза).
- •Регуляция синтеза и секреции
- •Активация ренин-ангиотензиновой системы
- •Активация ренин-ангиотензин-альдостероновой системы
- •Мишени и эффекты
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •3. Тиреоидные гормоны (йодтиронины).
- •Представляют собой йодированные производные аминокислоты тирозина (Tyr, y):
- •Трийодтиронин (т3);
- •Мишени и эффекты
- •Патология
- •Гормоны поджелудочной железы.
- •Инсулин
- •Гексамер инсулина.
- •Инкретины
- •Биологическое действие инкретинов
- •Механизм действия.
- •2. Глюкагон
- •Мишени и эффекты
- •Патология
- •Диффузная эндокринная система.
- •Пептидные гормоны жкт
- •Основные эффекты влияния гастроинтестинальных гормонов на пищеварительные функции.
- •Патология
- •Гастрин
- •Биологическая роль
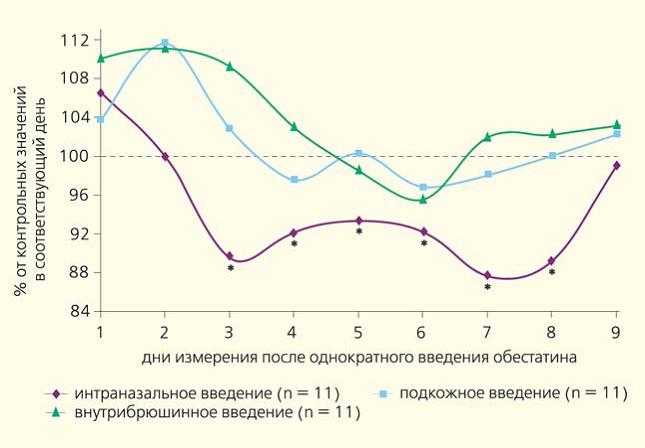
- •Динамика потребления корма после однократного введения обестатина в дозе 300 нМ/кг.() Гормоны репродуктивной функции
- •Окситоцин
- •Молекула окситоцина
- •Биологическая роль.
- •Пролактин (маммотропин, лактотропный гормон (лтг)
- •У женщин
- •У мужчин
- •Патология
- •Гонадотропные гормоны
- •Уровень fsh во время менструального цикла.
- •Биологические эффекты у мужчин
- •У женщин
- •Патология Гипофункция. Недостаток гонадотропинов связанный с заболеваниями гипофиза приводит к:
- •Гиперфункция.
- •Женские половые гормоны.
- •Эстрогены
- •Строение женских половых гормонов
- •Уровень эстрадиола во время менструального цикла.
- •Гормональный цикл женщины:
- •Аллопрегнанолон.
- •Уровень прогестерона во время менструального цикла.
- •Гиперфункция
- •Гормоны почек Эритропоэтин
- •Механизм действия.
- •Предсердный натрийуретический пептид
- •Механизм действия.
- •Биологические эффекты.
- •Сердце и сосуды
- •Жировая ткань
- •Диагностическое значение
- •Гормоны тимуса. Тимозин. Тимопоэтин. Тимулин. Регуляторные функции гормонов тимуса.
- •Патология Гипоадипонектинемия.
Патология
Апудо́мы — опухоли, исходящие из апудоцитов. В настоящее время есть описание следующих видов апудом:
ВИПома (синдром Вернера-Моррисона, панкреатическая холера, синдром водной диареи-гипокалиемии-ахлоргидрии);
Гастринома - опухоль вырабатывает большее количество гастрина. В результате происходит чрезмерная продукция соляной кислоты и пепсина;
Глюкагонома - опухоль (обычно злокачественная) альфа-клеток панкреатических островков. Характеризуется: мигрирующим эрозивным дерматозом, ангулярным хейлитом (заеда в уголках рта), стоматитом, глосситом, гипергликемией, нормохромной анемией;
Карциноид - опухоль ЖКТ исходящие из энтерохромаффинных ЕС-клеток, локализующихся в ЖКТ от кардиального отдела желудка до прямой кишки, поджелудочной железе, желчном пузыре, урогенитальном тракте, слизистой оболочке бронхов и вилочковой железе. Характеризуется гипотонией и приступами покраснения лица и верхней половины туловища. Опухоли секретируют главным образом серотонин, калликреин, гистамин, простагландины, нейропептид К, нейрокинин А и вещество Р, обладающие вазоактивными свойствами.
Нейротензинома N-клетки, продуцирующие нейротензин находятся в поджелудочной железе. Нейротензиномы наряду с нейротензином содержат также гастрин, ПП и глюкагон в соотношении 79:18:3:1. У больных выявляется клиническая картина ВИПомы так как ВИП и нейротензин имеют практически одинаковый биологический эффект, включая вазодилатацию, гипотензию, снижение секреции желудочного сока и перистальтики кишечника.
ППома - опухоль поджелудочной железы, секретирующая панкреатический полипептид (ПП). Клинические проявления отсутствуют. Часто диагностируется после метастазирования в печень;
Соматостатинома - злокачественная медленно растущая опухоль, характеризуется повышением уровня соматостатина. Различают:
• соматостатиному из дельта-клеток поджелудочной железы;
• апудому, секретирующую соматостатин — опухоль двенадцатиперстной кишки.
Диагноз на основании клиники и повышения уровня соматостатина в крови.
Гастрин
Гастри́н — гормон, вырабатываемый G-клетками желудка, расположенными в основном в пилорическом отделе желудка, а также D-клетками поджелудочной железы.
Химическое строение
Молекулы гастрина имеют линейную пространственную структуру. Существует три основных естественных формы гастрина:
«большой гастрин», или гастрин-34 — полипептид из 34 аминокислот,
«малый гастрин», или гастрин-17, состоящий из 17 аминокислот, и
«минигастрин», или гастрин-14, состоящий из 14 аминокислот.
Все гастрины гомологичны по химической структуре. Активной частью молекул гастринов, связывающейся со специфическими гастриновыми рецепторами, является сайт из 5 аминокислот. Синтетический аналог природных гастринов — пентагастрин — состоит как раз из этих 5 аминокислот.
Гастрин-34 производится в основном поджелудочной железой, тогда как гастрин-17 и гастрин-14 производятся в основном в желудке.
Биологическая роль
- Гастрин связывается со специфическими метаботропными гастриновыми рецепторами в желудке. Эффекты гормона реализуются посредством повышения активности аденилатциклазы. В результате усиления аденилатциклазной активности в париетальных клетках желудка происходит увеличение секреции желудочного сока, в особенности соляной кислоты.
Рецепторы к гастрину имеются и в тонкой кишке и поджелудочной железе.
Биологические эффекты гастрина:
повышает секрецию пепсиногена главными клетками желудка, и кислотность желудочного сока;
увеличивает секрецию бикарбонатов и слизи (гликопротеины [гликозоаминогликаны] и вода) в слизистой желудка;
тормозит опорожнение желудка;
увеличивает продукцию простагландина-E2 (PGE2) в слизистой желудка, что приводит к местному расширению сосудов, усилению кровоснабжения и физиологическому отёку слизистой желудка и способствует миграции лейкоцитов в слизистую;
стимулирует секрецию секретина, холецистокинина, соматостатина и ряда других гормонально активных кишечных и панкреатических пептидов, а также секрецию кишечных и панкреатических ферментов.
Секреция гастрина повышается:
в ответ на холинергическую (блуждающим нервом) и в меньшей степени на симпатическую стимуляцию желудка;
инсулином, гистамином, присутствием в желудке или в плазме крови олигопептидов и свободных аминокислот — продуктов расщепления белков;
при стрессе (вследствие усиления симпатической стимуляции желудка);
при высоком уровне глюкокортикоидов;
при гиперкальциемии;
при угнетении секреции соляной кислоты, например, при приёме ингибиторов протонного насоса или блокаторов H2-гистаминовых рецепторов. При приёме этих лекарств возникает выраженная гипергастринемия, что может вызывать феномен «кислотного рикошета» при их резкой отмене — секреция кислоты может превысить уровень, который был до лечения.
(в меньшей степени) при инфекции желудка Helicobacter pylori.
Угнетается секреция гастрина:
высоким уровнем соляной кислоты в желудке (регуляция секреции гастрина с помощью отрицательной обратной связи),
простагландином Е,
эндогенными опиоидами — эндорфинами и энкефалинами,
аденозином,
кальцитонином,
соматостатин наиболее значительно угнетает секрецию гастрина;
холецистокинином и секретином. Физиологическое значение этого механизма состоит в уменьшении секреции кислоты и пепсина в желудке после начала кишечной фазы пищеварения. В свою очередь уровни секретина и холецистокинина зависят от pH поступающей в двенадцатиперстную кишку пищи.
Патология
Чрезмерная секреция гастрина осуществляется клетками опухоли, продуцирующими гастрин, в желудке или поджелудочной железе при синдроме Золлингера — Эллисона, в случае доброкачественной или злокачественной гастриномы.
Повышенные концентрации гастрина при синдроме Золлингера-Эллисона вызывают:
гипертрофию слизистой желудка, усиление её складчатости,
функциональную гиперплазию желёз желудка, главных и париетальных клеток.
гиперсекрецию соляной кислоты и пепсина, что вызывает у больных развитие гастрита, язвенной болезни желудка или двенадцатиперстной кишки, гастроэзофагеальный рефлюкс.
Холецистокинин
Холецистокини́н (CCK; вначале получил название - панкреозимин) (греч. - двигающий жёлчный пузырь) — нейропептидный гормон, вырабатываемый I-клетками слизистой оболочки двенадцатиперстной кишки и проксимальным отделом тощей кишки. Холецистокинин обнаружен в панкреатических островках, различных кишечных и мозговых нейронах.
Образуется из предшественника – препрохолецистокинина путём нескольких посттрансляционных модификаций. Холецистокинин это целое семейство различных по длине полипептидов. Подобно гастрину имеет одинаковый с ним 5-аминокислотный домен. В слизистой оболочке тонкой кишки выявлены 3 молекулярные формы холецистокинина, различающиеся по числу аминокислотных остатков:
холецистокинин-8 (приходится 60-70 %.),
холецистокинин-12 и
холецистокинин-ЗЗ.
Низкомолекулярные формы холецистокинина инакивируются при прохождении через печень, в то время как крупномолекулярный холецистокинин попадает из печени в системный кровоток. Концентрация холецистокинина в крови здорового человека 5—800 нг/л. Холецистокинин может попадать в мочу, сохраняя при этом биологическую активность (урохолецистокинин).
Стимуляторами секреции холецистокинина являются:
поступающие из желудка в составе химуса белки (аминокислоты), жиры (особенно жирные кислоты с длинной цепью), компоненты жёлчегонных трав, кислоты (но не углеводы);
ССК-рилизинг пептид – паракринный фактор, секретируемый энтероцитами слизистой ЖКТ;
ацетилхолин, выделяемый окончаниями парасимпатической нервной системы (n. vagus).
Ингибитором секреции холецистокинина является:
соматостатин;
трипсин (протеаза сока поджелудочной железы) гидролизует ССК-рилизинг пептид и таким образом контролирует синтез ССК.
В ацинарных клетках поджелудочной железы имеются рецепторы ССК – холецистокинин А рецептор (ССКА), в мозгу и желудке - холецистокинин В рецептор (ССКВ). В ЦНС присутствуют большое количество рецепторов ССК, хотя гормон не проникает через ГЭБ.
С рецептором ССКВ связывается также гормон гастрин, регулирующий секрецию соляной кислоты и рост слизистой желудка.
Биологическая роль.
Гормон способствует перевариванию белков и жиров и выступает регулятором многих процессов в организме:
обладает свойствами антидепрессантов;
участвует в формировании эмоциий страха и в патогенезе шизофрении;
влияет на пищевое поведение человека. Вызывает чувство сытости и контролирует аппетит;
стимулирует расслабление сфинктера Одди (Глиссона) и сокращение жёлчного пузыря;
стимулирует секрецию пищеварительных ферментов ацинарными клетками поджелудочной железы;
увеличивает ток печёночной желчи. Снижает давление в билиарной системе;
повышает панкреатическую секрецию;
вызывает сокращение привратника желудка, что тормозит перемещение переваренной пищи в двенадцатиперстную кишку;
блокирует секрецию соляной кислоты париетальными клетками желудка;
В эксперименте введение CCK вызывает тошноту и тревогу, а также чувство насыщения. В отличии от гормона грелина ССК стимулирует эффекты n. vagus, причём разные формы ССК дают разные эффекты.
Недавно было установлено, что ССК играет важную роль в формировании устойчивости к опиоидам (морфину, героину) и в формировании гиперчувствительности к боли при отмене опиатов.
Грелин
Грелин — пептидный гормон (28 аминокислотных остатков), обладающий свойствами гонадолиберина и другими метаболическими и эндокринными функциями. Известен как гормон, регулирующий аппетит или повышающий секрецию гормона роста. Открыт в 1999 году Масаясу Коиджима.
Прогормон грелина синтезируется в основном P/D1-клетками слизистой оболочки фундального отдела желудка и эпсилон-клетками поджелудочной железы.
В 2005 году было установлено, что грелин образуется вместе с гормоном обестатином при расщеплении общего предшественника – грелин/обестатин препропептида (117 аминокислотных остатка). Вначале при расщеплении образуется прогрелин, а уже из него грелин и С-грелин (обестатин). Активная форма грелина, которая может активировать рецептор – это ацилированный (октаноилированный) ацил грелин. В активации участвует фермент грелин О-ацилтрансфераза.
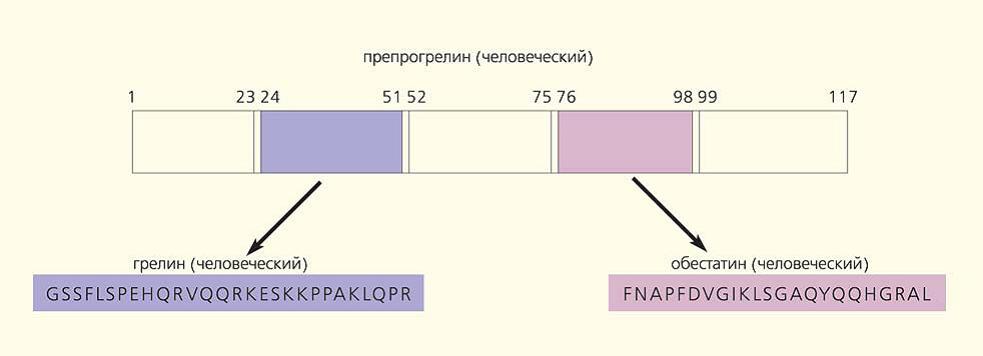
Образование грелина и обестатина из предшественника. Хиразова Е.Э. (2013).
Грелин вырабатывается также в дугообразном ядре (nucleus arcuatae) гипоталамуса и стимулирует секрецию гормона роста передней долей гипофиза.
Рецепторы грелина экспрессируются нейронами в дугообразном ядре и вентромедиальном гипоталамусе. Рецептор грелина - это рецептор связанный с G-белком (GPCR), известен как рецептор стимулятора гормона роста (GHS-R).
Биологическая роль:
грелин повышает потребление пищи и способствует увеличению массы жировой ткани. Уровень грелина в плазме крови перед приемами пищи увеличивается, а после приемов пищи уменьшается. Он дополняет действие гормона «насыщения» - лептина, У людей, страдающих анорексией — высокий уровень грелина в плазме крови, а у страдающих ожирением - ниже, чем у более худых людей;
при нехватки сна вырабатывается грелин, который стимулирует аппетит и блокирует выработку лептина. Это послужило основанием разработки «вакцины против ожирения» - антител, связывающихе грелин;
важен для когнитивной адаптации, процесса обучения и формирования памяти. На пустой желудок обучение проходит эффективнее, так как уровень грелина при этом наиболее высок;
У зародышей грелин вырабатывается тканью лёгкого и стимулирует рост органа;
способствует активизации эндотелиальной изоформы синтазы оксида азота (eNOS).
активизируют клетки в дугообразном ядре, которые секретируют нейропептид Y и возбуждают аппетит;
активирует мезолимбическую холинэргическую/дофаминергическую систему вознаграждения при приёме пищи. Она же участвует в формировании механизмов наркотической и алкогольной зависимости;
подавляет афферентную чувствительность блуждающего нерва желудка при его растяжении едой;
способствует пролиферации клеток кишечника и слизистой желудка, а также подавляет в них апоптоз при воспалительных процессах и воздействии оксидантного стресса;
подавляет провоспалительные механизмы и активирует антивоспалительные при колитах, сепсисе и моделировании у животных ишемии/реперфузии.
Современное представление о патохимии ожирения.
В настоящее время пишли к выводу, что лептин, инсулин и грелин – главные действующие лица в регуляции чувства голода и насыщения. Инсулин снижает выработку грелина и повышает секрецию лептина, тогда как лептин снижает секрецию инсулина. Низкий уровень инсулина стимулирует повышение уровня грелина, который формирует чувство голода и способствует потреблению пищи. При этом происходит высвобождение жирных кислот из адипоцитов, они уменьшаются в размерах и снижается секреция лептина. Это в свою очередь подавляет скорость обмена веществ и энергетические траты.
При поступлении питания уровень инсулина возрастает и стимуоирует поступление и накопление жирных кислот в адипоцитах. В результате в жировой ткани увеличивается секреция лептина, который стимулирует выработку адипонектина (гормон жировой ткани). Адипонектин регулирует метаболизм глюкозы и жирных кислот, способствует образованию новых адипоцитов. Считается, что высокий уровень адипонектина участвует в механизме формирования метаболических нарушений таких как атеросклероз, ожирение, неалкогольное жировое перерождении печени и метаболический синдром. В случае развития резистентности к лептину, уровень адипонектина снижается несмотря на высокую концентрацию лептина, причём адипоциты продуцируют всё новые и новые порции лептина. Жирные кислоты начинают накапливаться в мышечной ткани и печени. Страдает чувствительность к инсулину. В свою очередь повышение уровня инсулина ингибирует активность гормон зависимой липазы (HSL, hormone sensitive lipase) – важнейшего фермента мышечной ткани, участвующего в утилизации запасов жира как энергетических источников. Липаза активируется в ответ на действие катехоламинов и АКТГ. Подавление активности HSL при гиперинсулинемии приводит к ещё большему накоплению жира в мышечной ткани. Формируется порочный круг – гиперлептинемия – резистентность к лептину – гиперинсулинемия – резистентность к инсулину – избыточное потребление пищи – развитие ожирения.
Обестатин
Обестатин – (от англ. obesity — ожирение) - гормон секретируемый клетками слизистой желудка и кишечника. Открыт в 2005 году сотрудниками Медицинского факультета Стэнфордского университета благодаря компьютерному анализу генома человека. До сих пор нет точных данных о посттрансляционных модификациях приводящих к получению активной формы обестатина. Время жизни гормона очень мало — примерно 10 мин.
Относится к пептидным гормонам (24 аминокислотных остатка), кодируется геном общим с грелином. В результате посттрансляционного расщепления из общего предшественника образуются грелин и обестатин. Причина, почему из одного предшественника получается два гормона с противоположными свойствами – непонятна.
Обестатин найден в тканях ЖКТ, селезёнке, грудной железе, а также в составе грудного молока и в плазме крови. Рецептор обестатина — GPR39 обнаружен и на периферии и в центральной нервной системе.
Содержание его в плазме крови уменьшается при голодании.
Биологическая роль:
угнетает секрецию гормона роста;
снижает потребление пищи, индуцированное грелином;
замедляет опорожнение желудка и моторику кишечника. Является составной частью гормональной сети - кишечник-мозг – участвующей в регуляции механизмов «сытость – голод».
относится к анорексическим гормонам – снижающим потребление пищи и массу тела. У тучных людей – низкий уровень обестатина.
участвует в процессах формирования памяти;
регулирует сон;
влияет на клеточную пролиферацию;
повышает секрецию сока поджелудочной железы;
ингибирует секрецию инсулина, индуцируемую глюкозой.
Изучение соотношения уровня обестатин/грелин в плазме крови и в ЖКТ даёт основание использовать эти данные в диагностике и лечении некоторых заболеваний:, ожирения, диабета II типа, синдрома Прадер-Вилли (ожирение, миотония) и синдрома раздражённой толстой кишки.