
- •Пензенский государственный университет Кафедра «Химия»
- •Текст лекции № 2
- •. Пенза Содержание
- •Введение
- •1.Периодический закон д.И. Менделеева
- •2. Структура периодической системы (пс)
- •3. Семейства элементов
- •4. Размеры атомов и ионов
- •5.Энергия ионизации – количественная мера восстановительных свойств атомов
- •6. Сродство к электрону – количественная мера окислительных свойств атома
- •7. Электроотрицательность атома – количественная мера окислительно-восстановительных свойств элемента
- •Заключение
7. Электроотрицательность атома – количественная мера окислительно-восстановительных свойств элемента
Электроотрицательность ЭО – это способность атома, химически связанного с другим атомом, притягивать на себя электронную плотность химической связи.
Имеется около двадцати шкал электроотрицательности. Согласно Малликену(США) электроотрицательность равна полусумме энергии ионизации и энергии сродства к электрону:
ЭО = ½ (I + E).
Сложность использования подхода Малликена заключается в том, что нет надежных методов количественного определения энергии сродства к электрону. Поэтому Полинг (США) ввел относительную шкалу электроотрицательности, приняв электроотрицательность фтора равной четырем.
Относительно
этих двух величин рассчитываются ЭО
остальных элементов.

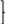

В периодах слева направо электроотрицательность возрастает, в главных подгруппах сверху вниз – убывает (рис. 5).
В периодах
F
В главныхподгруппах
Рис.5. Изменение
электроотрицательности в ПС
Наименьшие значения электоотрицательности имеют s-элементы I группы (щелочные металлы); Наибольшие значения электроотрицательности имеют p-элементы VIII и VI групп.
В побочных подгруппах ЭО элементов изменяется немонотонно.
Вывод: таким образом, электроотрицательность характеризует окислительно-восстановительные свойства атомов.
Помимо рассмотренных здесь периодических свойств существуют и другие, такие, как степень окисления, составы высших водородных соединений, составы высших кислородных соединений, термодинамические, электролитические свойства и многие другие. С некоторыми из них мы познакомимся позже.
Заключение
Зная квантовые числа, понятие «атомная орбиталь», принципы минимума энергии и запрета Паули, правила Гунда и Клечковского ,основываясь на понимании периодического закона Д.И. Менделеева, можно представить электронную конфигурацию любого элемента и предсказать свойства элементов.
