
- •Пензенский государственный университет Кафедра «Химия»
- •Текст лекции № 2
- •. Пенза Содержание
- •Введение
- •1.Периодический закон д.И. Менделеева
- •2. Структура периодической системы (пс)
- •3. Семейства элементов
- •4. Размеры атомов и ионов
- •5.Энергия ионизации – количественная мера восстановительных свойств атомов
- •6. Сродство к электрону – количественная мера окислительных свойств атома
- •7. Электроотрицательность атома – количественная мера окислительно-восстановительных свойств элемента
- •Заключение
5.Энергия ионизации – количественная мера восстановительных свойств атомов

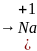 окисляется
(отдает
электроны)
окисляется
(отдает
электроны)
(повышает степень окисления)
В
общем виде:
 .
.
Энергия ионизации – это количество энергии, необходимое для отрыва одного электрона от невозбужденного атома и превращения его в положительно заряженный катион.
Обозначают
энергию ионизации символами I
или
 и выражают в электрон-вольтах на атом
[эВ/атом] или в кДж/моль.
и выражают в электрон-вольтах на атом
[эВ/атом] или в кДж/моль.
Напомним, что 1эВ – это энергия, которую приобретает электрон в ускоряющем электрическом поле с разностью потенциалов 1В (1эВ/атом = 96,5 кДж/моль).
В периодах слева направо энергия ионизации возрастает (то есть атомы все труднее отдают электроны) так как возрастает заряд ядра и, как следствие, уменьшается радиус атома и возрастает притяжение наружных электронов к ядру (рис.3).
В главных подгруппах сверху вниз энергия ионизации убывает (то есть атомы все легче отдают электроны), так как радиус атомов сверху вниз возрастает и ослабевает притяжение наружных электронов к ядру.
В периодах
В главныхподгруппах
Рис. 3. Изменение энергии
ио-низации в ПС

Минимальную энергию ионизации имеют s-элементы I группы (щелочные металлы);
Максимальной энергией ионизации обладают p-элементы VIII группы (инертные газы).
В побочных подгруппах при переходе от четвертого периода к пятому энергия ионизации увеличивается, а при переходе от пятого периода к шестому, где появляются лантан и лантаноиды, остается неизменным или даже немного уменьшается (эффект лантаноидного сжатия).
Вывод: энергия ионизации характеризует восстановительную способность атомов: чем больше энергия ионизации атома, тем меньше его восстановительная способность (то есть, тем труднее атом отдает электроны).
6. Сродство к электрону – количественная мера окислительных свойств атома
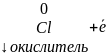
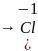 восстанавливается
(принимает электроны)
восстанавливается
(принимает электроны)
(понижает степень окисления)
.
Сродство к электрону E – это энергетический эффект процесса присоединения одного электрона к электронейтральному атому и превращения его в отрицательно заряженный анион.
Также, как и энергия ионизации, выражается в эВ/атом.
В периодах слева направо сродство к электрону возрастает (то есть атомы все легче присоединяют электроны), так как уменьшается радиус атомов и возрастает притяжение электронов к ядру (рис.4).
В главных подгруппах сверху вниз сродство к электрону убывает (то есть атомы все труднее принимают электроны), так как радиус атомов сверху вниз возрастает и притяжение наружных электронов к ядру ослабевает.
В периодах
В главныхподгруппах
Рис. 4. Измене-ние сродства
к электрону в ПС
Минимальным сродством к электрону обладают s-элементы II группы (бериллий, магний и щелочнoземельные металлы);
Максимальным сродством к электрону обладают обладают p-элементы VII группы (галогены).
В побочных подгруппах при переходе от четвертого периода к пятому сродство к электрону увеличивается, а при переходе от пятого периода к шестому, где появляются лантан и лантаноиды, остается неизменным или даже немного уменьшается,
Вывод: сродство к электрону характеризует окислительные свойства атома: чем больше сродство к электрону атома, тем больше его окислительная способность (то есть, тем легче атом присоединяет электроны).
В соответствии со сказанным, самыми сильными восстановителями являются элементы, находящиеся в начале каждого периода и в конце первой главной подгруппы (элементы цезий, франций). Их атомы имеют самые низкие значения энергий ионизации.
Самыми сильными окислителями являются элементы, располагающиеся в правом верхнем углу таблицы периодической системы (фтор, кислород, хлор). Атомы этих элементов обладают наивысшими значениями сродства к электрону.
