
- •Биохимия Водного и минерального обмена (Кухта)
- •Осмолярность, осмоляльность и тоничность – важные понятия в характеристике водно-солевого обмена
- •Распределение воды связано с общим весом тела (овт).
- •Количество воды в организме тщательно регулируется
- •Гипер и гипогидратация – основные формы проявления нарушений водного обмена
- •Уровень натрия в плазме крови легко измеряемый показатель водно-солевого обмена.
- •Калий – главный внутриклеточный катион
- •Уровень калия в плазме- важный клинический показатель
- •Хлориды - главные анионы внеклеточного пространства
- •Нарушения баланса хлоридов проявляются симптомами нарушения баланса натрия
- •Минеральные вещества.
- •Кальций
Минеральные вещества.
Все минеральные вещества в зависимости от их концентрации подразделяются на макро- и микроэлементы.
Макроэлементы. К ним относят те минеральные вещества, содержание которых превышает 50 мг/кг массы тела. Прежде всего, это «классические электролиты» – натрий и калий (об обмене этих катионов см. гл. «Водный обмен»), а также кальций, магний, фосфат, хлорид, сульфат.
Микроэлементы. Содержание этих «следовых» элементов – менее 50 мг/кг массы тела. К микроэлементам относят также и железо, хотя его концентрация превышает указанную величину.
По своему биологическому значению минеральные вещества можно разделить на: незаменимые, не являющиеся незаменимыми, токсичные.
Функция минеральных веществ:
поддержка электролитного баланса
поддержка определённого осмотического давления
создание определённых условий растворимости
участие в механизмах возбудимости
влияние на обменные процессы путём активирования или ингибирования ферментов
минерализация костей скелета и зубов.
Макроэлементы
Электролиты важны для поддержания фундаментальных клеточных функций. В здоровом организме поддерживается постоянство электролитного состава. Концентрация электролитов внутри клетки и во внеклеточном пространстве существенно различаются:
КАТИОНЫ |
Плазма (ммоль/л) |
Клетка (ммоль/л) |
Na+ |
142 |
10 |
K+ |
4 |
155 |
Ca++ |
2,5 |
<0,001 (cвободный Сa++) |
Mg++ |
0,9 |
15 |
АНИОНЫ |
|
|
Cl- |
102 |
8 |
HCO3 - |
25 |
10 |
HPO4 2- |
1 |
65 (вкл. органич. фосфат) |
SO4- |
0,5 |
10 |
Кальций
Большая часть кальция в организме находится в связанной форме - в виде Са-апатита костной ткани.
Общее содержание кальция в плазме крови - 2,0-2,5 ммоль/л. Половина этого количества приходится на ионизированный (диффузионный) кальций, способный проходить через клеточные мембраны. Кальций, связанный с белками крови, называется недиффузионным и он не способен проникать в клетки. Небольшая часть кальция плазмы крови находится в составе цитратов и фосфатов. Регулируется уровень кальция в крови гормонами-антагонистами: паратирином и тиреокальцитонином (механизм действия этих гормонов см. в гл. Гормоны), а также витамином D.
Концентрация Са2+ в цитозоле клетки составляет 0,1-10 мкмоль/л, в кальцисомах (мембраны эдоплазматического ретикулума) и митохондриях - на порядок больше. Внутриклеточный гомеостаз кальция жестко регулируется.
Роль кальция в организме.
Соли кальция составляют основу скелета и зубов. Ионы кальция принимают участие в многочисленных процессах, определяющих метаболизм клетки. Они регулируют нервно-мышечную возбудимость, сократительную и секреторную активности, проницаемость клеточных мембран, адгезию и рост клеток. Са2+ активирует процесс свёртывания крови.
Всасывание кальция и выведение из организма.
Кальций всасывается из кишечника в кровь с помощью специального Са2л-связывающего протеина, синтезируемого слизистой кишечника. Этот белок осуществляет свою функцию совместно с Са2+ -зависимой АТФ-азой. Стимулятором синтеза Са2+-связывающего протеина является 1,25-дигидрокси-холекальциферол (кальцитриол).
Усвоению кальция способствует белок пищи, лактоза, лимонная кислота. Затрудняют его всасывание фитиновая кислота (её много в зерновых растениях), а также жиры и щавелевая кислота, образующие с кальцием нерастворимые, плохо всасывающиеся соли. Избыточное содержание неорганических фосфатов в пище также затрудняет всасывание Са2+ .
Выводится кальций преимущественно через кишечник, 15% выделяется через почки, незначительная часть - со слюной. Выраженной способностью секретировать кальций обладает лактирующая молочная железа.
Регуляция внутриклеточного обмена кальция.
Поступление кальция в клетку регулируется нейрогормональными сигналами, одни из которых увеличивают скорость вхождения Са + в клетку из межклеточного пространства, другие - высвобождение иона из внутриклеточных депо. Поскольку действие многих нестероидных гормонов на клетку опосредуется кальцием, этот элемент, наряду с циклическими нуклеотидами, считается вторичным посредником в реализации механизма действия гормонов.
Из внеклеточного пространства Са2+ попадает в клетку через кальциевый канал. Этот интегративный белок состоит из 5 субъединиц, одна из которых является собственно каналом - водной порой, образуемой гидрофильными аминокислотами. Другая представляет собой воротный механизм, открывающийся при деполяризации клетки (при поступлении Са2+). Отдельная субъединица называется метаболическими воротами, которые способны фосфорилироваться и дефосфорилироваться. Фосфорилирование осуществляется цАМФ-зависимой протеинкиназой А - следовательно, кальциевый канал активируется гормона-
ми, механизм действия которых реализуется через цАМФ. Дефосфорилирование, т.е. инактивация канала, катализируется цитоплазматической фосфата-зой (фермент состоит из 2-х субъединиц: а (61кДа) связывает калмодулин, Р (19 кДа) - Са2+, после присоединения калмодулина фосфатаза активируется).
В плазматической мембране клеток имеется ещё один кальциевый канал - лиганд-регулнруемый кальциевый канал (его лигандами являются внеклеточная АТФ, цАДФ-рибоза, лейкотриены).
Высвобождение Са2+ из внутриклеточных депо является достаточно сложным процессом. Вначале, в ответ на нейрогормональный стимул, активируется фосфолипаза С. Этот фермент гидролизует минорный фосфолипид плазматической мембраны ФИФ2 (фосфатидилинозитол-4,5- бифосфат) на ДАТ (диацшглицерол) и ИТФ (инозитол-1,4,5-трифосфат).бифосфат) (диацшглицерол)
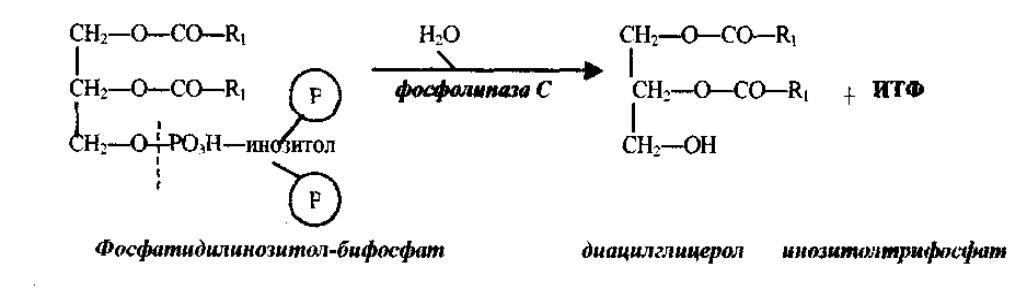
Эффект ИТФ и ДАТ синергичен (рис.14.1): ИТФ присоединяется к специфическому рецептору кальцисомы; конформационные изменения рецептора влекут за собой открытие ворот, запиравших канал для прохождения Са2+ из кальцисомы; высвободившийся из депо кальций связывается с протеинкина-зой С ДАГ повышает активность этой Са-зависимой протеинкиназы С.
Протеинкиназа С фосфосфорилирует различные белки (ферменты), изменяя тем самым их активность. Через фосфатидилинозитольный каскад опосредуются многие метаболические эффекты, например, гликогенолиз в печёночных клетках, высвобождение серотонина и агрегация тромбоцитов, выброс гистамина из тучных клеток, сокращение гладких мышц.
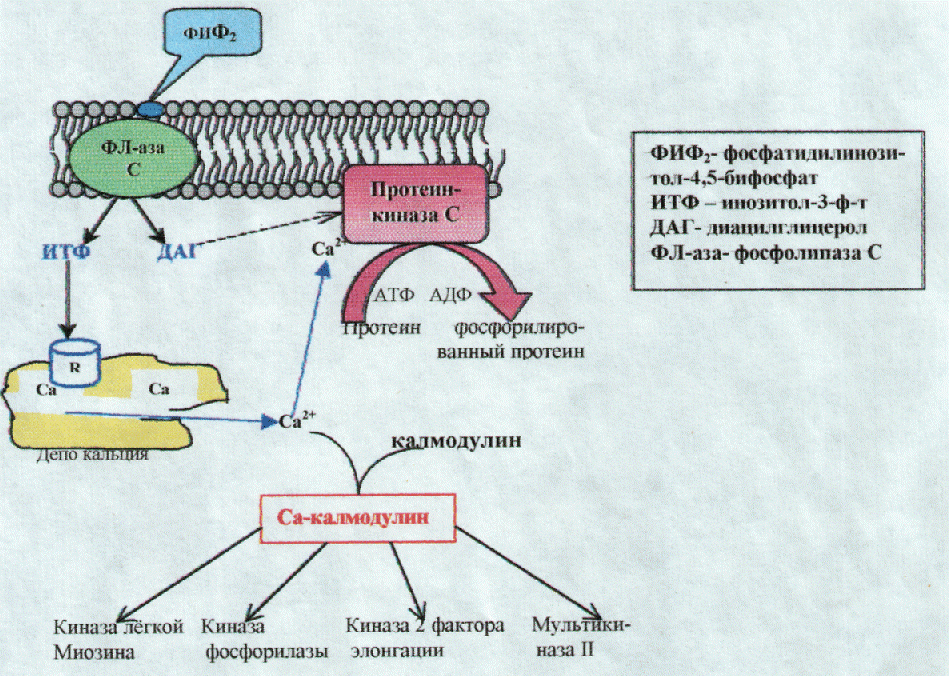
Рис. 14.1. Высвобождение Са++ из внутриклеточных депо.
Ионы кальция, поступившие в клетку извне или высвободившиеся из внутриклеточных депо, действуют 2 путями:
1. непосредственно связывают отрицательно заряженные группы на поверхности мембран, изменяя тем самым их полярность и возбудимость; кроме того, Са++ может реагировать с отрицательно заряженными группами белков, изменяя их конформацию и свойства (например, связывая СОО" группы у-карбокси-глутаминовой кислоты в составе факторов свёртывающей системы крови)
2. реализовать свой эффект с участием калмодулина. Калмодулин является частью множества Са++ - связывающих белков. Его молекулярная масса = 17000
Калмодулин имеет 2 высокоаффинных Са++ -связывающих участка на каждом из своих двух глобулярных доменов. Эти участки формируют почти совмещающиеся спиралъ-петля-спиралъ структуры, называемые EF-рукой. EF-рука - типичная пространственная организация сайтов (участков) связывания кальция во многих Са-связывающих белках.
При повышение концентрации Са2+ в клетке связывание иона с калмодулином сопровождается конформационной перестройкой последнего, приводящей к способности комплекса Са-калмодулин модулировать (отсюда такое название - «калмодулин») активность множества внутриклеточных белков: киназу лёгкой цепи миозина, киназу фосфорилазы, мультикиназу II, активирующую, в свою очередь, путём фосфорилирования ферменты синтеза углеводов (гликогенсинтазу), жирных кислот (ацетил-КоА-карбоксилазу), холестерола (ГМГ-КоА-редуктазу), фосфолипазу А2, эпидермальный фактор роста, ассоциацию микротубулина.
Выход кальция из клетки. Этот процесс осуществляется в основном 2 -мя внутриклеточными механизмами: Са++-АТФ-азой и Na+-Са++-антипортом.
Са-АТФ-аза активируется Са-калмодулиновым комплексом. Связывание кальция этим ферментом и транспорт иона через плазматическую мембрану в межклеточное пространство требует затраты энергии:
Следовательно, процесс саморегуляции внутриклеточного гомеостаза Са++ осуществляется по принципу обратной связи: выход ионов кальция в цитозоль клетки активирует калмодулин, а образовавшийся Са-калмодулиновый комплекс, активируя многочисленные ферменты, одновременно устраняет избыток кальция, ускоряя его выведение за счет активации Са++-АТФ-азы.
Na+-Са++- антипорт.. Способность клетки освобождаться от кальция связана также с функционированием Nа+/К+-АТФ-азы: поступление Na+ в клетку включает в работу механизм, ответственный за выход из неё кальция.
Нарушения обмена кальция.
Недостаток кальция. Недостаток кальция приводит к развитию одного из самых распространённых заболеваний на земле - остеопорозу. В настоящее время им страдает более 200 млн. человек, из них 25 млн. имеют переломы костей. Количество женщин, умирающих от осложнений остеопороза, превышает их смертность от всех видов рака. Остеопороз характеризуется уменьшением массы и ухудшением микроархитектуры костной ткани, вследствие чего кости становятся хрупкими. У мужчин потеря массы кости начинает преобладать над остеосинтезом примерно с середины третьего десятилетия жизни, составляя 0,3-0,5% в год; у женщин она выше, особенно в период менопаузы (до 2-3% в год). Чем лучше был сформирован скелет в юности, тем позже проявляется остеопо-роз. Поэтому профилактика заболевания должна начинаться до 25-30 лет. Максимально возможно замедляют процесс потери костной ткани достаточно высокое содержание в диете кальция и белка, а также витамина Д.
Дефицит кальция в пище или гиповитаминоз Д приводят к гипокалъциемии. В ответ на низкий уровень кальция в сыворотке крови увеличивается секреция паратирина. Этот гормон стимулирует образование активной формы витамина Д - 1,25-Дз (тогда как низкий уровень паратирина - неактивную форму витамина - 24,25-Дз). 1,25-Дз абсолютно необходим для всасывания кальция из кишечника. Паратирин и!,25-Дз действуют синергично, стимулируя активность остебластов и образование кости, а также увеличивая реабсорбцию кальция в дистальных канальцах почек. Когда содержание кальция и витамина Д в пище достаточное, декальцинации кости не происходит. Однако если содержание кальция в диете низкое, паратирин и 1,25-Дз будут причиной деминерализации кости - потеря костной массы является компенсаторной реакцией организма, способствующей поддержанию необходимого уровня кальция в крови. Дефицит витамина Д также приводит к деминерализации кости за счёт повышения секреции паратирина (недостаток витамина Д → снижение уровня кальция в крови → выброс паратирина), это явление называется вторичным гиперпаратиреоидизмом.
Почечный остеопороз. Почечная недостаточность приводит к неспособности образования 1,25-Д3, необходимого для процесса всасывания кальция из кишечника, поэтому источником сывороточного кальция станет кость. Кроме того, при недостатке активной формы витамина Д нарушается реабсорбции кальция почками, что сопровождается развитием гиперфосфатемии (вспомним, что в крови соотношение Са/Р - величина постоянная). Гиперфосфатемия и гипокальциемия стимулируют секрецию паратирина, что приводит к возрастанию потерь кальция костной тканью. При этом усиление декальцинации костей и увеличение их хрупкости одновременно будет сопровождаться кальцификацией мягких тканей (метастатическая калъцификация вследствие связывания кальция избытком фосфатов и образования водорастворимых фосфорнокальциевых солей, легко диффундирующих в различные ткани). В этом случае простое назначение высоких доз витамина Д (вызывающих гиперкальциемию) без терапии связывания фосфатов антацидами только бы усилило метастатическую кальцификацию, т.е. поражение почек, аорты и т.д., а также образованию камней в почках и желчном пузыре.
Гипокалъциемия в детском возрасте, обусловленная чаще всего гиповитаминозом Д и недостаточным потреблением молочных продуктов (основного источника кальция) приводит к заболеванию рахитом, т.е. остеомаляции - размягчению костей.
Типичным симптомом недостатка кальция в организме в любом возрасте является развитие кариеса, непроизвольные подергивания, вплоть до судорожных сокращений, отдельных групп мышц.
Синдром острой недостаточности кальция (чаще отмечается во время оперативных вмешательств на щитовидной железе) проявляется судорогами прямо на операционном столе.
Гиперкальциемия. Повышение уровня кальция в плазме крови вызывается в основном двумя причинами: 1/ гипервитаминозом Д и 2/ гиперпаратиреоидизмом как первичного (аденома паращитовидных желез), так и вторичного характера, особенно при метастазах злокачественной опухоли в кости (см. также выше «вторичный гиперпаратиреоидизм»). Причиной летального исхода при синдроме гиперкальциемии является, как правило, почечная недостаточность.
Суточная потребность. Пищевые источники.
Ежедневная потребность в кальции для взрослых составляет 0,5-0,8 г/сутки. Во время роста и беременности она возрастает вдвое. Изучение обмена кальция у людей различного возраста выявило положительную зависимость между уровнем потреблением кальция и его усвоением, а также существование так называемого порога насыщения, ниже которого начинается распад кости. Кальций, поступающий в количествах ниже пороговых, не может обеспечить полное насыщение им растущего скелета. Снижение содержания этого элемента в рационе питания ниже суточной потребности - высокий риск развития остеопороза, особенно у пожилых женщин (недостаток эстрогенов в период менопаузы приводит к деструкции костной ткани). Вместе с тем при избытке кальция в пище величина его усвоения остаётся постоянной.
Основной источник кальция в питании человека - молоко и сыр (около 1г кальция содержится в 1л молока и 100 г сыра).
Фосфор
Организм человека весьма богат фосфором. Наибольшее его количество (85%) находится в костной ткани.
Фосфор – важнейший вне- и внутриклеточный анион. Большая его часть внутри клетки связана с белками и липидами (так называемы «органический фосфор»). Фосфор внеклеточного пространства находится в виде одно- и двузамещенных фосфатов. В плазме крови эти фосфаты образуют буферную систему, поддерживая физиологическое значение рН при изменениях кислотно-щелочного баланса организма. Соотношение фосфора и кальция в плазме крови взаимосвязано: когда содержание первого повышается, второго – падает.

Рис.14.3. Распределение фосфора в организме человека
Фосфор, не реабсорбировавшийся почечными канальцами, является одним из ингредиентов, определяющих буферные свойства мочи. Роль органического фосфата в организме заключается в том, что он входит в состав многих важнейших соединений:
Нуклеиновых кислот
Фосфолипидов
Служит энергоносителем (в составе АТФ и других нуклеозидтрифосфатов, креатин~Р, макроэргических субстратов гликолиза)
Участвует в работе сигнальных передатчиков гормонов (в составе цАМФ, цГМФ, ИТФ)
Участвует в образовании коферментной формы водорастворимых витаминов (тиаминпирофосфата, пиридоксальфосфата, коферментов рибофлавина и ниацина)
Обуславливает активирование или прекращение функционирования ферментов путём их фосфорилирования.
Регуляция содержания фосфора в организме. Обмен фосфора тесно связан с процессами поступления и освобождения из костей кальция. Поступление кальция в организм повышает выведение фосфора с мочой.
Контроль внеклеточной концентрации фосфора осуществляется почками: под влиянием паратирина реабсорбция его снижается. Эстрогены, тироксин повышают его выведение почками, гормон роста, инсулин и кортизол, напротив, это выведение уменьшают. При ацидозе усиливается выведение фосфора из организма.
Нарушения обмена фосфора.
Гиперфосфатемия. Основная причина этого состояния – нарушение экскреции фосфора почками вследствие почечной недостаточности. Однако уменьшение экскреции фосфатов почками отмечается и при отсутствии заболевания почек – этот симптом является характерным для гипопаратиреоидизма (паратирин тормозит реабсорбцию фосфата). Гиперфосфатемия может быть следствием внутрисосудистого гемолиза.
Гипофосфатемия. Её основными причинами являются гиперпаратиреоидизм, врожденный дефект реабсорбции фосфора в почечных канальцах, серьёзная недостаточность питания, онкологические заболевания. Уменьшение содержания фосфора в крови может быть вызвано инъекциями инсулина при лечении диабетической комы (вслед за глюкозой под влиянием инсулина в клетки проникает и фосфор), при приёме антацидов, например, гидроокиси алюминия.
Проявляется гипофосфатемия мышечной слабостью (недостаток АТФ), которая при падении концентрации фосфора ниже 0,3 ммоль/л может привести к остановке дыхания.
Потребность. Пищевые источники. Основное количество фосфора поступает в организм с такими продуктами питания, как молоко, рыба, хлеб, правда, из последнего этот элемент хуже усваивается из-за высокого содержания в зерновых фитатов.
Суточная потребность – около 1 г.
Магний
Магний относится к незаменимым составным частям тканей и жидкостей организма. В количественном отношении катион магния занимает второе место после натрия (рис. 14.4).
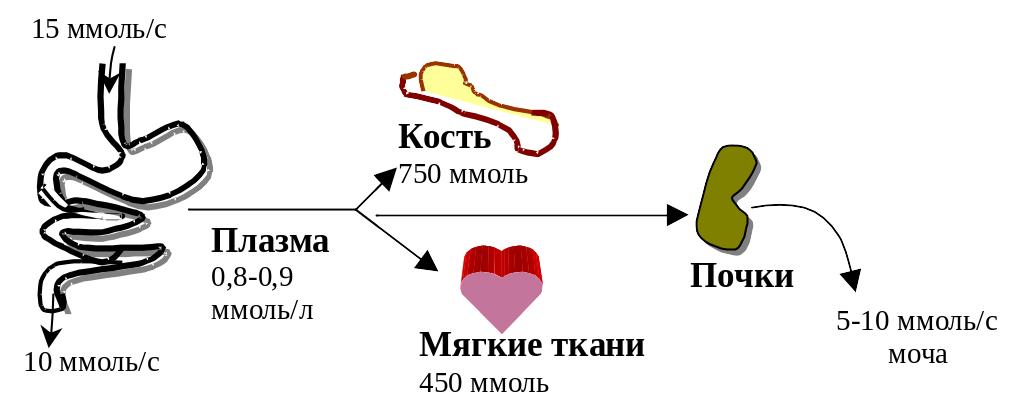
Рис. 14.4. Распределение магния в организме
Участие в метаболизме.
Так как Mg2+ легко образует комплексы с фосфатами, он участвует во всех фосфат-зависимых реакциях, в том числе АТФ, УТФ и ГТФ-зависимых.
Магнием активируется около 300 ферментных систем – основные биохимические процессы, протекающие внутри клетки, являются Mg2+-зависимыми: гликолиз, окислительный метаболизм, трансмембранный транспорт натрия и калия. Магний является кофактором ДНК-полимераз, он играет роль связующего звена при взаимодействии субъединиц рибосом друг с другом, тРНК и факторами трансляции. Он участвует в синтезе трипептида глутатиона.
При любом снижении внутриклеточной концентрации магния изменяются электирические свойства плазматической мембраны и мембран внутриклеточных структур. Mg2+ оказывает влияние на секрецию гормона паратирина.
Нарушения обмена магния.
Повышение концентрации Mg2+ в крови наблюдается редко (иногда наблюдается при почечной недостаточности). Пероральный приём соей магния вызывает диарею.
Дефицит магния. Так как магний в достаточном количестве содержится в продуктах питания, гипомагнийемия обычно связана с общим недостатком питания. Дефицит магния развивается также при нарушении процессов всасывания в кишечнике (поносы), рвоте, осмотическом диурезе (например, при диабете или длительном применении мочегонных препаратов), цитотоксической лекарственной терапии.
Симптомы низкой концентрации Mg2+ в сыворотке крови схожи с таковыми при гипокальциемии, в первую очередь, нарушается нейромышечная функция (подёргивания мышц, тремор, судороги). Появляется чувство страха, отмечаются тревога и раздражительность.
Потребность. Пищевые источники. Минимальная суточная потребность в магнии около 0,2-0,3 г . У детей, беременных и кормящих женщин потребность в этом элементе повышена.
Так как магний являются составной частью хлорофилла, зелёные овощи, наряду со злаками и животной пищей, являются важными пищевыми ресурсами магния.
