
- •Характерні особливості властивостей
- •1. Елементи групи іа
- •Деякі важливі фізичні характеристики s-елементів іа групи наведені у таблиці 1.
- •Лабораторна робота
- •Дослід №4. Відновні властивості пероксиду натрію
- •2. Елементи групи іі а
- •2.1. Фізичні характеристики елементів Фізичні характеристики елементів
- •Лабораторна робота
- •3. Елементи групи іііа
- •3.1. Фізичні характеристики елементів
- •Елементи ivа групи
- •4.1. Фізичні характеристики елементів Деякі важливі фізичні характеристики p-елементів іvа групи наведені у таблиці 8.
- •Лабораторна робота
- •5. Елементи vа групи
- •Деякі важливі відомості про p-елементів vа групи наведені у таблиці 9.
- •5.1. Фізичні характеристики елементів Деякі важливі фізичні характеристики p-елементів vа групи наведені у таблиці 10.
- •Деякі властивості гідроксидів елементів va групи
- •6. Елементи групи vіа
- •6.1. Фізичні характеристики елементів Деякі важливі фізичні характеристики p-елементів viа групи наведені у таблиці 12.
- •Деякі важливі відомості про p-елементиVіа групи наведені у таблиці 13.
- •Лабораторна робота
- •Вправи.
- •7. Елементи групи viiа
- •Деякі важливі фізичні характеристики елементів viiа групи наведені у таблиці 15.
- •Деякі властивості кисневмісних кислот галогенів
- •Лабораторна робота Дослід 1. Одержання хлору
- •8. Елементи VIII a групи
- •8.1. Фізичні характеристики елементів Фізичні властивості елементів
6. Елементи групи vіа
До складу VІА групи входять 8О, 16S, 34S, 52Te, 84Po. Будова зовнішніх
електронних рівнів – ns2 nр4. Для кисню – 8О |
|
; для решти елементів: |
||
2s 2p |
||||
|
|
, де n – (номер періоду) = 3, 4, 5, 6. |
||
ns np nd |
||||
6.1. Фізичні характеристики елементів Деякі важливі фізичні характеристики p-елементів viа групи наведені у таблиці 12.
Таблиця 12
Елемент, Е |
O |
S |
Se |
Te |
Po |
Радіус атома, нм |
0,073 |
0,102 |
0,116 |
0.136 |
0,146 |
Радіус іона, нм Е 2 - Е 4+ Е 6 +
|
0,140 - - |
0,184 0,037 0,029 |
0,198 0,050 0,035 |
0,221 0,097 - |
- - - |
Перший потенціал іонізації, еВ |
13,62 |
10,36 |
9,75 |
9,01 |
8,43 |
Спорідненість до електрону, еВ |
1,47 |
2,08 |
2,02 |
1,96 |
1,32 |
Електронегативність |
3,50 |
2,44 |
2,48 |
2,01 |
1,76 |
Ступені окислення Е у сполуках (виділені найбільш характерні) |
-1 -2 +2 |
-2 +2 +4 +6 |
-2 +2 +4 +6 |
-2 +2 +4 +6 |
-2 +2 +4
|
Деякі важливі відомості про p-елементиVіа групи наведені у таблиці 13.
6.2. Прості речовини
Кисень – найбільш розповсюджений елемент. У вільному стані кисень О2 знаходиться у повітрі (ω(О2) = 23%).Крім О2 у верхніх шарах атмосфери є озон О3. Максимальна концентрація О3 знаходиться на висоті ≈ 25км. Цей озоновий шар утворюється з О2 під дією ультрафіолетового опромінювання Сонця. Озоновий шар затримує жорстке сонячне випромінювання, дія якого шкідлива для всіх організмів.
У природі зустрічається у великій кількості самородна сірка. Вона існує в кількох алотропних формах. За кімнатної температури стабільна жовта ромбічна сірка.
Se, Te зустрічаються як домішки у сульфідних рудах.
У промисловості кисень одержують ректифікацією рідкого повітря, електролізом води.
В лабораторії:
2ВаО2
![]() 2ВаО + О2;
2ВаО + О2;
2Н2О2 2Н2О + О2;
2КМnО4 К2МnО4 + МnО2 + О2;
2КСІО3 2КСІ + 3О2.
О3 одержують в озонаторах із О2 дією тихого електричного розряду: 3О2 2О3.
Сірку у промисловості одержують із газів металургійних та коксових печей, із самородної сірки. Селен і телур – переробкою відходів електролітичної очистки кольорових металів.
Кисень має високу хімічну активність. Він безпосередньо взаємодіє з усіма простими речовинами, крім галогенів, благородних металів Ag, Au, Рt та благородних газів. О3 – дуже сильний окисник; в реакціях за його участю, як правило, утворюється О2:
2Аg + О3 → Аg2О + О2;
2КІ + О3 + Н2О → І2 + 2КОН + О2.
Кисень окислюється тільки фтором, а S, Se, Те, Ро, на відміну від кисню, можуть і окислюватись, і відновлюватись. Вони з легкістю окислюються киснем та галогенами. В ряду S – Ро здатність окислюватись збільшується, а відновлюватись – зменшується.
Якщо кип’ятити S, Se, Te у розчинах лугів, то вони диспропорціонують. З кислотами – неокисниками не реагують. При нагріванні реагують з кислотами – окисниками. Ро взаємодіє з кислотами як типовий метал.
S, Se, Te можуть розчинятись у розчинах своїх аніонів Е2‾, утворюючи поліаніони Е п2‾.
Табл. 13
Прод. табл. 13.
Реакції з простими речовинами:
О 2 + 2Н2 2Н2 О;
Е + Н2 Н2 Е (E = S, Se);
О2+N2 2NO;
Е + 2Г2 ЕГ4; (Е = S, Se, Te; Г – F, Cl, Br);
Е + О2 ЕО2 (Е = S, Se, Te, Ро);
5Е + 2Р Р2 Е5; (Е = О2, S, Se);
3Те + 2Р Те3 Р2;
2Е + С → СЕ2.
З металами елементи VIA групи утворюють оксиди, сульфіди, селеніди, телуриди. Більшість селенідів та телуридів є напівпровідниками.
Найбільш активні лужні метали (K, Rb, Cs) утворюють з киснем надпероксиди ЕО2, а натрій – пероксид, Nа2О2.
Реакції з найважливішими реагентами:
Ро + 2НСІ → РоСІ2 + Н2;
Е + 2Н2SO4(конц.) → ЕО2 + 2SО2 + 2Н2О (Е = S, Se, Te);
3Е + 6NaOH (надл.) 2Na2 E + Na2EO3 + 3H2O; (Е = S, Se, Te);
3S + 3Н2О 2Н2S + Н2SО3;
S + 6НNO3(конц.) → H2SO4 + 6NO2 + 2H2O;
E + 4HNO3 (конц.) → H2EO3 + 4NO2 + H2O; (Е = Se, Те)
Po + 8 HNO3 (конц.) → Po(NO3)4 + 4NO2 + 4H2O;
6.3. Бінарні сполуки
Сполуки з киснем та їх властивості наводяться в хімії кожного елемента.
Кисень утворює
чотири типи сполук: оксиди, що мають у
своєму складі О‾2; пероксиди:
–О–О–; надпероксиди – в їх структурі
є іон
![]() та
озоніди, які містять
та
озоніди, які містять
![]() .
Іони
та
можна вважати молекулами О2 та
О3, що приєднали по одному електрону.
Надпероксиди та озоніди утворюють
тільки найбільш активні лужні метали
К, Rb, Cs.
.
Іони
та
можна вважати молекулами О2 та
О3, що приєднали по одному електрону.
Надпероксиди та озоніди утворюють
тільки найбільш активні лужні метали
К, Rb, Cs.
За хімічними властивостями оксиди ділять на солетворні та несолетворні. Солетворні, в свою чергу, – на основні, наприклад CaO, BaO, MgO ( утворюють солі, взаємодіючи з кислотами); кислотні, наприклад СО2, SО3 (утворюють солі з основами) та амфотерні, наприклад Al2O3, ZnO. Амфотерні оксиди взаємодіють з утворенням солей і з кислотами, і з основами.
Несолетворні оксиди, наприклад СО, NО. Існують солеподібні оксиди (Fе3О4, Рb3О4).
Деякі оксиди d – елементів є нестехіометричними сполуками.
6.3.1. Сполуки з воднем. Сполуки з воднем Н2Е, крім Н2О та Н2Ро – отруйні гази. Температури плавлення, кипіння, густина води не підпорядковуються загальній закономірності зміни цих властивостей у ряду Н2 S – Н2Ро. Аномальні властивості води пояснюються малим розміром молекул води та утворенням водневих зв’язків між ними.
Відомі вищі водневі сполуки: для сірки – полісульфіди складу Н2Sn (n = 2 – 9, частіше 2), для кисню – пероксид водню Н2О2.
Н2 S, Н2Se, Н2Te одержують або прямим синтезом, або дією розбавлених кислот чи води на сполуки елементів з металами:
Е+Н2 Н2Е (Е = S, Se);
FeS+2HCl → H2S + FeCl2;
АІ2Е3+ 6Н2О → 2Аl(ОН)3 + 3Н2Е (Е= S, Se, Te).
Н2Sn одержують: Na2Sn+2HCl → H2Sn + 2NaCl
Водні розчини Н2Е (Е = S, Se, Te) – слабкі двохосновні кислоти. Н2S і Н2Se утворюють кислі та середні солі, Н2Те – тільки середні. Н2О – дуже слабкий амфотерний електроліт.
Н2Е, крім Н2О, – сильні відновники, з легкістю окислюються киснем повітря за звичайної температури до простих речовин, а при спалюванні – до диоксидів. Відновна активність у ряду Н2 S – Н2Se – Н2Te зростає.
2Н2Е + О2 → 2Е+ 2Н2О;
2Н2Е + 3О2 2ЕО2 + 2Н2О (Е = S, Se, Te).
При окисленні Н2S
у розчині іншими окисниками утворюється
або вільна сірка або іон![]() :
:
Н2S + І2 → S + 2НІ;
5Н2S + 2КМnО4 + 3Н2SО4→ 5S + 2МnSО4 + К2SО4 + 8Н2О;
Н2S + 4НСlО → Н2SО4 + 4НСl.
Н2О може окислюватись до О2 дією сильних окисників (F2, О3 та ін.) і відновлюватись до Н2 дією сильних відновників (активні метали тощо):
2Н2О + 2F2 → O2 + 4HF;
2H2O + 2Na → H2 + 2NaOH.
Молекули Н2О можуть утворювати кристалогідрати та бути лігандами в аквакомплексах, наприклад: CuSO4∙5H2O; [Cr(Н2О)6]Cl3.
6.3.2. Сполуки з металами Найбільше практичне значення мають сполуки кисню та сірки.
Для сірки відомі сульфіди та полісульфіди.
Розчинні сульфіди – сульфіди лужних, лужноземельних металів і амонію – одержують нейтралізацією основ сірководневою кислотою та відновленням сульфатів вугіллям:
2NaOH + H2S → Na2S + 2H2O;
BaSO4 + 4C BaS + 4CO.
Нерозчинні сульфіди одержують синтезом із простих речовин (сульфіди ртуті та срібла – за кімнатних умов) або за реакцією обміну:
Zn + S ZnS;
CuSO4 + H2S → CuS + H2SO4.
Полісульфіди активних металів та амонію утворюються при взаємодії сірки з відповідними сульфідами при сплавленні або у концентрованому розчині:
Na2S + (n-I)S Na2Sn
У водних розчинах сульфіди гідролізують, деякі, наприклад, AI2S3, Cr2S3, Fe2S3, – необоротно:
Na2S + H2O NaHS + NaOH;
Cr2S3 + 6H2O → 2Cr (OH)3 + 3H2S.
Більшість нерозчинних у воді сульфідів розчиняється у кислотах-неокисниках:
ZnS + 2HCl → ZnCl2 + H2S.
Сульфіди, добуток розчинності яких дуже малий, не розчиняються у кислотах – неокисниках, а розчиняються у концентрованій HNO3, "царській горілці" або у концентрованих розчинах сульфідів лужних металів чи амонію:
3CuS + 8HNO3 → 3CuSO4 + 8NO + 4H2O;
HgS + K2S → K2[HgS2].
Всі сульфіди – відновники. Продуктами окислення, в залежності від умов, є S, SО2, сульфати:
NiS + 2O2 → NiSO4;
SnS + 2O2 SnO2 + SO2;
CoS + H2O2 + 2CH3COOH → Co (CH3COO)2 + S + 2H2O.
Полісульфіди можуть окислюватись, відновлюватись, диспропор-ціонувати:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2;
Na2S2 + SnS → Na2SnS3;
Na2S2 → Na2S + S.
6.3.3. Сполуки з киснем. Ступеню окислення +4 відповідають діоксиди ЕО2, ступеню окислення +6 – триоксиди ЕО3. Оксид Ро (VІ) – РоО3 – нестійкий. Відомий нестійкий оксид сірки (ІІ) – SО: 2SО → SО2 + S.
SО2 у промисловості одержують випалюванням сірчистих руд або спалюванням сірки:
4FeS2 + IIO2 2Fe2O3 + 8SO2;
S + O2 SO2;
у лабораторії SО2 одержують дією сильних кислот на сульфіти:
Na2 SO3 + H2SO4 → Na2SO4 + SO2 + H2O;
SeO2 і ТеО2 одержують синтезом з простих речовин:
Е + О2 ЕО2;
оксид S(VІ) одержують каталітичним окисленням SО2:
2SО2 + О2
![]() 2SО3;
2SО3;
SеО3 – кип’ятінням К2SeО4 з SО3:
K2SeO4 + SO3 K2SO4 + SeO3,
ТеО3 – зневодненням Н6ТеО6:
Н6ТеО6 ТеО3 + 3Н2О.
За хімічним характером SО2, SeО2, ЕО3 – кислотні оксиди; ТеО2, РоО2 – амфотерні:
ЕO2 + H2О → H2EO3 (E= S, Se, Te);
EO2 + 2KOH → K2EO3 + H2О(E = S, Se, Te);
TeO2 + 2KOH + 2H2O → K2 [Te(OH)6];
PoO2 + 2H2SO4 → Po(SO4)2 + 2H2O.
ТеО2, РоО2 погано розчиняються у воді.
ЕО2, в залежності від умов, можуть окислюватись, відновлюватись, диспропорціонувати:
SО2 + СІ2 + 2Н2О → Н2SО4 + 2НСІ;
SО2 + 2Н2S → 3S + 2Н2О;
4SО2 + 8КОН К2S + 3К2SО4 + 4Н2О.
ЕО3 при нагріванні розкладаються:
2ЕО3 2ЕО2 + О2.
SеО3 та SО3 – сильні окисники:
SеО3 + 2КІ → К2SeО3+ І2;
5SО3 + 2Р → Р2О5 + 5SО2.
6.3.4. Сполуки з галогенами. Для сірки і селену найбільш характерні галогеніди типу Е2Г2, для телура – ТеГ2.
Відомо багато сполук сірки з галогенами. Найбільше значне має SF6 – це інертний за звичайних умов газ. Інші галогеніди сірки під дією води гідролізують і диспропорціонують:
SCl4 + 3H2О → H2SO3 + 4HCl;
2SCl2 + 3H2О → H2SO3 + S+ 4HCl.
Відомі оксогалогеніди сірки – хлористий тіоніл SОСl2 та хлористий сульфурил SО2Сl2. Їх одержують:
SO2 + PCl5 → SOCl2 + POCl3;
SO3 + SCl2 → SOCl2 + SO2 ;
SO2 + Cl2 → SO2Cl2.
SOCl2 та SO2Cl2 – отруйні рідини, у воді повністю гідролізують:
SОСl2 + 2Н2О → Н2SО3 + 2НСl:
SО2Сl2 + 2Н2O → Н2SО4 + 2НСl.
Це свідчить про те, що SОСl2 та SО2 Сl2 є хлорангідридами сірчистої та сірчаної кислот.
Галогеніди селену за хімічними властивостями подібні до галогенідів сірки.
Галогеніди телуру більш подібні до солей, ніж до галогенангідридів.
Галогеніди полонію – солі.
6.4. Гідроксиди та їх похідні. Оксидам ЕО2 і ЕО3 відповідають гідроксиди складу Н2ЕО3 і Н2ЕО4, а ТеО3 – Н6ТеО6.
Н2 SО3 одержують розчиненням SО2 у воді:
SО2+ Н2О → Н2 SО3;
Н2 SеО3 і Н2ТеО3 – окисленням Se і Те концентрованою HNO3:
Se + 4HNO3 → H2SeO3 + 4NO2 + H2O.
або розчиненням SeО3 та TeО3 у воді.
Н2SО4 одержують у промисловості окисленням SО2 до SО3 та подальшим розчиненням SО3. Схема одержання:
FеS2
(або S)
SО2 –
![]() SО3
SО3
![]() Н2SО4:
Н2SО4:
1) контактний спосіб: каталізатор – Pt або оксиди ванадію. Одержують кислоту будь-якої концентрації з незначним вмістом домішок. SО3 поглинають концентрованою Н2SО4, утворюється олеум. Сірчану кислоту з ω(Н2SО4) = 98% одержують, змішуючи олеум з розбавленою Н2SО4;
2) нітрозний спосіб: каталізатор – оксиди азоту. Кінцевий продукт містить 78% Н2SО4:
2NO + O2 → 2NO2;
SO2 + NO2+ H2O → NO + Н2SО4;
Н2SeО4 і Н6TeО6 – окисленням простих речовин або сполук Е(ІV) сильними окисниками:
H2SeO3 + H2O2 → H2SeO4+ H2O;
Te + HClО3 + 3H2O → H6TeO6 + HCl.
Водні розчини Н2ЕО3 (крім Н2ТеО3), Н2ЕО4 і Н6ТеО6 – кислоти. Телуриста кислота Н2ТеО3 має амфотерні властивості. Н2SО4 і Н2SeО4 у розбавлених розчинах є сильними кислотами. Н2SО4к, Н2SeО4, Н6TeО6 – сильні окисники:
H2SO4P + Zn → ZnSO4 + H2;
2H2SO4K + Cu → CuSO4 + SO2 + 2H2O;
H2SeO4 + 2HCl → H2SeO3 + Cl2 + H2O.
Суміш Н2SеО4 і НСl розчиняє Аu і Рt.
Н2SО3 проявляє відновні властивості, але може бути відновлена дією сильних відновників:
Н2SО3 + І2 + Н2О → Н2 SО4 + 2HІ;
Н2SО3 + 2Н2S → 3S + 3Н2О.
Для Н2SеО3 і Н2ТеО3 окисні властивості більш характерні, ніж для Н2SО3:
Н2SеО3 + 2Н2SО3 → 2Н2SО4+ Se + Н2О.
Серед похідних гідроксидів найбільше значення мають сульфіти та сульфати. Сульфіти утворюються при взаємодії SО2 з розчинами лугів або карбонатів в результаті реакцій обміну:
SО2 + 2NaOH → Na2SO3 + H2O;
SO2+ Na2CO3 → Na2SO3 + CO2;
Na2SO3+ CuSO4 → CuSO3 + Na2SO4,
Сульфати утворюються як результат окислення металів Н2SО4, а також окисленням сульфідів, нейтралізацією основ сірчаною кислотою, в результаті реакцій обміну:
2Ag + 2H2SO4k → Ag2SO4 + SO2 + 2H2O;
PbS + 4H2O2 = PbSO4 + 4H2O;
H2SO4 + KOH → KHSO4 + H2O;
Sr(NO3)2 + K2SO4 → SrSO4 + 2KNO3.
Розчинні у воді сульфіти та сульфати слабких основ гідролізують:
Na2SO3 + H2O NaHSO3 + NaOH;
2ZnSO4 + 2H2O (ZnOH)2 SO4 + H2SO4.
Сульфіти розкладаються під дією сильних кислот:
К2SО3 + Н2SО4 → К2SО4 + SО2 + Н2О.
Водні розчини сульфітів мають відновні властивості, але сильні відновники їх відновлюють:
2Na2SO3 + O2 → 2Na2SO4;
Na2SO3 + 2Na2S + 3H2O → 3S + 6NaOH.
При нагріванні сульфіти диспропорціонують:
4Na2SO3 Na2S + 3Na2SO4.
При термічному розкладі гідросульфітів утворюються піросульфіти:
2NaHSO3 Na2S2O5 + H2O.
При нагріванні розчину Na2SO3 з сіркою утворюється тіосульфат натрію:
Na2SO3 + S Na2S2O3.
Na2S2O3 з легкістю розкладається кислотами, є сильним відновником; по різному взаємодіє з сильними та слабкими окисниками:
Na2S2O3 + H2SO4 → Na2SO4 + SO2 + S + H2O;
Na2S2O3 + 4Cl2 + 5H2O → 2H2SO4 + 6HCl + 2NaCl;
2Na2S2O3 + I2 → 2NaI + Na2S4O6;
Na2S2O3 є сіллю тіосірчаної кислоти Н2S2О3. Це сильна, але нестійка кислота, що має структуру:

Іони S2О32‾ можуть бути лігандами у комплексних сполуках, наприклад Nа[Fe(S2O3)2], K3[Ag(S2O3)2].
Na2S4O6 – сіль тетратіонової кислоти, однієї з політіонових кислот загальної формули Н2SnО6.(n > 2) і будови:
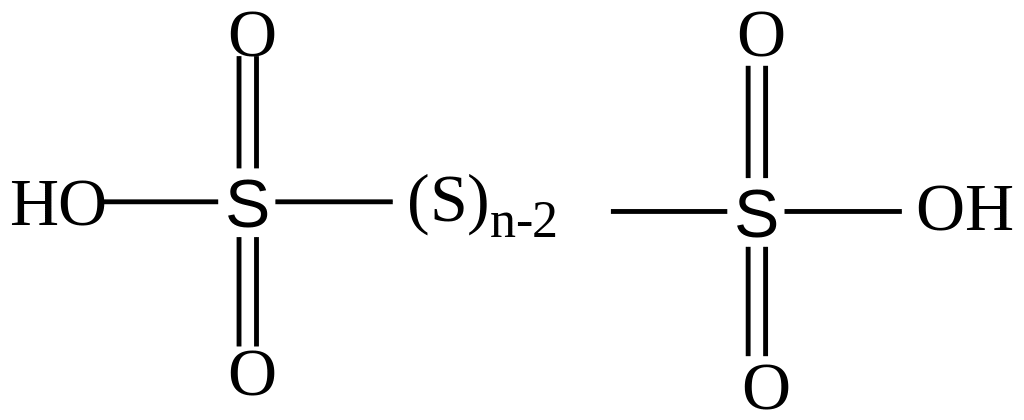
Крім Н2SO3, H2SO4, H2SnO6 сірка утворює полісірчані: H2SO4nSO3 та пероксокислоти: H2SO5 – пероксомоносірчана кислота (мононадсірчана або кислота Каро), Н2S2О8 – пероксодисірчана кислота (двонадсірчана).
Суміш Н2SО4 та полісірчаних кислот Н2S2О7, H2S3O10, H2S4O13 називають олеум – це густа масляна рідина.
Полісірчані та пероксокислоти взаємодіють за звичайних умов з водою, утворюючи сірчану кислоту:
H2S2О7 + Н2О → 2Н2SО4;
піросірчана кислота
Н2SО5 + Н2О → Н2SО4 + Н2О2;
пероксомоносірчана кислота
Н2S2О8 + 2Н2О → 2Н2SО4 + Н2О2.
перексодисірчана кислота
