
- •Загальні основи аналітичної хімії
- •Кисень;
- •Магнію;
- •Який з наведених іонів – аніон:
- •Хлорид натрію;
- •Хлоридна;
- •До розділу I: “Загальні основи аналітичної хімії”
- •Ця речовина має сильні інсектицидні властивості і має назву:
- •Гліцерин;
- •Трьохатомний спирт гліцерин застосовується в шкіряній, лікерній, парфумерній промисловостях. Укажіть його формулу:
- •Глюкоза;
- •Глюкоза;
- •Гліцерин.
- •Глюкоза;
- •NaHco3;
- •Глюкоза;
- •До розділу II: “Органічна хімія”
- •Температура;
- •Хлорид натрію;
- •Нітрат натрію;
- •Сірчана кислота;
- •Нітрат срібла;
- •Азотна кислота;
- •До розділу III: “Фізична та колоїдна хімія і фізико хімічні методи дослідження”
особливості будови кристалічної решітки;
тип хімічного зв’язку;
дефекти кристалічної решітки;
взаємодія між молекулами;
взаємодія між атомами.
Вкажіть призначення поляризатора в поляриметрі:
одержання поляризованого світла;
визначення забарвлених розчинів;
вилучення вузької області спектру;
підвищення чіткості визначення;
визначення речовин в непрозорих розчинах.
Розчин сахарози С12Н22О11 обертає площину поляризації вправо на 9,5 град.(L=2 дм). Скільки сахарози (г) міститься в 100 мл розчину, якщо питоме обертання дорівнює + 66,5 град.?
7,1;
3,5;
7,5;
6,5;
3,1.
Розрахувати кут обертання площини поляризації розчину, що містить 5г фруктози С6Н12О6 в 100 мл, L = 10 см, питоме обертання дорівнює – 92,0 град.
+4,6;
–4,6;
–4,4;
+5,4;
+6,4.
Закінчити визначення: розчинами називають...
тверді, рідкі та газоподібні гомогенні (однорідні) системи, які складаються з двох чи більше компонентів;
тверді, рідкі та газоподібні гетерогенні (неоднорідні) системи, які складаються з двох чи більше компонентів;
тверді, рідкі та газоподібні гетерогенні (неоднорідні) системи, які складаються лише з двох компонентів;
тверді, рідкі та газоподібні гетерогенні (неоднорідні) системи, які складаються з одного компоненту;
тверді, рідкі та газоподібні гомогенні та гетерогенні системи, які складаються з двох чи більше компонентів.
Які фактори впливають на властивості розчинів:
природа розчинника та розчиненої речовини, концентрація, температура;
природа розчинника, температура, тиск;
температура, тиск, концентрація;
густина, температура, концентрація, тиск;
об’єм, концентрація, температура.
Закон Рауля для розбавлених розчинів має математичний вираз:
 ;
; ;
; ;
; ;
; .
.
Із закону Рауля існують наслідки. Скільки їх?
2;
3;
1;
5;
не існує.
В розбавлених розчинах стала кипіння називається:
ебуліоскопічна;
кріоскопічна;
евтектична;
осмотична;
газова.
В розбавлених розчинах стала замерзання називається:
кріоскопічна;
ебуліоскопічна;
газова;
осмотична;
евтектична.
Явище односторонньої дифузії розчинника до концентрованого розчину крізь напівпроникну мембрану називається...
осмос;
стискання;
розчинення;
перетворення;
випаровування.
В вигляді якої сполуки визначають сульфати фотонефелометричним методом:
сульфат барію;
сульфат кальцію;
сульфат срібла;
сульфат магнію;
сульфат свинцю.
Осмотичний тиск має математичний вираз:
 ;
; ;
; ;
; ;
; .
.
Осмотичний тиск людини та тварин дорівнює:
8 атмосфер;
16 атмосфер;
10 атмосфер;
2 атмосфери;
не існує.
Математичний вираз основного закону колориметрії Бугера-Ламберта-Бера має вигляд:
 ;
; ;
; ;
; ;
; .
.
За допомогою якого приладу вимірюють оптичну густину речовини:
фотоелектроколориметр;
рефрактометр;
поляриметр;
потенціометр;
в’язкозиметр.
Фізико-хімічні системи, в яких окремі ділянки однакові за своїми властивостями та складом, називають:
гомогенні;
гетерогенні;
тетрагенні;
пентагенні;
не існує.
Фізико-хімічні системи, в яких окремі ділянки (дві чи більше) різняться за своїми властивостями та складом, називають:
гетерогенні;
пентагенні;
тетрагенні;
гомогенні;
не існує.
Хімічно активна складова частинка системи, яка при виділенні з системи існує в ізольованому вигляді як завгодно довго називається:
компонент;
фаза;
ступінь вільності;
складова;
кількість фаз.
Умови, які можливо в системі вільно змінювати без порушення стану рівноваги називають:
ступінь вільності;
фаза;
компонент;
кількість фаз;
складова.
Сутність гомогенних частин системи, які володіють однаковими властивостями, які залежать від температури, тиску, концентрації та природи речовини, називається:
фаза;
компонент;
ступінь вільності;
складова;
кількість фаз.
Рівняння правила фаз має математичний вираз:
 ;
; ;
; ;
; ;
; .
.
Процес розподілу розчинених речовин між двома рідкими фазами, які не змішуються, та є основою для виділення та розділення речовин називається:
екстракція;
розчинення;
проникнення;
дифузія;
кристалізація.
Закон розподілу має математичний вираз:
 ;
; ;
; ;
; ;
; .
.
Які фактори впливають на густину та швидкість екстракції:
температура, природа розчинника, час, поверхня контакту, частота суміші розчинника;
температура, каталізатор, тиск, густина;
концентрація, об’єм, тиск;
молекулярна маса, маса речовини, густина, об’єм;
природа розчинника, каталізатор, швидкість.
Різниця потенціалів між металами та розчином називається:
електродний потенціал;
водневий електрод;
окисно-відновний потенціал;
порівняльний електрод;
не існує.
Від яких факторів залежить величина потенціалу:
природа електроду, концентрація, температура, середовище;
тиск, об’єм, густина;
природа розчинника, об’єм;
зовнішні фактори, світло, температура;
фактори не впливають, бо потенціал стала величина.
Електродний потенціал за рівнянням Нернста має математичний вираз:
 ;
; ;
; ;
; ;
; .
.
Окисно-відновний потенціал за рівнянням Нернста має математичний вираз:
;
;
;
;
.
Метод, який лежить в основі залежності величин потенціалів електроду від концентрації компонентів називається:
потенціометрія;
поляриметрія;
нефелометрія;
рефрактометрія;
турбідиметрія.
Електроди, які реагують на зміни концентрації досліджуваного іону в розчині та являють собою індикатор при титруванні називаються:
індикаторні;
допоміжні;
водневі;
хінгідронні;
порівняльні.
Електроди, потенціал яких не залежить від концентрації досліджуваних іонів в розчині та використовується лише для визначення потенціалу індикаторного електроду називається:
порівняльний;
хінгідронний;
водневий;
індикаторний;
скляний.
Для визначення концентрації іонів водню використовують прилад:
потенціометр;
рефрактометр;
поляриметр;
фотоелектроколориметр;
нефелометр.
Для прямої потенціометрії будують графік в координатах:
величина потенціалу – концентрація стандартних розчинів;
оптична густина – концентрація стандартних розчинів;
інтенсивність розсіяного світла - концентрація стандартних розчинів;
показник заломлення - концентрація стандартних розчинів;
висота – концентрація.
Для непрямої потенціометрії будують графік в координатах :
величина потенціалу – об’єм робочого титрованого розчину;
оптична густина – концентрація стандартних розчинів;
показник заломлення - концентрація стандартних розчинів;
величина потенціалу – концентрація стандартних розчинів;
величина потенціалу – кількість вимірювань.
Системи, в яких одна речовина розподіляється в середовищі інших речовин у вигляді дуже мілких часточок називаються:
дисперсні;
гомогенні;
гетерогенні;
пентагенні;
тетрагенні.
Від чого залежить інтенсивність розсіяного світла:
від кількості та розміру частинок, довжини хвилі падаючого світла;
від концентрації розчину, об’єму;
довжини хвилі, концентрації, об’єму;
концентрації, кількості частинок;
від густини, температури, об’єму.
Як змінюється інтенсивність розсіяного світла з зменшенням довжини хвилі падаючого світла:
зростає;
не змінюється;
зменшується;
для різних речовин залежність різна;
залежності не має.
При підвищенні температури в’язкість розчинів:
зменшується;
збільшується;
залишається без змін;
для різних речовин залежність різна;
залежності не має.
Закінчити визначення: фототурбидиметрія – це оптичний метод аналізу, застосований на вимірюванні:
інтенсивність світла, яке пройшло через суспензію;
інтенсивності заломленою суспензією світла;
інтенсивність світла, розсіюваного суспензією;
інтенсивність поглинутого світла;
інтенсивність ослабленого світла, що відбивається суспензією.
Скільки хлорид-іонів (мг) міститься в 2 мл стандартного розчину 0,005М розчину хлориду калію:
0,1775;
0,355;
0,088;
0,0177;
0,089.
В яких координатах будують калібрувальний графік в методі фотонефелометрія:
інтенсивність розсіяного світла – концентрація розчинів;
“ оптична щільність” – концентрація розчинів;
інтенсивність заломленого суспензією світла – концентрація розчинів;
інтенсивність поглинутого світла – концентрація розчину;
інтенсивність світла, яке пройшло через суспензію – концентрація розчину.
При фотонефелометричному визначенні сульфатів у воді використовують стандартний розчин 0,001М сірчаної кислоти. Скільки SO32- (мг) містить 1 мл цього розчину:
0,08;
0,88;
0,04;
0,084;
0,48.
Вкажіть речовини, які можна визначити фотонефелометричним методом:
Хлорид натрію;
оцтова кислота;
Нітрат натрію;
лимонна кислота;
щавлева кислота.
Вкажіть об’єкти фототурбідиметричного методу аналізу:
суспензії, емульсії;
забарвлені розчини;
істинні розчини;
розчин сахарози;
розведені розчини.
Розрахувати молярний коефіцієнт світлопоглинання забарвленого розчину, якщо при проходженні через шар 5 см цього розчину початкова інтенсивність світлового потоку (І0) зменшилась у 5 разів (Іt). Вкажіть вірну відповідь:
0,14;
1,4;
0,7;
7,0;
7,4.
Вкажіть діапазон довжин хвиль (нм) в якому можна застосувати метод фотоелектроколориметрії:
400-1000;
200-400;
100-760;
200-760;
100-560.
Для визначення інтенсивності розсіяного світла використовують рівняння Релея:
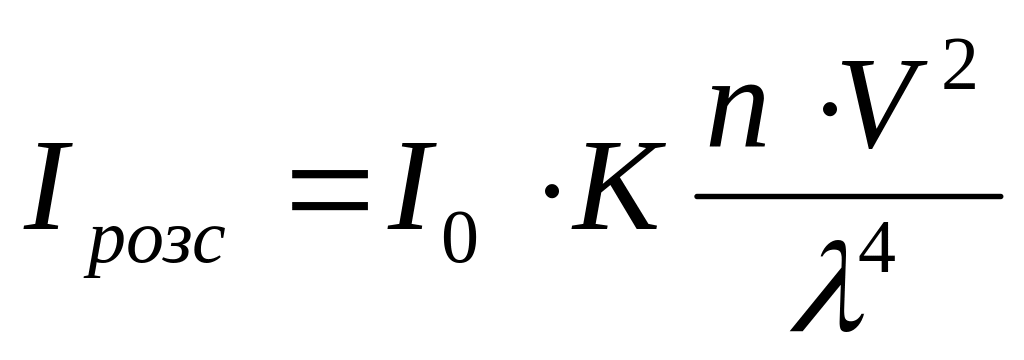 ;
; ;
; ;
; ;
; .
.
Обрахувати оптичну густину поглинаючого шару кювети (см) для знаходження оптичної густини розчину NiSO4 , що містить 2 мг солі в 50 мл розчину: “епсілон” дорівнює 400, Д= 0,43.
4;
5;
3,5;
0,5;
2.
Світлопоглинання досліджуваного розчину дорівнює 55%. Знайти оптичну густину цього розчину.
0,26;
0,36;
0,16;
0,23;
0,62.
При визначенні заліза моносульфосаліцилату оптична густина розчину, що містить 0,5 мг заліза в 100 мл, дорівнює 0,42 (в=2см). Знайти молярний коефіцієнт поглинання розчину моносульфосаліцилату заліза.
2,37 ·10000;
2,36·100;
2,36·1000;
2,36·100000;
3,63·1000.
Явище світлорозсіювання в колоїдних системах та пов’язана з ним зміна забарвлення колоїду називається:
опалесценція;
флотація;
флуоресценція;
фотосинтез;
фотоліз.
Внутрішньомолекулярне явище, яке пов’язане з вибірковим поглинанням світла речовини, яка флуоресціює називається:
флуоресценція;
фотосинтез;
фотоліз;
опалесценція;
флотація.
Метод аналіз, в основі якого лежить зміна інтенсивності світла, який виникає в результаті розсіювання падаючого на частинки світла називається:
нефелометричним;
потенціометричним;
рефрактометричним;
турбідиметричним;
поляриметричним.
Метод аналізу, в основі якого лежить зміна послабленого світла, який пройшов крізь дисперсну систему називається:
турбідиметричним;
поляриметричним;
нефелометричним;
потенціометричним;
рефрактометричним.
Для визначення інтенсивності розсіяного світла використовують прилади:
нефелометр;
поляриметр;
рефрактометр;
потенціометр;
в’язкозиметр.
Вкажіть призначення захисного колоїду:
стабілізація суспензії;
прискорення утворення твердої фази;
зниження розчинності осаду;
збільшення розчинності осаду;
видалення впливу домішок.
Вкажіть реактив для фотонефелометричного визначення солей барію:
Сірчана кислота;
соляна кислота;
щавлева кислота;
оцтова кислота;
метафосфорна кислота.
Яка речовина підвищує стійкість суспензії?
желатин;
Нітрат срібла;
Азотна кислота;
соляна кислота;
гідроксид амонію.
Зміна концентрації речовини в поверхневому шарі у порівнянні з концентрацією речовини в середині фази, називається:
адсорбція;
десорбція;
хемосорбція;
адсорбент;
адсорбтив.
Речовина, яка поглинає своєю поверхнею молекули інших речовин, називається:
адсорбент;
адсорбтив;
поглинач;
вбирач;
не існує.
Речовина, яка поглинається в поверхню молекул інших речовин, називається:
адсорбтив;
поглинач;
вбирач;
адсорбент;
не існує.
Процес поглинання, який супроводжується хімічною реакцією, називається:
хемосорбція;
десорбція;
адсорбція;
сорбція;
не існує.
На межі розділу фаз рідина – газ існує залежність, яка виражена рівнянням Гіббса:
 ;
; ;
; ;
; ;
; .
.
Поверхневий натяг залежить від концентрації насичених жирних кислот у водних розчинах, що підтверджує рівняння Шишковського:
 ;
; ;
; ;
; ;
; .
.
Тверді поверхні, які гарно змочуються водою, називаються:
гідрофільними;
гідрофобними;
біофобними;
ліофобними;
ліофільними.
Тверді поверхні, на яких вода не розтікається, називаються:
гідрофобними;
ліофобними;
біофобними;
міофобними;
гідрофільними.
Рух частинок дисперсної фази до протилежно зарядженого електроду, називається:
електрофорез;
електроліз;
електроосмос;
електрошок;
електролазер.
Перенесення рідини відносно твердої стінки під впливом внутрішньої різниці потенціалів, називають:
електроосмос;
електролазер;
електрошок;
електрофорез;
електроліз.
У хроматографічному методі аналізу будують графік в таких координатах:
висота піку – концентрація розчину;
концентрація розчину – об’єм розчину;
показник заломлення – концентрація розчину;
густина розчину – маса речовини (%);
висота піку – густина розчину.
На чому Цвет зробив своє дослідження для хроматографічного методу аналізу:
пігмент зеленого листка;
часточки кори;
забарвлення пелюстків;
кількість води;
кількість органічних і неорганічних сполук.
Поріг коагуляції колоїдів має математичний вираз:
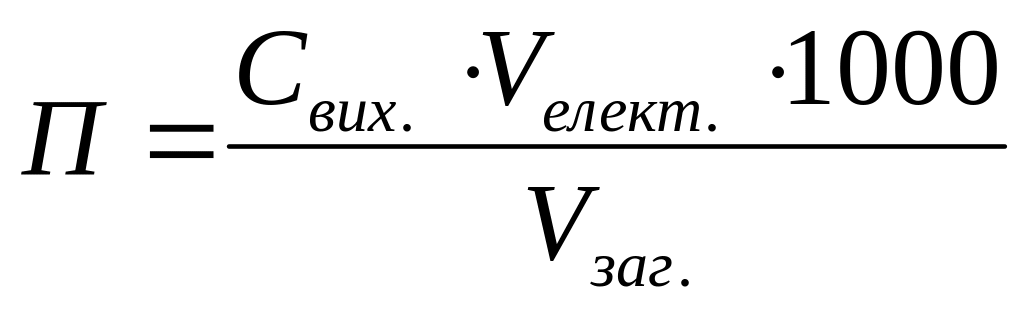 ;
; ;
; ;
; ;
; .
.
В яких одиницях вимірюється поріг коагуляції колоїдів:
моль/л;
кг/м3;
м3;
м3/г;
м2/кг.
Математичний вираз формули Ньютона для розчинів ВМС на сили в’язкості:
 ;
; ;
; ;
; ;
; .
.
Значення рН, яке співпадає електронейтральному ізоелектричному стану білка називається:
ІЕТ;
ПДВ;
ВМС;
МГС;
ЕРС.
Для чого в фотоколориметрах застосовується світофільтр?
для виділення чистоти спектру з найбільшим світлопоглинанням;
для підвищення чутливості аналізу;
для поглинання світлового потоку;
для підвищення чіткості аналізу;
для ослаблення світлового потоку.
Від чого залежить величина молярного коефіцієнту світлопоглинання?
від природи досліджуваної речовини;
від концентрації розчину;
від товщини поглинального шару розчину;
від характеру забарвлення розчину;
від довжини хвилі світла.
За допомогою якого методу здійснюють визначення концентрації оптично активних речовин?
поляриметрія;
рефрактометрія;
нефелометрія;
турбідиметрія;
колориметрія.
Таблиця розподілу правильних відповідей
