
- •Структура атомов
- •7.3.Строение молекул
- •7.4.Континуальная концепция. Понятие физического поля
- •7.5.Поле движущихся зарядов
- •Глава 8. Структурные уровни организации материи
- •Масштабы расстояний во Вселенной и соответствующие теории
- •Физический вакуум
- •Фундаментальные частицы и фундаментальные взаимодействия
- •Глава 9. Примеры физических, химических и биологических процессов
- •Флуктуации
- •Процессы естественной радиоактивности
- •Химические процессы. Энергетика и скорость химических реакций
- •Процессы фотосинтеза и дыхания
Гл а в а 7
Корпускулярная и континуальная концепции описания природы 7.1.Концепция атомизма
Представления о веществе как о предмете изучения естественных наук (в первую очередь химии и физики) менялись в соответствии с уровнем развития знаний и практического использования веществ. Концепция атомизма (поиск «элементарных кирпичиков» мироздания) оказалась плодотворной в объяснении химических и физических свойств тел.
Представления о химических элементах как пределе разложения веществ решали одну из задач химии — выяснение состава веществ. Д. И. Менделеев построил Периодическую систему (1869), связывающую химические свойства элементов (известных тогда 62 элементов) с их атомной массой. Все химические элементы распределены на 8 вертикальных столбцов — групп, которые состоят еще из двух подгрупп. Строки — это периоды. Внутри строки — последовательный переход от активных металлов к неактивным, затем к неметаллам и, наконец, к инертным газам. Установленная структура позволила предсказать ему химические свойства элементов, которые еще не были открыты, но для них были пустые места в Периодической системе. Впоследствии эти химические элементы были открыты.
Если до начала XX в. атом представлялся неделимым, то открытие электрона, рентгеновского излучения, радиоактивности, искусственных ядерных реакций позволило выявить сложную структуру атома. Теоретическое обоснование периодического закона, смысл понятий химического элемента, валентности, химической связи и т.д. были даны в 1930-е гг. на основе квантовых представлений. Химический элемент — это атом с определенным зарядом ядра, которому соответствует номер элемента в таблице Д. И. Менделеева, а каждому элементу — определенный род атомов, обозначаемый специальным химическим символом.
Атом — часть вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Размеры атома определяются размерами его электронной оболочки, хотя они не имеют четных границ. Линейные размеры атома — порядка 10 - 10 м, а атомного ядра — порядка (10 -14— 10 -15) м. Атом состоит из тяжелого плотного атомного ядра, обладающего положительным зарядом, окруженного электронными оболочками. Все атомные ядра состоят из нуклонов: протонов и нейтронов. Нейтрон не имеет электрического заряда, а у протона заряд — (+е), т.е. он равен по абсолютной величине заряду электрона е = 1,6·10-19 Кл. Атом в целом нейтрален, поэтому ядро удерживает Z электронов в электронных оболочках, равных числу протонов. Заряд ядра — основная характеристика атома — величина Ze, где Z — число протонов в ядре. Число нуклонов в ядре А = N + Z называют атомным числом, здесь N — число нейтронов в ядре.
Атомные
ядра химических элементов обозначают
 ,
где
X
—
символ химического элемента. Элементы
с одинаковым зарядом ядра (порядковым
номером) Z,
но с разным количеством нейтронов в
ядре N
называют изотопами.
Различие
массы ядер практически не сказывается
на физических и химических свойствах
изотопов. Наибольшие отличия из-за
большой разницы в массах у изотопов
водорода: легкого водорода (протия, А
=1),
дейтерия (А
=
2) и трития (А
=
3). В таблице Д. И. Менделеева указаны
значения атомных масс элементов, взятые
им за основную характеристику элемента
при открытии закона. Атомная
масса —
дробная величина (в отличие от
массового числа А),
поскольку
за атомную массу принимают среднее
значение масс изотопов с учетом их
процентного содержания.
,
где
X
—
символ химического элемента. Элементы
с одинаковым зарядом ядра (порядковым
номером) Z,
но с разным количеством нейтронов в
ядре N
называют изотопами.
Различие
массы ядер практически не сказывается
на физических и химических свойствах
изотопов. Наибольшие отличия из-за
большой разницы в массах у изотопов
водорода: легкого водорода (протия, А
=1),
дейтерия (А
=
2) и трития (А
=
3). В таблице Д. И. Менделеева указаны
значения атомных масс элементов, взятые
им за основную характеристику элемента
при открытии закона. Атомная
масса —
дробная величина (в отличие от
массового числа А),
поскольку
за атомную массу принимают среднее
значение масс изотопов с учетом их
процентного содержания.
В течение некоторого времени считалось, что протоны, нейтроны и электроны являются теми элементарными «кирпичиками», из которых состоит вещество. Однако в 1960-е годы появились убедительные доказательства того, что протоны и нейтроны сами состоят из частиц, названных кварками.
Атом является квантовой системой. Его основная характеристика — полная внутренняя энергия — может принимать только дискретный ряд значений. Каждому из разрешенных значений энергии соответствует одно или несколько стационарных квантовых состояний атома. Энергия атома может меняться только скачкообразно — путем квантового перехода из одного стационарного состояния в другое. Графически возможные значения энергии изображают в виде схемы уровней энергии, самый нижний называют основным, а остальные — возбужденными, так как для перехода на них атому нужно сообщить энергию.
Масса атома растет с увеличением числа Z. Она обусловлена в основном массой ядра, так как тр = 1 840тe, тр ≈ тп, где те — масса электрона, тр — масса протона, тп — масса нейтрона. Методами масс-спектроскопии было установлено, что масса ядра всегда тя < тр + тп + те. Значит, при объединении нуклонов в ядро выделяется энергия, которая в соответствии с формулой Эйнштейна равна: Е =Δтc2, где Δт — дефект массы ядра, Е — энергия связи атома. Чтобы разделить ядро на нуклоны, надо приложить такую же энергию, которую называют энергией связи нуклонов.
Энергия связи нуклонов в ядре: Есв = Δтс2 = c2{[Zmp + (А – Z)·mn - mя}. Удельная энергия связи — это энергия связи, приходящаяся на один нуклон, т.е. Eсв / A. Она зависит от атомного числа: в начале таблицы растет, достигая максимума для А = 50 — 60, затем падает. Из этого следует, что при ядерных превращениях часть массы ядер исходных элементов будет превращаться в энергию.
Атомы могут быть в свободном (в газе) и связанном (в жидких и твердых телах) состояниях. Все физические и химические свойства атомов определяются особенностями его строения, а структура и физико-химические свойства макроскопических тел определяются атомами, из которых они состоят, способами их соединения в молекулы, типом и строением химической связи.
Структура атомов
Квантовая механика, согласно двойственной природе электрона, представляет электрон в атоме в виде электронного облака более плотного в тех точках пространства, где наиболее вероятно обнаружить электрон. Состояние электрона в атоме однозначно описывается набором квантовых чисел: п, ℓ, тℓ , ms .
Главное квантовое число п = 1, 2, 3, ... . Оно определяет размеры электронной оболочки и энергетические уровни электронов. Большее значение п соответствует большим размерам электронной оболочки и более высокой энергии электронов в атоме. Состояние электрона, характеризующееся значением п, принято называть энергетическим уровнем электрона в атоме: при п = 1 электрон — на первом энергетическом уровне, при п = 2 — на втором и т.д.
Орбитальным квантовым числом ℓ определяются: форма электронных облаков (или орбиталей), энергетические подуровни электрона и его орбитальный момент импульса. Орбиталь — это часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая (90 %). Квантовое число ℓ называют также побочным, или азимутальным числом, ℓ =0, 1,... (n - 1), где п — главное квантовое число. Данному значению п соответствуют п возможных значений орбитального квантового числа ℓ. Энергетическим подуровням присвоены буквенные обозначения:
Орбитальное квантовое число ℓ 0 1 2 3…
Обозначение энергетического подуровня s р d f…
Магнитное квантовое число тℓ определяет взаимодействие магнитного поля, создаваемого электроном, с внешним магнитным полем. Магнитное квантовое число может принимать любые целочисленные значения в пределах от + ℓ до - ℓ , т.е. значению ℓ соответствует (2·ℓ + 1) возможных значений тℓ или (2·ℓ + 1) возможных расположений электронного облака (или орбиталей) в пространстве.
Кроме орбитального момента импульса, определяемого значением ℓ, электрон обладает и собственным моментом импульса, что можно упрощенно рассматривать как результат вращения электрона вокруг своей оси. Квантовую величину, отражающую вращение электрона вокруг своей оси, называют спиновым квантовым числом или просто спином. Спин обозначается буквой s и его проекция на выбранное направление ms может принимать два значения: +1/2 или -1/2.
Заполнение электронами энергетических состояний в атоме происходит в соответствии с принципом Паули, согласно которому в любом атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Распределение электронов в атомах по уровням удовлетворяет принципу минимума потенциальной энергии электромагнитного взаимодействия: с возрастанием числа электронов каждый следующий электрон должен занять возможное энергетическое состояние с наименьшей энергией. Энергия подуровней определяется суммой квантовых чисел п + ℓ. При равных значениях этой суммы заполняется подуровень с наименьшим числом п, в остальных случаях с наименьшей величиной этой суммы (правило Клечковского).
Порядок заполнения электронами орбиталей одного подуровня определяется правилом Хунда, согласно которому абсолютное значение суммарного спина должно быть максимальным.
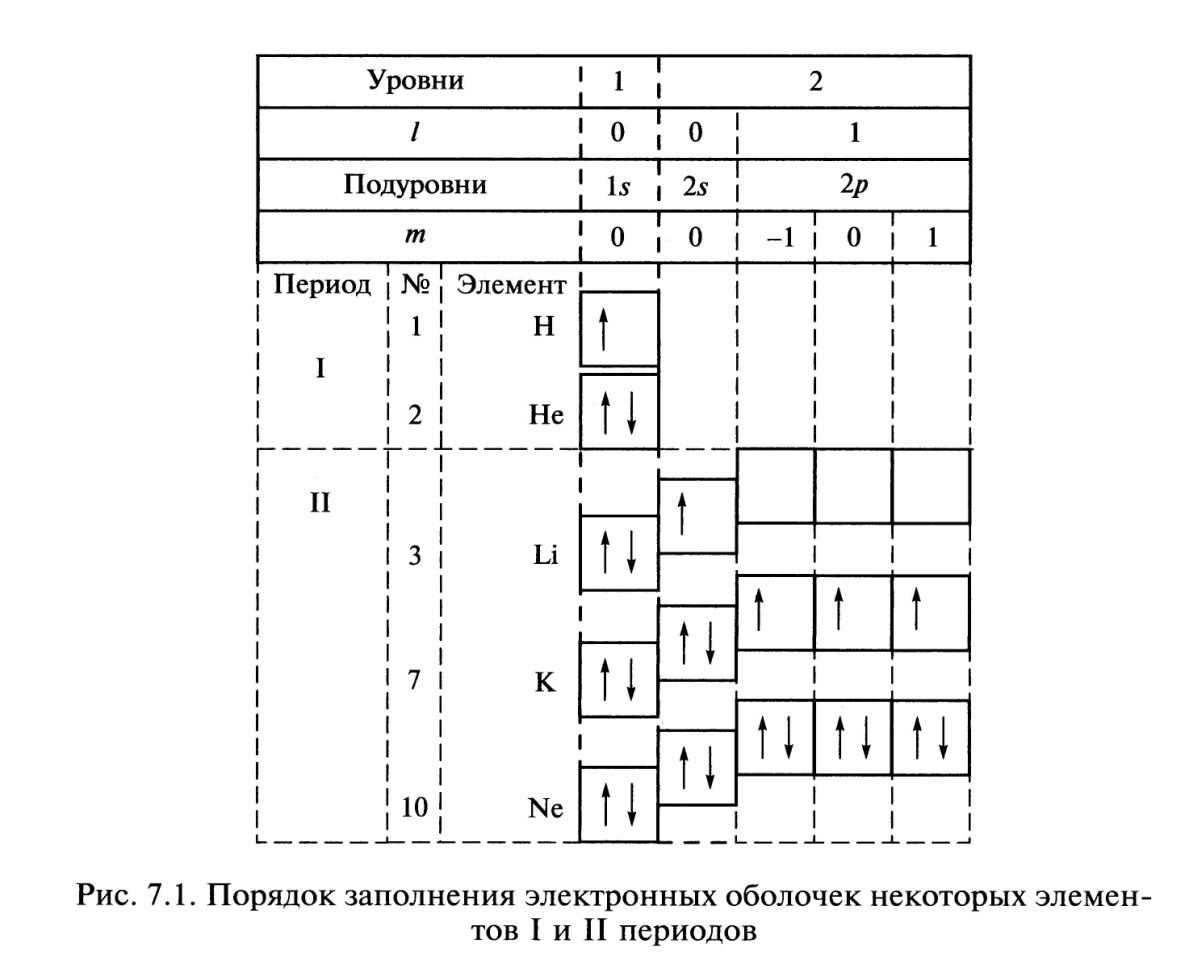
Порядок заполнения электронных оболочек некоторых элементов I и II периодов приведен на рис. 7.1.
Каждая клетка условно обозначает орбиталь. Для ℓ = 0 — орбиталь одна - s, для ℓ = 1 — три орбитали (три объединенные клетки), составляющие электронную оболочку соответствующего энергетического подуровня р. Ступенчатое расположение клеток соответствует увеличению энергии электронных оболочек. Стрелками обозначено распределение электронов по орбиталям и их спины.
Большинство свойств атомов определяется строением и характеристиками его внешних электронных оболочек, в которых электроны связаны относительно слабо (Есв — от нескольких единиц до нескольких десятков электронвольт). Строение внутренних оболочек атома, электроны которых связаны гораздо сильнее (102— 104 эВ), проявляется лишь при взаимодействии атома с быстрыми частицами или фотонами высоких энергий.
Внешняя оболочка полностью заполнена у атомов благородных газов (гелия, аргона и др.), поэтому их электронные структуры обладают высокой устойчивостью и они химически неактивны.
У других элементов они не заполнены, и находящиеся на этих оболочках электроны могут участвовать в образовании различных химических связей. Эти электроны названы валентными. Химические свойства элементов определяются структурой (числом электронов, силой связи и т.д.) внешней оболочки, и периодичность в изменении свойств элементов связана с периодически повторяемым строением внешнего электронного слоя. В зависимости от того, какой из подуровней внешнего электронного слоя заполняется последним, все элементы разделяются на четыре электронных семейства: s-, р-, d- и f-элементы.
