
Степени окисления азота
– 3: K3[Fe(CN)6], HCN, C2N2, HSCN, K3[Fe(SCN)6], NH3, [NH4]+, NH4Cl, Na3N, NaNH2, Na2NH, NH3.H2O, CO(NH2)2, Ca3N2, AlN, Si3N4, S4N4, P5N3, (NPF2)3, NCl3, [Cu(NH3)4](OH)2;
– 2: N2H4, N2H4.H2O, N2H5Cl, N2H6Cl2, [N2H5]+, (N2H6)2+, N2H6SO4, [Ni(N2H4)6](OH)2;
– 1: NH2OH, NH2OH.H2O, NH3OHCl, NH2Cl,
0: N2; [Ru(N2)(NH3)5]Cl2;
+ 1: Na2O, H2N2O2, Na2N2O2, N2F2;
+ 2: NO, K2N2O3, [Fe(NO)4], N2F4;
+ 3: N2O3, NF3, HNO2, KNO2, Ba(NO2)2.H2O, K[Ag(NO2)2], [NO][BrF4], [NO2]2[XeF4], NOF, (NO2)–, [NO][NO2], (NO)HSO4, (NO)[ClF4];
+ 4: NO2, N2O4;
+ 5: N2O5, NOF3, NO2F, HNO3, (NO3)–, H3NO4, ZiNO3.3H2O, Ca(NO3)2.4H2O, AgNO3, Fe(NO3)3.9H2O, Fe(NO3)2, CsNO4, [NO2][AsF6], HNO3(O2), [NO2][NO3], NO2NH2, [NO2]ClO4, [NOF2][SbF6], [NF4][AsF6];
Степени окисления фосфора
– 3: PH3, [PH4]ClO4, [PH4]I, Ca3P2, AlP, Cu3P, [Ni(PH3)4];
– 2: P2H4;
0: P4, Pn, P;
+ 1: H(PH2O2), K(PH2O2), NaPH2O2.H2O, Mg(PH2O2).6H2O;
+ 2: P2I4, H2P2H2O4, BaP2H2O4, (PH2O4)2–;
+ 3: P2O3, H2PHO3, (PHO3)–, K2PHO3, KHPHO3, PN, AgPHO3, PF3, POF, P2S3, P4O6, H[PF4], K3[PS3];
+ 4: P4O8, Cs4P4O10, H4P2O6, Na2H2P2O6.6H2O, Na4P2O6.10H2O, Ca2P2O6;
+ 5: P2O5, PF5, POCl3, H3PO4, H4P2O7, H3P3O9, H4P4O12, Na3PO4, Na2HPO4, NaH2PO4, Ca3(PO4)2, CaHPO4, Ca(H2PO4)2, Na4P2O7, K4P2O7.3H2O, K3PO4.7H2O, Na2H2P2O7.6H2O, NH4H2PO4, (NH4)2HPO4, P2S5, P4O10, H[PF6], PSF3, K3[PS4], P3N5, Ag4[P2S7], H3PO3(O2), H4P2O6(O2), H5P3O10, NH4[PF6], Na[PO2F2], H2[PO3F], H[PO2F2], Mg2[PN3], KAlP2O7, Al(H2PO4)3, H3[Fe(PO4)2], K6[Cu(P2O7)2].
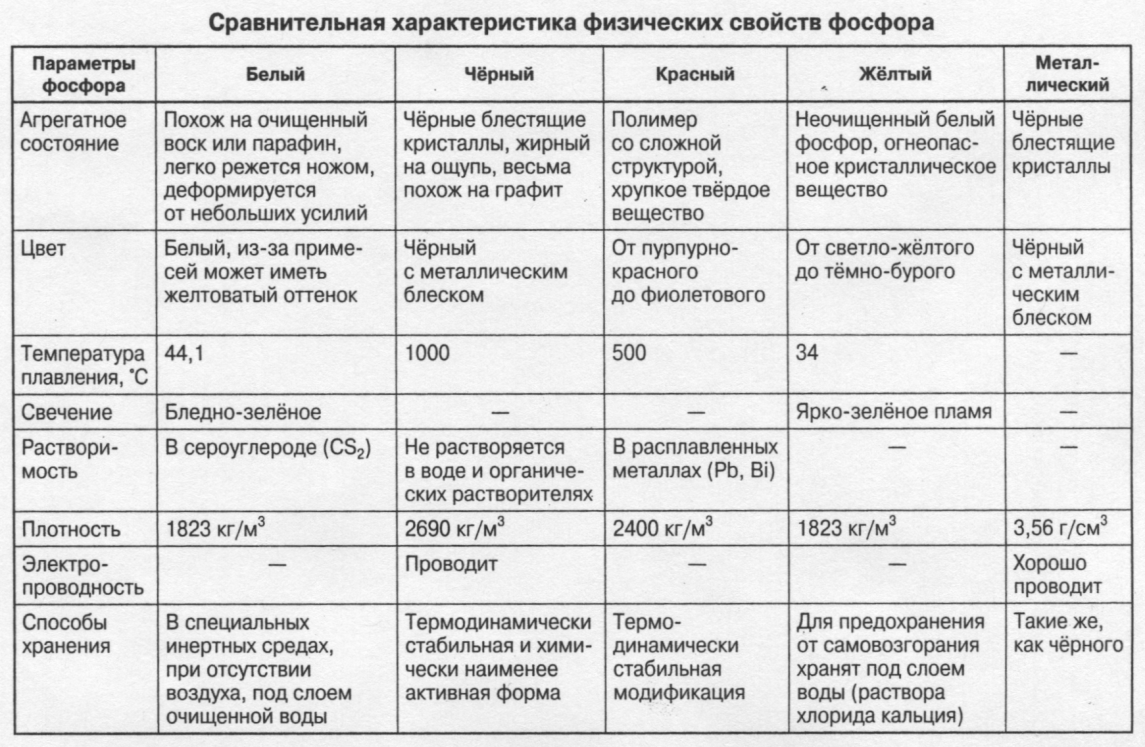
Химические свойства аммиака
1. 2NH3 ↔ N2H4 + H2
2NH3 ↔ N2 + 3H2 (t0C)
2. NH3(г) + H2O ↔ NH3.H2O(p) ↔ NH4+ + OH-
3. NH3 + HCl(г) → NH4Cl(тв.)
4. NH3 + H2SO4 → NH4HSO4
NH3 + H2SO4 → (NH4)2SO4
5. NH3 + H2S → NH4HS; NH3 + H2S → (NH4)2S
6. NH3 + O2 → N2 + H2O
7. Промышленный способ получения азотной кислоты:
NH3 + O2 → NO + H2O
NO + O2 → 2NO2
NO2 + O2 + H2O → HNO3
8. NH3 + O3 → NH4NO3 + O2 + H2O
9. NH3 + F2 → NF3 + NH4F (t0C)
10. NH3 + Cl2 → NH2Cl + NH4Cl
NH3 + Cl2 → N2 + NH4Cl
11. NH3(г) + H2O + CO2(г) → NH4HCO3
12. NH3 + CO2 → NH4(NH2COO)
NH3 + CO2 → CO(NH2)2 + H2O (t0C, p)
13. NH3 + Li → LiNH2 + H2↑; NH3 + Li → Li2NH + H2↑
14. NH3 + Na → Na3N + H2↑
15. NH3 + Mg → Mg3N2 + H2↑
16. NH3 + Cu + H2O + O2 → [Cu(NH3)2]OH
NH3 + Cu + H2O + O2 → [Cu(NH3)4](OH)2
17. NH3 + MnO2 → Mn2O3 + N2↑ + H2O (t0C)
NH3 + CuO → Cu + N2↑ + H2O (t0C)
18. NH3(ж) + Na → [Na(NH3)4]0 (син.)
[Na(NH3)4]0 + nNH3(ж) ↔ [Na(NH3)4]+ + e . nNH3
19. NH3(г) + CuCl2 → [Cu(NH3)6]Cl2
20. NH3(ж) + NH3(ж) ↔ NH4+ + NH2-
Химические свойства гидрата аммиака
1. NH3.H2O(разб.) ↔ NH4+ + OH-, Ko = 1,8 ∙ 10-5
2. NH3.H2O(конц.) → NH3↑ + H2O
3. NH3.H2O + HГ(разб.) → NH4Г (Г = F, Cl, Br, I)
NH3.H2O + HF(конц.) → NH4(HF2) + H2O
4. NH3.H2O + H2SO4 → NH4HSO4 + H2O
NH3.H2O + H2SO4 → (NH4)2SO4 + H2O
NH3.H2O + H2SO4 → (NH4)2SO4 + NH4HSO4 + H2O
5. NH3.H2O + HNO3 → NH4NO3 + H2O
6. NH3.H2O + H3PO4 → NH4(H2PO4) + H2O
NH3.H2O + H3PO4 → (NH4)2HPO4 + H2O
NH3.H2O + H3PO4 → (NH4)2HPO4 + NH4(H2PO4) + H2O
7. NH3.H2O + P2O5 → NH4(H2PO4) + H2O
NH3.H2O + P2O5 → (NH4)2HPO4 + H2O
NH3.H2O + P2O5 → (NH4)2HPO4 + NH4(H2PO4) + H2O
8. NH3.H2O + CO2 → (NH4)2CO3 + H2O (SO2)
NH3.H2O + CO2 → NH4НCO3 + H2O (SO2)
NH3.H2O + CO2 → NH4НCO3 + (NH4)2CO3 + H2O (SO2)
9. NH3.H2O + H2S → NH4HS + H2O
NH3.H2O + H2S → (NH4)2S + H2O
NH3.H2O + H2S → NH4HS + (NH4)2S + H2O
10. NH3.H2O + CH3COOH → NH4(CH3COO) + H2O
11. NH3.H2O + S → (NH4)2SO3S + NH4HS + H2O (tº)
12. NH3.H2O(гор.) + CO → NH4(HCOO)
13. NH3.H2O(конц., хол.) + AlCl3 → Al(OH)3↓ + NH4Cl
NH3.H2O(конц., гор.) + AlCl3 → AlO(OH)↓ + NH4Cl + H2O
14. NH3.H2O + NaClO(разб.) → NH2Cl↑ + NaOH + H2O
NH3.H2O + NaClO(конц.) → N2H4.H2O + NaCl + H2O (t0C)
15. NH3.H2O(конц.) + Br2 → N2↑ + NH4Br + H2O
16. NH3.H2O(конц.) + KMnO4 → MnO2↓ + N2↑ + KOH + H2O
NH3.H2O(конц.) + K2Cr2O7(тв.) → Cr(OH)3↓ + N2↑ + KOH + H2O
17. NH3.H2O(конц.) + AgCl → [Ag(NH3)2]Cl + H2O
NH3.H2O(конц.) + CuSO4 → [Cu(NH3)4]SO4 + H2O
18. NH3.H2O(конц.) + Co(OH)2 → [Co(NH3)6](OH)2
Оксиды фосфора
P2O3 (P4O6) |
P2O5 (P4O10) |
∆ |
∆ - 1492 кДж/моль (- 2984) |
1. Кислотные свойства: |
|
H2O, NaOH, NH3.H2O, Ba(OH)2, Na2CO3, Na2SiO3, |
|
Na2PHO3 |
Na3PO4, NaHPO4, Ca3(PO4)2, CaHPO4 |
2. Окислители, реагируют с восстановителями: |
|
C, Me |
C, Me, P |
3. Восстановители, реагируют с окислителями: |
|
O2, H2O2, Cl2, Br2 (PГ3О + О2) |
F2 (PОF3 + О2) |
Свойства азотной кислоты
1. Диссоциация:
HNO3
![]() H+
+ NO3–; HNO3
+ H2O
H3O+
+ NO3–.
H+
+ NO3–; HNO3
+ H2O
H3O+
+ NO3–.
2. Взаимодействие с металлами:
В зависимости от активности металла и концентрации кислоты продуктами восстановления могут быть NH4NO3, N2, N2O, NO, NO2:
Mg + HNO3 = Mg(NO3)2 + NH4NO3 + H2O; Mg + HNO3 = Mg(NO3)2 + N2+ H2O;
Mg + HNO3 = Mg(NO3)2 + N2O + H2O; Mg + HNO3 = Mg(NO3)2 + NO + H2O;
Mg + HNO3 = Mg(NO3)2 + NO2 + H2O; Cu + HNO3 = Cu(NO3)2 + NO + H2O;
Pb + HNO3 = Pb(NO3)2 + NO2 + H2O; Sn + HNO3 = Sn(NO3)2 + NH4NO3 + H2O;
Sn + HNO3(конц.) = H2SnO3¯ + NO2 + H2O; Al + HNO3(р-р) = Al(NO3)3 + N2O + H2O;
Fe + HNO3 (разб.)= Fe(NO3)3 + NO + H2O; Fe + HNO3 = Fe(NO3)3 + NO2 + H2O;
Fe + HNO3(оч. разб.)= Fe(NO3)2 + NH4NO3 + 6H2O.
Концентрированная азотная кислота пассивирует металлы Al, Be, Bi, Co, Cr, Nb, Ni, Pb, Th, U. Концентрированная азотная кислота не реагирует с металлами Au, Ir, Pt, Rh, Ta, W, Zr.
3. Концентрированная азотная кислота взаимодействует с неметаллами, восстанавливаясь до NO или NO2:
HNO3(безводн) + F2 = (NO2)OF + HF;
S + HNO3 = H2SO4 + NO2 + H2O; C + HNO3 = CO2 + NO2 + H2O;
I2 + HNO3 = HIO3 + NO2 + H2O; P + HNO3 = H3PO4 + NO2 + H2O.
4. Взаимодействие с оксидами металлов:
а) реакции обмена (Fe2O3, Al2O3, CuO и т.п.):
HNO3 + Al2O3 = Al(NO3)3 + H2O;
(Pb2+2Pb+4)O4 + HNO3 = PbO2 + Pb(NO3)2 + H2O.
б) окислительно-восстановительные реакции (FeO, CrO, Cu2O, Fe3O4, As2O3) с выделением NO или NO2:
HNO3 + FeO = Fe(NO3)3 + NO + H2O; HNO3 + CrO = Cr(NO3)3 + NO2 + H2O;
HNO3 + Cu2O = Cu(NO3)2 + NO2 + H2O;
HNO3 + (Fe+2,Fe2+3)O4 = Fe(NO3)3 + NO2 + H2O;
HNO3 + (Fe+2,Fe2+3)O4 = Fe(NO3)3 + NO + H2O;
HNO3(конц.) + FeO = Fe(NO3)3 + NO2 + H2O.
5. Взаимодействие с основными и амфотерными гидроксидами:
а) реакции обмена:
HNO3 + Al(OH)3 = Al(NO3)3 + H2O; HNO3 + NaOH = NaNO3 + H2O;
б) окислительно-восстановительные реакции (Fe(OH)2, Cr(OH)2) с выделением NO или NO2:
HNO3 + Fe(OH)2 = Fe(NO3)3 + NO2 + H2O;
HNO3 + Cr(OH)2 = Cr(NO3)3 + NO + H2O.
6. Взаимодействие с аммиаком, гидратом аммиака (гидроксидом аммония):
HNO3 + NH3 = NH4NO3; HNO3 + NH4OH = NH4NO3 + H2O.
7. Взаимодействие с оксидами неметаллов:
H2O + P2O3 + HNO3(конц.) = H3PO4 + NO2; SO2 + HNO3(конц.) = H2SO4 + NO2;
HNO3 конц + As2O3 + H2O = H3AsO4 + NO2↑ (кип).
8. Взаимодействие с солями:
а) реакции обмена (CaCO3, Na2CO3, Na2SiO3, NaHCO3, (CuOH)2CO3, Na[Al(OH)4], [Ag(NH3)2}Cl):
HNO3 + Na2CO3 = NaNO3 + CO2 + H2O; HNO3 + Na2SiO3 = NaNO3 + H2SiO3¯;
б) окислительно-восстановительные реакции (сульфиты, нитриты, гипофосфиты, фосфиты, соли железа(II)) с выделением NO или NO2:
HNO3 конц + FeSO3 = Fe(NO3)3 + NO2 + H2SO4 + H2O;
HNO3 конц + FeSO4 + H2SO4 = Fe2(SO4)3 + NO2 + H2O;
HNO3 конц + Na2SO3 = Na2SO4 + NO2 + H2O;
HNO3 конц + K2SO3S = K2SO4 + S + NO2↑ + H2O;
HNO3 конц + Fe(NO3)2 = Fe(NO3)3 + NO2↑ + H2O;
HNO3 конц + AgNO2 = AgNO3 + NO2↑ + H2O.
9. Взаимодействие с бинарными соединениями: металл-неметалл, неметалл-неметалл: (сульфиды, карбиды, йодиды, фосфиды, нитриды, …)
HNO3 конц + Na2S = NaNO3 + S¯ + NO2 + H2O;
HNO3 конц + Na2S = Na2SO4 + NO + H2O;
HNO3 конц + FeS = Fe(NO3)3 + S + NO2 + H2O;
HNO3 конц + FeS = Fe2(SO4)3 + Fe(NO3)3 + NO2 + H2O;
HNO3 конц + Fe3C = Fe(NO3)3 + NO2 + CO2 + H2O;
HNO3 конц + FeI2 = Fe(NO3)3 + I2 + NO2 + H2O;
HNO3 конц + CuI = Cu(NO3)2 + I2 + NO2 + H2O.
HNO3 конц 3 + Hg2I2 = Hg(NO3)2 + I2 + NO2↑ + H2O;
HNO3 конц + As2S3 = H3AsO4 + H2SO4 + NO2↑ + H2O;
HNO3 конц + SnS = SnO2 + NO2↑ + H2SO4 + H2O;
HNO3 + Mg3N2 = Mg(NO3)2 + NH4NO3;
HNO3 + Al4C3 = Al(NO3)3 + CH4↑;
HNO3 конц + Ca3P2 = Ca(NO3)2 + H3PO4 + NO2 + H2O.
10. Разложение при нагревании:
HNO3 = NO2 + O2 + H2O.
11. Реагирует с P2O5, проявляющим сильные водоотнимающие свойства:
HNO3 + P2O5 = N2O5 + HPO3.
12. Взаимодействие с водородными соединениями неметаллов:
HNO3 + H2S = S¯ + NO2 + H2O; HNO3 + H2S = H2SO4 + NO2 + H2O;
HNO3 + PH3 = H3PO4 + NO2 + H2O; HNO3 + HI = HIO3 + NO2 + H2O;
HNO3 конц + SbH3 = Sb2O5 + NO2↑ + H2O.
13. Взаимодействие с кислотами
HNO3 + H2SO3 = H2SO4 + NO + H2O; HNO3 + HPHO3 = H3PO4 + NO2 + H2O;
HNO3 + H2PHO3 = H3PO4 + NO2 + H2O.
14. Взаимодействие с карбонилами металлов
HNO3 конц + [W(CO)6] = WO3 + CO2↑ + NO2↑ + H2O;
HNO3 конц + [Fe(CO)5] = Fe(NO3)3 + CO2↑ + NO2↑ + H2O;
HNO3 конц + [Ni(CO)5] = Ni(NO3)2 + CO2↑ + NO2↑ + H2O;
HNO3 конц + [Co2(CO)8] = Co(NO3)2 + CO↑ + NO2↑ + H2O.
15. Участие азотной кислоты в ОВР с другими кислотами
HNO3 + Cu + HCl = CuCl2 + NO↑ + H2O; HNO3 + Fe + HCl = FeCl3 + NO↑ + H2O;
HNO3 + Pt + HCl = H2[PtCl6] + NO↑ + H2O; HNO3 + Bi + HCl = BiCl3 + NO↑ + H2O;
HNO3 + Hg + HCl = HgCl2 + NO↑ + H2O; HNO3 + Ge + HCl = GeCl4 + NO↑ + H2O.
HNO3 + Sb + HCl = H[SbCl6] + NO↑ + H2O; HNO3 + Si + HF = H2[SiF6] + NO↑ + H2O;
HNO3 + As + HCl = H[AsCl4] + NO↑ + H2O;
HNO3 + Au + HCl = H[AuCl4] + NO↑ + H2O;
HNO3 + Fe + H2SO4 = Fe2(SO4)3 + NO2↑ + H2O;
Химические свойства Н3РО4
1. Н3РО4 ↔ Н+ + Н2РО41- Кк(I) = 7,1 . 10-3
Н2РО41- ↔ Н+ + НРО42- Кк(II) = 6,2 . 10-8
НРО42- ↔ Н+ + РО43- Кк(III) = 5,0 . 10-13
2. 2H3+1PO4 + Zn0 → Zn+2(H2PO4)2 + H20↑(ZnHPO4, Zn3(PO4)2)

3. 2Н3+1РО4 + Fe0 → Fe+2(H2PO4)2 + H20↑(FeHPO4, Fe3(PO4)2)
H3PO4 + Fe + O2 →H3[Fe(PO4)2] + H2O (H6[Fe(PO4)3])
4. CaO + 2H3PO4 → Ca(H2PO4)2 + H2O
CaO + 2H3PO4 → Ca2+ + 2H2PO4- + H2O
5. 5.1 Н3РО4 + 3NaOH → Na3PO4 + 3H2O
Н3РО4 + 3OH- → PO43- + 3H2O
5.2 Н3РО4 + 2NaOH → Na2HPO4 + 2H2O
Н3РО4 + 2OH- → HPO42- + 2H2O
5.3 Н3РО4 + NaOH → NaH2PO4 + H2O
Н3РО4 + OH- → H2PO4- + H2O
5.4 2Н3РО4 + 5NaOH → Na3PO4 + Na2HPO4 + 5H2O
2Н3РО4 + 5OH- → PO43- + HPO42- + 5H2O
(n+m)H3PO4 + (3n+2m)NaOH → nNa3PO4 + mNa2HPO4 + (3n+2m)H2O
5.5 2Н3РО4 + 3NaOH → Na2HPO4 + NaH2PO4 + 3H2O
2Н3РО4 + 3OH- → HPO42- + H2PO4- + 3H2O
(n+m)H3PO4 + (2n+m)NaOH → nNa2HPO4 + NaH2PO4 + 3H2O
 2Н3РО4
+ 4NaOH → Na3PO4
+ NaH2PO4
+ 4H2O
2Н3РО4
+ 4NaOH → Na3PO4
+ NaH2PO4
+ 4H2O
уравнение 5.2 2 Na2HPO4
6. 6.1 3Ca(OH)2 + 2H3PO4 → Ca3(PO4)2↓ + 6H2O
3Ca2+ + 6OH- + 2H3PO4 → Ca3(PO4)2↓ + 6H2O
6.2 Ca(OH)2 + H3PO4 → CaHPO4↓ + 2H2O
Ca2+ + 2OH- + H3PO4 → CaHPO4↓ + 2H2O
6.3 Ca(OH)2 + 2H3PO4 → Ca(H2PO4)2 + 2H2O
2OH- + 2H3PO4 → 2H2PO4- + 2H2O
7. Na2CO3 + 2H3PO4 → 2NaH2PO4 + CO2↑ + H2O
pH > 7 pH < 7 pH < 7
CO32- + 2H3PO4 → 2H2PO4- + CO2↑ + H2O
8. Na2SiO3 + 2H3PO4 → H2SiO3↓ + 2NaH2PO4
pH < 7
SiO32- + 2H3PO4 → H2SiO3↓ + 2H2PO4-
9. 2H3PO4 + FeCl3 → H3[Fe(PO4)2] + 3HCl
2H3PO4 + Fe3+ → [Fe(PO4)2]3- + 6H+
10. NaHCO3 + H3PO4 → NaH2PO4 + CO2↑ + H2O
pH < 7
HCO3- + H3PO4 → H2PO4- + CO2↑ + H2O
11. (ZnOH)2CO3 + 4H3PO4 → 2Zn(H2PO4)2 + CO2↑ + 3H2O
(ZnOH)2CO3 + 4H3PO4 → 2Zn2+ + 4H2PO4- + CO2↑ + 3H2O
12. 3[Ag(NH3)2]OH + 4H3PO4 → Ag3PO4↓ + 3(NH4)2HPO4 + 3H2O
3[Ag(NH3)2]+ + 3OH- + 4H3PO4 → Ag3PO4↓ + 6NH4+ + 3HPO42- + 3H2O
13. 2Na3PO4 + H3PO4 → 3Na2HPO4
2 моль 1 моль 3 моль
2PO43- + H3PO4 → 3HPO42-
Na3PO4 + 2H3PO4 → 3Na2HPO4
1 моль 2 моль 3 моль
PO43- + 2H3PO4 → 3HPO42-
Na3PO4 + H3PO4 → Na2HPO4 + NaH2PO4
1 моль 1 моль 1 моль 1 моль
PO43- + H3PO4 → HPO42- + H2PO4-
14. Na2HPO4 + H3PO4 → 2NaH2PO4
HPO42- + H3PO4 → 2H2PO4-
15. 2NH3 + H3PO4 → (NH4)2HPO4
2 моль 1 моль 1 моль
NH3 + H3PO4 → NH4H2PO4
2 моль 1 моль 1 моль
3NH3 + 2H3PO4 → (NH4)2HPO4 + NH4H2PO4
3 моль 2 моль 1 моль 1 моль
16. 2H3PO4 → H4P2O7 + H2O (150ºC)
H3PO4 → HPO3 + H2O (300ºC, вак.)
Разложение нитратов
1.Нитраты щелочных металлов:
LiNO3 = Li2O + NO2 + O2
NaNO3 = NaNO2 + O2 380 oC;
KNO3 = KNO2 + O2 400 oC.
2. Нитраты щелочноземельных металлов:
Ca(NO3)2 = Ca(NO2)2 + O2 450–500 oC;
Ca(NO3)2 = CaO + NO2 + O2 более 560 oC;
3. Нитраты серебра и ртути:
Hg(NO3)2 = Hg + NO2 + O2;
AgNO3 = Ag + NO2 + O2
4. Нитраты марганца и олова:
Mn(NO3)2 = MnO2 + NO2;
Sn(NO3)2 = SnO2 + NO2
5. Разложение нитрата железа (II), кобальта (II):
Fe(NO3)2 = FeO + NO2 + O2;
Fe(NO3)2 = Fe2O3 + NO2 + O2;
Fe(NO3)2 = Fe3O4 + NO2 + O2;
Co(NO3)2 = CoO + NO2 + O2;
Co(NO3)2 = Co2O3 + NO2 + O2;
6. Нитраты остальных металлов:
Cu(NO3)2 = CuO + NO2 + O2;
Al(NO3)3 = Al2O3 + NO2 + O2.
Mg(NO3)2 = MgO + NO2 + O2
Ni(NO3)2 = NiO + NO2 + O2
7. Разложение нитрата аммония:
NH4NO3 = N2O + H2O; 190–235 °C
NH4NO3 = N2 + O2 + H2O. выше 300 °С
Химические свойства нитрита калия (натрия, кальция, стронция, бария)
1. KNO2 ↔ K+ + NO2-
NO2- + H2O → HNO2 + OH-, pH > 7
2. KNO2 + HCl(разб.) → KCl + HNO2
3. KNO2(тв.) + HCl(конц.) → KCl + KNO3 + NO↑ + H2O
KNO2 + HCl(конц.) → (NO)Cl + KCl + H2O
4. KNO2(насыщ.) + H2SO4(конц.) → K2SO4 + NO2↑ + NO↑ + H2O
5. KNO2(тв.) + HNO3(конц.) → KNO3 + NO2↑ + NO↑ + H2O
6. KNO2 + O2 → KNO3
7. KNO2 + H2O2 → KNO3 + H2O
KNO2 + H2O + Br2 → KBr + H2O
8. KNO2 + H2SO4 (разб.) + KMnO4 → KNO3 + MnSO4 + K2SO4 + H2O
KNO2 + H2SO4 (разб.) + K2Cr2O7 → KNO3 + Cr2(SO4)3 + K2SO4 + H2O
9. KNO2 + H(Zn, KOH) → NH3↑ + KOH + H2O
10. KNO2(насыщ.) + (NH4)2SO4(насыщ.) → N2↑ + K2SO4 + H2O
11. KNO2 + H2SO4 (разб.) + KI → NO↑ + I2↓ + K2SO4 + H2O
12. KNO2(тв.) + H2SO4 (разб.) + FeSO4(тв.) → Fe2(SO4)3 + K2SO4 + H2O
13. KNO2 + Cr2O3 + KNO3 → K2CrO4 + NO↑
14. KNO2(разб.) + AgNO3 → AgNO2↓ + KNO3
KNO2(конц.) + AgNO3 → K[Ag(NO2)2]
15. KNO2 + CoSO4 + CH3COOH → K3[Co(NO2)6]↓ + NO↑ + CH3COOK + K2SO4 + H2O
NaNO2 + CoSO4 + CH3COOH → Na3[Co(NO2)6] + NO↑ + CH3COONa + Na2SO4 + H2O
Химические свойства Na2HPO4 –
гидроортофосфата натрия
1. Na2HPO4 ↔ 2Na+ + HPO42-
HPO42- + H2O → H2PO4- + OH-, pH > 7
Na2HPO4 + H2O ↔ NaH2PO4 + NaOH
2. Na2HPO4 + NaOH → Na3PO4 + H2O
Na2HPO4 + Ca(OH)2 → Na3PO4 + Ca3(PO4)2↓
3. Na2HPO4 + H3PO4 → NaH2PO4
4. Na2HPO4 + AgNO3 → Ag3PO4↓ + NaNO3 + NaH2PO4
5. Na2HPO4 + CaCl2 → CaHPO4↓ + NaCl
Na2HPO4 + CaCl2 → Ca3(PO4)2↓ + NaCl + NaH2PO4
6. Na2HPO4 → Na4P2O7 + H2O (tº)
Химические свойства NaH2PO4 –
дигидроортофосфата натрия
1. NaH2PO4 ↔ Na+ + H2PO42-
H2PO4- + H2O ↔ HPO42- + H3O+, pH < 7
2. NaH2PO4 + NaOH → Na2HPO4 + H2O
NaH2PO4 + NaOH → Na3PO4 + H2O
NaH2PO4 + Ca(OH)2 → CaHPO4↓ + Na2HPO4 + H2O
NaH2PO4 + Ca(OH)2 → Ca3(PO4)2↓ + Na3PO4 + H2O
NaH2PO4 + Ca(OH)2 → Ca3(PO4)2 + NaOH + H2O
3. NaH2PO4 + AgNO3 → Ag3PO4↓ + NaNO3 + H3PO4
4. NaH2PO4 → Na2H2P2O7 + H2O (tº)
Химические свойства ортофосфата натрия
1. Na3PO4 + HOH ↔ Na2HPO4 + NaOH
PO43- + HOH ↔ HPO42- + OH-, pH > 7
2. Na3PO4(конц.) + Al + H2O → Na[Al(OH)4] + Na2HPO4 + H2↑ (t0C)
Na3PO4(конц.) + Zn + H2O → Na[Zn(OH)4] + Na2HPO4 + H2↑ (t0C)
3. Na3PO4 + CO2 + H2O → Na2HPO4 + NaHCO3
4. Na3PO4 + H2SO4 → Na2SO4 + H3PO4 (HCl, HNO3)
Na3PO4 + H2SO4 → Na2SO4 + Na2HPO4 (HCl, HNO3)
Na3PO4 + H2SO4 → Na2SO4 + NaH2PO4 (HCl, HNO3)
Na3PO4 + CH3COOH → NaH2PO4 + CH3COONa
5. Na3PO4 + P2O5 + H2O → Na2HPO4
Na3PO4 + P2O5 + H2O → NaH2PO4
Na3PO4 + P2O5 + H2O → Na2HPO4 + NaH2PO4
6. Na3PO4 + H3PO4 → Na2HPO4
Na3PO4 + H3PO4 → NaH2PO4
Na3PO4 + H3PO4 → Na2HPO4 + NaH2PO4
7. Na3PO4 + AgNO3 → NaNO3 + Ag3PO4↓
8. Na3PO4 + MeX2 → NaX + Me3(PO4)2↓ (Ca2+, Sr2+, Ba2+, Cl-, Br-, NO3-)
9. Na3PO4 + NaH2PO4 → Na2HPO4
10. Na3PO4 + NH4Cl → Na2HPO4 + NaCl + NH3↑ (t0C)
1. Объем аммиака равен 7.84 л. Вычислите количество и массу вещества, количество молекул, массу молекулы, плотность, относительную плотность по водороду и по воздуху.
Решение:
1 а.е.м. = 1.661 ∙ 10-24 г
M(NH3) = 17 г/моль
n(NH3) = 7.84 л / 22.4 л/моль = 0.35 моль
m(NH3) = 0.35 моль · 17 г/моль = 5.95 г
N(NH3) = 0.35 моль · 6.02·1023 моль-1 = 2.107·1023
mM(NH3) = 17 г/моль / 6.02·1023 моль-1 = 2.824·10-23 г
mM(NH3) = 5.95 г / 2.107·1023 моль-1 = 2.824·10-23 г
mM(NH3) = 1.661 ∙ 10-24 г · 17 = 2.824·10-23 г
(NH3) = 17 г/моль / 22.4 л/моль = 0.759 г/л
(NH3) = 5.95 г / 7.84 л = 0.759 г/л
DH2(NH3) = 17 / 2 = 8.5
Dвозд(NH3) = 17 / 29 = 0.586
Решите: 1. Объем оксида азота (II) равен 6.16 л. Вычислите количество и массу вещества, количество молекул, массу молекулы, плотность, относительную плотность по водороду и по воздуху.
2. Масса оксида азота (I) равна 9,9 г. Вычислите количество вещества, объем, количество молекул, массу молекулы, плотность, относительную плотность по водороду и по воздуху.
3. Число молекул оксида азота (II) равно 2,709 ∙ 1023. Вычислите количество и массу вещества, объем, массу молекулы, плотность, относительную плотность по водороду и по воздуху.
2. Относительная плотность по гелию смеси азота и аммиака равна 5.35. Вычислите массовые и объемные доли газов в смеси.
Решение:
M(N2 + NH3) = 5.35 · 4 г/моль = 21.4 г/моль
n(N2 + NH3) = 1 моль
m(N2 + NH3) = 21.4 г
M(N2) = 28 г/моль n(N2) = x моль
M(NH3) = 17 г/моль n(NH3) = (1 – x) моль
28x + 17(1 – x) = 21.4
28x + 17 – 17x = 21.4 11x = 4.4 x = 0.4
n(N2) = 0.4 моль n(NH3) = 0.6 моль
%(N2) = (0.4 моль / 1 моль) ·100% = 40%
%(NH3) = (0.6 моль / 1 моль) ·100% = 60%
w%(N2) = (0.4 моль· 28 г/моль / 21.4 г) ·100% = 52.34%
w%(NH3) = (0.6 моль· 17 г/моль / 21.4 г) ·100% = 47.66%
Решите: 1. Относительная плотность по водороду смеси оксида азота (II) и аммиака равна 9.8. Вычислите массовые и объемные доли газов в смеси.
2. Относительная плотность по водороду смеси оксида азота (II) и оксида азота (I) равна 1,1552. Вычислите массовые и объемные доли газов в смеси.
3. Масса смеси азота и водорода равна 3.4 г, а объем смеси равен 8.96 л. Вычислите молярную массу смеси, массовые и объемные доли газов в смеси.
Решение:
n(N2 + H2) = 8.96 л / 22.4 л/моль = 0.4 моль
M(N2) = 28 г/моль n(N2) = x моль
M(H2) = 2 г/моль n(H2) = (0.4 – x) моль
28x + 2(0.4 – x) = 3.4
28x + 0.8 – 2x = 3.4 26x = 2.6 x = 0.1
n(N2) = 0.1 моль n(H2) = 0.3 моль
M(N2 + H2) = 3.4 г / 0.4 моль = 8.5 г/моль
%(N2) = (0.1 моль / 0.4 моль) ·100% = 25%
%(H2) = (0.3 моль / 0.4 моль) ·100% = 75%
w%(N2) = (0.1 моль· 28 г/моль / 3.4 г) ·100% = 82.35%
w%(H2) = (0.3 моль· 2 г/моль / 3.4 г) ·100% = 17.65%
Решите: 1. Масса смеси трифторида азота и фтора равна 14.7 г, а объем смеси равен 6.72 л. Вычислите молярную массу смеси, массовые и объемные доли газов в смеси.
2. Масса смеси азота и оксида азота (I) равна 8,6 г, а объем смеси равен 5,6 л. Вычислите молярную массу смеси, массовые и объемные доли газов в смеси.
3. Масса смеси оксидов азота (II) и (IV) равна 7,6 г, а объем смеси равен 4,48 л. Вычислите молярную массу смеси, массовые и объемные доли газов в смеси. Какова массовая доля соли в растворе, полученном при взаимодействии данной смеси с 53,86 мл 13%-го раствора гидроксида натрия (2 = 1,14 г/мл).
4. Какой объем аммиака (н.у.) необходимо растворить в 500 мл воды, чтобы получить 20%-ный раствор аммиака ( = 0.922 г/мл). Какова молярная концентрация аммиака?
Решение:
M(р-ра NH3) = 500 г / 0.8 = 625 г
n(NH3) = (625 г – 500 г) / 17 г/моль = 7.353 моль
V(NH3) = 7.353 моль · 22.4 л/моль = 164.7 л
V(р-ра) = 625 г / 0.922 г/мл = 677.9 мл
С(NH3) = 7.353 моль / 0.6779 л = 10.85 моль/л
Решите: Какой объем аммиака (н.у.) необходимо растворить в 300 мл воды, чтобы получить 25%-ный раствор аммиака ( = 0.906 г/мл). Какова молярная концентрация аммиака?
5. В 1 литре воды растворили 300 л аммиака (н.у.). Какова массовая доля аммиака в растворе?
Решение:
m(NH3) = (300 л / 22.4 л/моль) · 17 г/моль = 227.7 г
m(р-ра) = 227.7 г + 1000 г = 1227.7 г
w%(NH3) = (227.7 г / 1227.7 г) ·100% = 18.5
Решите: В 750 мл воды растворили 320 л аммиака (н.у.). Какова массовая доля аммиака в растворе?
6. К 150 г 8%-го раствора аммиака прилили 200 г 25%-го раствора аммиака. Какова массовая доля аммиака в растворе?
Решение:
m3(р-ра) = 150 + 200 = 350 г
m3(NH3) = 150·0.08 + 200·0.25 = 62 г
w3%(NH3) = (62 г / 350 г) ·100% = 17.7%
Решите: К 300 мл 5%-го раствора аммиака (1 = 0.976 г/мл) прилили 500 мл 28%-го раствора аммиака (2 = 0.898 г/мл). Какова массовая доля аммиака в растворе?
7. Растворимость аммиака при 20 ºС равна 526 г/л. Вычислите массовую долю аммиака в растворе. Какой объём аммиака растворяется в 1 литре воды при 20 ºС (Р=101325 Па)?
Решение:
w%(NH3) = (526 / 1526) · 100% = 34,47 %
n (NH3) = 526 г / 17г/моль = 30,9412 моль
V (NH3) = nRT/P
V (NH3)= (30.9412 8,314 293) / 101325 = 0,744 м3 (744 л)
Решите: Растворимость аммиака при 25 ºС равна 462 г/л. Вычислите массовую долю аммиака в растворе. Какой объём аммиака растворяется в 1 литре воды при 25 ºС (Р=101325 Па)?
8. Какой объем 17%-го раствора аммиака ( = 0.932 г/мл) вступит в реакцию с 62.5 мл 15%-го раствора хлорида алюминия ( = 1.14 г/мл)?
Решение:
0.08 моль 0.24 моль
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
1 моль 3 моль
133.5 г/моль 17 г/моль
n(AlCl3) = (62.5 мл · 0.15 · 1.14 г/мл) / 133.5 г/моль = 0.08 моль
V(р-ра NH3) = (0.24 моль · 17 г/моль) / (0.17 · 0.932 г/мл) = 25.8 мл
Решите: Какой объем 30%-го раствора сульфата железа (III) ( = 1.308 г/мл) вступит в реакцию с 27.7 мл 20%-го раствора аммиака ( = 0.922 г/мл)?
9. Какой максимальный объем 25%-го раствора аммиака ( = 0.906 г/мл) вступит в реакцию с 55.3 мл 18%-го раствора сульфата меди (II) ( = 1.206 г/мл)?
Решение:
0.075 моль 0.3 моль
CuSO4 + 4NH3(р-р) = [Cu(NH3)4]SO4
1 моль 4 моль 1 моль
160 г/моль 17 г/моль
n(CuSO4) = (55.3 мл · 0.18 · 1.206 г/мл) / 160 г/моль = 0.075 моль
V(р-ра NH3) = (0.3 моль · 17 г/моль) / (0.25 · 0.906 г/мл) = 22.5 мл
Решите: Какой максимальный объем 25%-го раствора аммиака ( = 0.906 г/мл) вступит в реакцию с 35.1 мл 30%-го раствора хлорида цинка ( = 1.293 г/мл)?
10. Какой объем аммиака выделится при взаимодействии 47.4 мл 20%-го раствора сульфата аммония ( = 1.115 г/мл) с 36 мл 25%-го раствора гидроксида калия ( = 1.24 г/мл) при нагревании?
Решение:
0.08 моль 0.16 моль 0.16 моль
(NH4)2SO4 + 2KOH = K2SO4 + 2NH3 + 2H2O
1 моль 2 моль 2 моль
132 г/моль 56 г/моль 22.4 л/моль
n((NH4)2SO4) = (47.4 мл · 0.2 · 1.115 г/мл) / 132 г/моль = 0.08 моль
n(KOH) = (36 мл · 0.25 · 1.24 г/мл) / 56 г/моль = 0.2 моль
(0.08/1) < (0.2/2), KOH в избытке
V(NH3) = 0.16 моль · 22.4 л/моль = 3.584 л
Решите: Какой объем аммиака выделится при взаимодействии 38 мл 20%-го раствора хлорида аммония ( = 1.057 г/мл) с 25 мл 25%-го раствора гидроксида натрия ( = 1.28 г/мл) при нагревании?
11. Какой объем 18%-го раствора сульфата аммония ( = 1.103 г/мл) вступит в реакцию с 65.7 мл 25%-го раствора хлорида бария ( = 1.267 г/мл)?
Решение:
0.1 моль 0.1 моль
(NH4)2SO4 + BaCl2 = BaSO4 + 2NH4Cl
1 моль 1 моль
132 г/моль 208 г/моль
n(BaCl2) = (65.7 мл · 0.25 · 1.267 г/мл) / 208 г/моль = 0.1 моль
V(р-ра (NH4)2SO4) = (0.1 моль · 132 г/моль) / (0.18 · 1.103 г/мл) = 66.5 мл
Решите: Какой объем 20%-го раствора иодида аммония ( = 1.132 г/мл) вступит в реакцию с 83.7 мл 25%-го раствора нитрата свинца ( = 1.266 г/мл)?
12. В каком объеме воды необходимо растворить 30 г хлорида аммония, чтобы получить 20%-й раствор хлорида аммония?
Решение:
m(р-ра NH4Cl) = 30 г / 0.2 = 150 г m(H2O) = 150 – 30 = 120 г V(H2O) = 120 г / 1 г/мл = 120 мл
Решите: В каком объеме воды необходимо растворить 60 г сульфата аммония, чтобы получить 25%-й раствор сульфата аммония?
13. Сколько по массе нитрата аммония необходимо растворить в 225 мл воды, чтобы получить 25%-й раствор нитрата аммония?
Решение:
m(р-ра) = 225 г / 0.75 = 300 г m(NH4NO3) = 300 – 225 = 75 г
Решите: Сколько по массе бромида аммония необходимо растворить в 210 мл воды, чтобы получить 30%-й раствор бромида аммония?
14. Растворимость хромата аммония при 25С равна 370 г/л. Вычислите массовую долю хромата аммония в насыщенном растворе.
Решение:
w%((NH4)2CrO4) = 370 г / (370 г + 1000 г) ·100% = 27.01%
Решите: Растворимость бихромата аммония при 20С равна 356 г/л. Вычислите массовую долю бихромата аммония в насыщенном растворе.
15. Массовая доля бромида аммония в насыщенном при 20С растворе равна 42.595%. Вычислите растворимость бромида аммония.
Решение:
Пусть m(р-ра NH4Br) = 100 г
m(NH4Br) = 42.595 г
m(H2O) = 57.405 г V(H2O) = 0.057405 л
S20(NH4Br) = (42.595 г / 57.405 г) · 100 = 74.2 г / 100 г H2O
S20(NH4Br) = (42.595 г / 57.405 г) · 1000 = 742 г/л
S20(NH4Br) = 42.595 г / 0.057405 л = 742 г/л
Решите: Массовая доля сульфата аммония в насыщенном при 20С растворе равна 42.98745%. Вычислите растворимость сульфата аммония.
16. Дигидроортофосфат аммония массой 70.6 г растворяется в 200 мл воды с образованием насыщенного при 20С раствора. Определите растворимость NH4H2PO4.
Решение:
S20(NH4H2PO4) = 70.6 г / 0.2 л = 353 г/л
Решите: Гидроортофосфат аммония массой 86.25 г растворяется в 125 мл воды с образованием насыщенного при 20С раствора. Определите растворимость (NH4)2HPO4.
17. Какова молярная концентрация нитрата аммония в 20%-м растворе ( = 1.083 г/мл)?
Решение:
Пусть V(р-ра NH4NO3) = 1 л (1000 мл)
n(NH4NO3) = (1000 мл · 0.2 · 1.083 г/мл) / 80 г/моль = 2.7075 моль
C(NH4NO3) = 2.7075 моль / 1 л = 2.7075 моль/л
Решите:
Какова молярная концентрация сульфата аммония в 30%-м растворе ( = 1.172 г/мл)?
18. Какова массовая доля хлорида аммония в растворе с молярной концентрацией 2.722 моль/л ( = 1.04 г/мл)?
Решение:
w%(NH4Cl) = (2.722 моль · 53.5 г/моль) / (1000 г · 1.04 г/мл)·100% = 14%
Решите: Какова массовая доля сульфата аммония в растворе с молярной концентрацией 1.689 моль/л ( = 1.115 г/мл)?
19. Бромид и хлорид аммония массой 8.2 г растворили в воде и получили 50 мл раствора ( = 1.06 г/мл), который полностью вступил в реакцию с 49.8 мл 30%-го раствора нитрата свинца (II) ( = 1.33 г/мл). Вычислите молярные концентрации бромида и хлорида аммония в растворе. Какова массовая доля нитрата аммония в фильтрате?
Решение:
х моль 0.5х моль х моль 0.5х моль
2NH4Br + Pb(NO3)2 = 2NH4NO3 + PbBr2
2 моль 1 моль 2 моль 1 моль
98 г/моль 331 г/моль 80 г/моль 367 г/моль
у моль 0.5у моль у моль 0.5у моль
2NH4Cl + Pb(NO3)2 = 2NH4NO3 + PbCl2
2 моль 1 моль 2 моль 1 моль
53.5 г/моль 278 г/моль
 n(Pb(NO3)2)
= (49.8 мл · 0.3 · 1.33 г/мл) / 331 г/моль = 0.06 моль
n(Pb(NO3)2)
= (49.8 мл · 0.3 · 1.33 г/мл) / 331 г/моль = 0.06 моль
98x + 53.5y = 8.2 98x + 53.5y = 8.2 x = 0.04
0.5x + 0.5y = 0.06 (·107) 53.5x + 53.5y = 6.42 y = 0.08
n(NH4Br) = 0.04 моль
n(NH4Cl) = 0.08 моль
С(NH4Br) = 0.04 моль / 0.05 л = 0.8 моль/л
С(NH4Cl) = 0.08 моль / 0.05 л = 1.6 моль/л
m(р-ра после реакции) = 50·1.06 + 49.8·1.33 – (0.02·367 + 0.04·278) = 100.77 г
n(NH4NO3) = 0.04 + 0.08 = 0.12 моль
w%(NH4NO3) = (0.12 моль · 80 г/моль) / 100.77 г ·100% = 9.53%
Решите: Дигидрофосфат и гидрофосфат аммония массой 12.18 г растворили в воде и получили 50 мл раствора ( = 1.08 г/мл), который полностью вступил в реакцию с 54.2 мл 25%-го раствора гидроксида калия ( = 1.24 г/мл). Вычислите молярные концентрации дигидрофосфат и гидрофосфат аммония в растворе, объем выделившегося газа. Какова массовая доля фосфата калия в фильтрате?
20. В 68 г 5%-го раствора аммиака растворили 5.04 л аммиака (н.у.). К полученному раствору прилили 52.9 мл 30%-го раствора соляной кислоты ( = 1.15 г/мл). Каковы массовые доли веществ в растворе после реакции?
Решение:
n1(NH3) = (68 г · 0.05) / 17 г/моль = 0.2 моль
n2(NH3) = 5.04 л / 22.4 л/моль = 0.225 моль
n3(NH3) = 0.2 + 0.225 = 0.425 моль
0.425 моль 0.425 моль 0.425 моль
NH3 + HCl = NH4Cl
1 моль 1 моль 1 моль
17 г/моль 36.5 г/моль 53.5 г/моль
n(HCl) = (52.9 мл · 0.3 · 1.15 г/мл) / 36.5 г/моль = 0.5 моль
(0.425 / 1) < (0.5 / 1), HCl в избытке
m(р-ра) = (68 + 0.225 · 17 + 52.9 · 1.15) = 132.66 г
w%(NH4Cl) = (0.425 моль · 53.5 г/моль) / 132.66 г ·100% = 17.14%
w%(HCl) = ((0.5 – 0.425) моль · 36.5 г/моль) / 132.66 г ·100% = 2.1%
Решите: В 70 мл 6%-го раствора аммиака ( = 0.972 г/мл) растворили 3.584 л аммиака (н.у.). К полученному раствору прилили 121 мл 25%-го раствора бромоводорода ( = 1.206 г/мл). Каковы массовые доли веществ в растворе после реакции?
21. Аммиак объемом 6.72 л (н.у.) пропустили через 66 мл 20%-го раствора ортофосфорной кислоты ( = 1.115 г/мл). Вычислите массовую долю соли в растворе.
Решение:
NH3 + H3PO4 = NH4H2PO4 2NH3 + H3PO4 = (NH4)2HPO4
1 моль 1 моль 1 моль 2 моль 1 моль 1 моль
3NH3 + 2H3PO4 = NH4H2PO4 + (NH4)2HPO4
3 моль 2 моль 1 моль 1 моль
(n+2m) NH3 + (n+m)H3PO4 = nNH4H2PO4 + m(NH4)2HPO4
(n+2m) моль (n+m) моль n моль m моль
n(NH3) = 6.72 л / 22.4 л/моль = 0.3 моль
n(H3PO4) = (66 мл · 0.2 · 1.115 г/мл) / 98 г/моль = 0.15 моль
n(NH3) : n(H3PO4) = 0.3 : 0.15 = 2:1, (NH4)2HPO4
0.3 моль 0.15 моль 0.15 моль
2NH3 + H3PO4 = (NH4)2HPO4
2 моль 1 моль 1 моль
132 г/моль
m(р-ра) = (0.3 · 17 + 66 · 1.115) = г
w%((NH4)2HPO4) = (0.15 моль · 132 г/моль) / 78.69 г ·100% = 25.16%
Решите: 1. Аммиак объемом 10.08 л (н.у.) пропустили через 118.7 мл 20%-го раствора ортофосфорной кислоты ( = 1.115 г/мл). Вычислите массовые доли солей в растворе.
2. К 24.1 мл 15%-го раствора аммиака ( = 0.941 г/мл) добавили 87.9 мл 20%-го раствора ортофосфорной кислоты ( = 1.115 г/мл). Вычислите массовую долю соли в растворе.
3. К 36.9 мл 20%-го раствора аммиака ( = 0.922 г/мл) добавили 68.5 мл 25%-го раствора ортофосфорной кислоты ( = 1.145 г/мл). Вычислите массовую долю соли в растворе.
4. Сероводород объемом 4,48 л пропустили через 35,6 мл 10%-го раствора аммиака ( = 0,956 г/мл). Какая соль и в каком количестве образовалась в растворе?
5. Сероводород объемом 6,72 л пропустили через 45 мл 25%-го раствора аммиака ( = 0,907 г/мл). Какая соль образовалась в растворе?
6. Сероводород объемом 5,04 л пропустили через 24,9 мл 20%-го раствора аммиака ( = 0,922 г/мл). Какие соли и в каком количестве образовались в растворе?
7. Какой максимальный объем оксида серы (IV) вступит в реакцию с 53,4 мл 10%-го раствора аммиака ( = 0,956 г/мл).
8. Какой максимальный объем 20%-го раствора аммиака ( = 0,922 г/мл) вступит в реакцию с 5,6 л оксида серы (IV)?
9. Оксид серы (IV) объемом 7,64 л пропустили через 41,5 мл 20%-го раствора аммиака ( = 0,922 г/мл). Какие вещевства и в каком количестве образовались в растворе?
10. Какой максимальный объем аммиака вступит в реакцию с 53,8 мл 20%-го раствора серной кислоты ( = 1,139 г/мл)? Какова массовая доля соли в растворе?
11. Какой максимальный объем 20%-го раствора серной кислоты ( = 1,139 г/мл) вступит в реакцию с 44,5 мл 10%-го раствора аммиака ( = 0,956 г/мл)?
12. Оксид углерода (IV) объемом 3,36 л пропустили через 26,7 мл 10%-го раствора аммиака ( = 0,956 г/мл). Какая соль и в каком количестве образовалась в растворе?
13. Оксид углерода (IV) объемом 5,04 л пропустили через 32,6 мл 15%-го раствора аммиака ( = 0,939 г/мл). Какие вещества и в каком количестве образовалась в растворе?
14. Какая максимальная масса оксида фосфора (V) вступит в реакцию с 53,4 мл 10%-го раствора аммиака ( = 0,956 г/мл). Какая соль и в каком количестве образовалась в растворе?
15. Оксид фосфора (V) массой 14,2 г поместили в 38,7 мл 14%-го раствора аммиака ( = 0,942 г/мл). Какие вещества и в каком количестве образовалась в растворе?
16. . Какой максимальный объем газообразного аммиака (н.у.) вступит в реакцию со 107.6 мл 20%-го раствора серной кислоты ( = 1.139 г/мл)? Какова массовая доля соли в растворе после реакции?
17. Какой максимальный объем 20%-го раствора селеновой кислоты ( = 1.164 г/мл) вступит в реакцию с 5.04 л аммиака? Какова массовая доля соли в растворе после реакции?
18. Какой максимальный объем 6,7%-го раствора аммиака ( = 0,970 г/мл) вступит в реакцию с 15 г оксида хрома (VI)? Какова массовая доля соли в растворе?
19. Оксид хрома (VI) массой 10 г вступит в реакцию с 43,4 мл 4%-го раствора аммиака ( = 0,98 г/мл). Какова массовая доля соли в растворе?
20. Хлорид фосфора (V) массой 10,425 г полностью прореагировал с 66,1 мл 8%-го раствора аммиака ( = 0,965 г/мл). Каковы массовые доли соли в растворе?
21. Хлорид фосфора (V) массой 12,51 г полностью прореагировал с 74,7 мл 10%-го раствора аммиака ( = 0,956 г/мл). Каковы массовые доли соли в растворе?
22. Смесь хлорида, сульфита и карбоната аммония обработали концентрированной соляной кислотой. При этом выделилось 1.68 л смеси газов с относительной плотностью по воздуху 1.7931035. Такая же навеска смеси солей полностью реагирует при нагревании с 34.5 мл 20%-го раствора гидроксида натрия ( = 1.219 г/мл). Вычислите массовые доли солей в исходной смеси.
Решение:
NH4Cl + HCl
х моль х моль
(NH4)2SO3 + 2HCl = 2NH4Cl + SO2 + H2O
1 моль 1 моль
116 г/моль 64 г/моль
у моль у моль
(NH4)2СO3 + 2HCl = 2NH4Cl + СO2 + H2O
1 моль 1 моль
96 г/моль 44 г/мол
n(газов) = 1.68 л / 22.4 л/моль = 0.075 моль
M(газов) = 1.7931035 · 29 г/моль = 52 г/моль
 m(газов)
= 0.075 моль · 52 г/моль = 3.9 г
m(газов)
= 0.075 моль · 52 г/моль = 3.9 г
х + у = 0.075 64х + 64у = 4.8 x = 0.03
64х + 44у = 3.9 64х + 44у = 3.9 y = 0.045
n((NH4)2SO3) = 0.03 моль
n((NH4)2СO3) = 0.045 моль
n(NaOH) = (34.5 мл · 0.2 · 1.219 г/мл) / 40 г/моль = 0.21 моль
0.03 моль 0.06 моль
(NH4)2SO3 + 2NaOH = 2NH3 + Na2SO3 + 2H2O
1 моль 2 моль
0.045 моль 0.09 моль
(NH4)2СO3 + 2NaOH = 2NH3 + Na2СO3 + 2H2O
1 моль 2 моль
n(NaOH/ NH4Cl) = 0.21 – (0.06 + 0.09) = 0.06 моль
0.06 моль 0.06 моль
NH4Cl + NaOH = NH3 + NaCl + H2O
1 моль 1моль
m(NH4Cl) = 0.06 моль · 53.5 г/моль = 3.21 г
m((NH4)2SO3) = 0.03 моль · 116 г/моль = 3.48 г
m((NH4)2СO3) = 0.045 моль · 96 г/моль = 4.32 г
m(смеси) = 3.21 + 3.48 + 4.32 = 11.01 г
w%(NH4Cl) = 3.21 г / 11.01 г ·100% = 29.16%
w%((NH4)2SO3) = 3.48 г / 11.01 г ·100% = 31.61%
w%((NH4)2СO3) = 4.32 г / 11.01 г ·100% = 39.24%
Решите: Смесь бромида, сульфида и карбоната аммония обработали концентрированной соляной кислотой. При этом выделилось 2.24 л смеси газов с относительной плотностью по гелию 9.5. Такая же навеска смеси солей полностью реагирует при нагревании с 45.2 мл 25%-го раствора гидроксида калия ( = 1.24 г/мл). Вычислите массовые доли солей в исходной смеси.
23. Какой объем 16%-го раствора хлорида алюминия ( = 1.149 г/мл) вступит в реакцию с 54.4 г 15%-го раствора сульфида аммония?
Решение:
0.08 моль 0.12 моль
2AlCl3 + 3(NH4)2S + 6H2O = 2 Al(OH)3 + 3H2S + 6NH4Cl
2 моль 3 моль
133.5 г/моль 68 г/моль
n((NH4)2S) = (54.4 г · 0.15) / 68 г/моль = 0.12 моль
V(р-ра AlCl3) = (0.08 моль · 133.5 г/моль) / (0.16 · 1.149 г/мл) = 58.1 мл
Решите: Какая масса 14%-го раствора сульфида аммония вступит в реакцию с 78.4 г 20%-го раствора сульфата хрома (III)?
24. Сколько по массе 15%-го раствора сульфида аммония вступит в реакцию с 55 мл 20%-го раствора хлорида железа (III) ( = 1.182 г/мл)?
Решение:
0.08 моль 0.12 моль
2FeCl3 + 3(NH4)2S = 2FeS + S + 6NH4Cl
2 моль 3 моль
162.5 г/моль 68 г/моль
n(FeCl3) = (55 мл · 0.2 · 1.182 г/мл) / 162.5 г/моль = 0.08 моль
m(р-ра (NH4)2S) = (0.12 моль · 68 г/моль) / 0.15 = 54.4 г
Решите: Сколько по массе 20%-го раствора сульфида аммония вступит в реакцию с 51.6 мл 25%-го раствора сульфата железа (III) ( = 1.241 г/мл)?
25. К 8.56 г кристаллического хлорида аммония прилили 9.6 мл 90%-го раствора серной кислоты ( = 1.815 г/мл). Какой объем хлороводорода образовался при этом?
Решение:
n(NH4Cl) = 8.56 г / 53.5 г/моль = 0.16 моль
n(H2SO4) = (9.6 мл · 0.9 · 1.815 г/мл) / 98 г/моль = 0.16 моль
n(NH4Cl) : n(H2SO4) = 0.16 : 0.16 = 1 : 1
0.16 моль 0.16 моль 0.16 моль
NH4Cl + H2SO4 = NH4HSO4 + HCl
1 моль 1 моль 1 моль
22.4 л/моль
V(HCl) = 0.16 моль · 22.4 л/моль = 3.584 л
Решите: К 14.5 г кристаллического сульфита аммония прилили 15 мл 96%-го раствора серной кислоты ( = 1.84 г/мл). Какой объем газа образовался при этом?
26. Какой объем азота выделится при взаимодействии 10.2 г нитрита калия с 40.5 мл 20%-го раствора хлорида аммония ( = 1.057 г/мл) при нагревании? Каковы массовые доли веществ в растворе после реакции?
Решение:
0.12 моль 0.12 моль 0.12 моль 0.12 моль
KNO2 + NH4Cl = N2 + KCl + 2H2O
1 моль 1 моль 1 моль 1 моль
85 г/моль 53.5 г/моль 28 г/моль 74.5 г/моль
n(KNO2) = 10.2 г / 85 г/моль = 0.12 моль
n(NH4Cl) = (40.5 мл · 0.2 · 1.057 г/мл) / 53.5 г/моль = 0.16 моль
(0.12/1) < (0.16/1), NH4Cl в избытке
V(N2) = 0.12 моль · 22.4 л/моль = 2.688 л
m(р-ра) = (10.2 + 40.5 · 1.057) г – 0.12 моль · 28 г/моль = 49.65 г
w%(KCl) = (0.12 моль · 74.5 г/моль) / 49.65 г ·100% = 18%
w%(NH4Cl) = ((0.16 – 0.12) моль · 53.5 г/моль) / 49.65 г ·100% = 4.31%
Решите: Какой объем азота выделится при взаимодействии 19.8 г нитрита кальция с 66 мл 30%-го раствора хлорида аммония ( = 1.082 г/мл) при нагревании? Каковы массовые доли веществ в растворе после реакции?
27. Установите молекулярную формулу вещества:
|
w%(N) |
w%(H) |
w%(O) |
w%(Cl) |
Mr |
1 |
82.353 |
17.647 |
|
|
|
2 |
97.674 |
2.326 |
|
|
|
3 |
87.500 |
12.500 |
|
|
32 |
4 |
42.(424) |
9.(09) |
48.(484) |
|
|
5 |
26.168 |
7.477 |
|
66.355 |
|
6 |
21.184 |
3.883 |
|
68.932 |
|
7 |
40.288 |
7.194 |
|
51.079 |
|
8 |
26.(6) |
5.714 |
|
67.619 |
105 |
9 |
20.144 |
5.755 |
23.022 |
51.079 |
|
10 |
21.374 |
|
24.427 |
54.198 |
|
11 |
11.618 |
|
|
88.382 |
|
12 |
40.000 |
14.286 |
45.714 |
|
|
13 |
56.000 |
12.000 |
32.000 |
|
|
14 |
27.451 |
9.804 |
62.745 |
|
|
15 |
17.178 |
|
39.264 |
43.558 |
|
16 |
29.787 |
2.128 |
68.085 |
|
|
17 |
22.(2) |
1.587 |
76.190 |
|
|
18 |
17.722 |
1.266 |
81.013 |
|
|
19 |
45.161 |
3.226 |
51.613 |
|
62 |
20 |
20.144 |
5.755 |
23.022 |
51.079 |
|
21 |
13.793 |
3.941 |
47.291 |
34.975 |
|
22 |
11.915 |
3.404 |
54.468 |
30.213 |
|
23 |
35.000 |
5.000 |
60.000 |
|
|
24 |
43.750 |
6.250 |
50.000 |
|
64 |
25 |
93.(3) |
6.(6) |
|
|
60 |
26 |
17.284 |
3.704 |
79.012 |
|
|
27 |
45.161 |
3.226 |
51.613 |
|
62 |
28 |
9.622 |
|
65.979 |
24.399 |
|
29 |
10.811 |
|
61.776 |
27.413 |
|
30 |
63.(63) |
|
36.(36) |
|
|
31 |
46.(6) |
|
53.(3) |
|
|
32 |
36.842 |
|
63.158 |
|
|
33 |
30.435 |
|
69.565 |
|
|
34 |
25.(925) |
|
74.(074) |
|
|
35 |
30.435 |
|
69.565 |
|
|
28. Какой объем NO образуется при взаимодействии 4.8 г меди с 20%-м раствором азотной кислоты ( = 1.115 г/мл)? Какой объем кислоты вступит в реакцию? Какова массовая доля соли в растворе?
Решение:
0.075 моль 0.2 моль 0.075 моль 0.05 моль
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
3 моль 8 моль 3 моль 2 моль 4 моль
64 г/моль 63 г/моль 188 г/моль 30 г/моль
n(Cu) = 4.8 г / 64 г/моль = 0.075 моль
V(р-ра HNO3) = (0.2 моль · 63 г/моль) / (0.2 · 1.115 г/мл) = 56.5 мл
V(NO) = 0.05 моль · 22.4 л/моль = 1.12 л
m(р-ра) = (4.8 + 56.5·1.115) г – (0.05·30) г = 66.3 г
w%(Cu(NO3)2) = (0.075 моль · 188 г/моль) / 66.3 г ·100% = 21.27%
Решите: Какой объем NO образуется при взаимодействии 4.48 г железа с 15%-м раствором азотной кислоты ( = 1.085 г/мл)? Какой объем кислоты вступит в реакцию? Какова массовая доля соли в растворе?
29. Какой объем воздуха (%(O2) = 21%) необходим для каталитического окисления 1 м3 аммиака (н.у.)?
Решение:
1 м3 1 м3
4NH3 + 5O2 = 4NO + 6H2O (Pt)
4 моль 5 моль
Объемы реагирующих и образующихся газов относятся как коэффициенты в уравнении реакции.
Решите: Какой объем воздуха (%(O2) = 21%) необходим для окисления 1 м3 оксида азота (II) (н.у.)?
30. Сколько по массе меди вступит в реакцию с 30.8 мл 50%-го раствора азотной кислоты ( = 1.31 г/мл)? Какой объем оксида азота (IV) выделится в реакции? Какова массовая доля соли в растворе?
Решение:
0.08 моль 0.32 моль 0.08 моль 0.16 моль
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
1 моль 4 моль 1 моль 2 моль 2 моль
64 г/моль 63 г/моль 188 г/моль 46 г/моль
n(HNO3) = (30.8 мл · 0.5 · 1.31 г/мл) / 63 г/моль = 0.32 моль
m(Cu) = 0.08 моль · 64 г/моль = 5.12 г
V(NO2) = 0.16 моль · 22.4 л/моль = 3.584 л
m(р-ра) = (5.12 + 30.8·1.31) г – (0.16·46) г = 38.11 г
w%(Cu(NO3)2) = (0.08 моль · 188 г/моль) / 38.11 г ·100% = 39.46%
Решите: Сколько по массе железа вступит в реакцию с 34.6 мл 60%-го раствора азотной кислоты ( = 1.36 г/мл)? Какой объем оксида азота (IV) выделится в реакции? Какова массовая доля соли в растворе?
31. Какой объем NO2 вступит в реакцию с 7.68 г меди при 500С (р = 101500 Па)? Сколько по массе оксида меди (II) образуется при этом?
Решение:
0.06 моль 0.12 моль 0.12 моль
2NO2 + 4Cu = N2 + 4CuO
2 моль 4 моль 4 моль
64 г/моль 80 г/моль
n(Cu) = 7.68 г / 64 г/моль = 0.12 моль
V(NO2) = (0.06 · 8.314 · 773) / 101500 = 0.003799 м3 (3.799 л)
m(CuO) = 0.12 моль · 80 г/моль = 9.6 г
Решите: Какой объем N2O вступит в реакцию с 5.12 г меди при 500С (р = 102000 Па)? Сколько по массе оксида меди (I) образуется при этом?
32. Какой объем оксида азота (IV) (н.у.) вступит в реакцию с 63.2 мл 25%-го раствора иодоводородной кислоты ( = 1.216 г/мл)?
Решение:
0.075 моль 0.15 моль
NO2 + 2HI = NO + I2 + H2O
1 моль 2 моль
22.4 л/моль 128 г/моль
n(HI) = (63.2 мл · 0.25 · 1.216 г/мл) / 128 г/моль = 0.15 моль
V(NO2) = 0.075 моль · 22.4 л/моль = 1.68 л
Решите: Какой объем оксида азота (IV) (н.у.) вступит в реакцию с 400 мл раствора перманганата калия ( = 1.04 г/мл) концентрацией 0.3 моль/л? Найти массовые доли веществ в растворе после реакции.
33. Какой объем оксида азота (IV) (н.у.) вступит в реакцию с 68.7 мл 15%-го раствора гидроксида натрия ( = 1.165 г/мл)? Найти массовые доли веществ в растворе после реакции.
Решение:
0.3 моль 0.3 моль 0.15 моль 0.15 моль
2 NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2 моль 2 моль 1 моль 1 моль
46 г/моль 40 г/моль 69 г/моль 85 г/моль
n(NaOH) = (68.7 мл · 0.15 · 1.165 г/мл) / 40 г/моль = 0.3 моль
m(р-ра) = 0.3·46 + 68.7·1.165 = 93.8355 г
w%(NaNO2) = (0.15 моль · 69 г/моль) / 93.8355 г ·100% = 11%
w%(NaNO3) = (0.15 моль · 85 г/моль) / 93.8355 г ·100% = 13.6%
Решите: Какой объем оксида азота (IV) и какой объем кислорода (н.у.) вступит в реакцию с 47.1 мл 20%-го раствора гидроксида калия ( = 1.19 г/мл)? Найти массовые доли веществ в растворе после реакции.
34. Какие объемы оксида азота (II) и оксида азота (IV) вступили в реакцию с 70.2 мл 12.5%-го раствора NaOH ( = 1.14 г/мл) при охлаждении? Какова массовая доля нитрита натрия в растворе?
Решение:
0.125 моль 0.125 моль 0.25 моль 0.25 моль
NO + NO2 + 2NaOH = 2NaNO2 + H2O
1 моль 1 моль 2 моль 2 моль
30 г/моль 46 г/моль 40 г/моль 69 г/моль
n(NaOH) = (70.2 мл · 0.125 · 1.14 г/мл) / 40 г/моль = 0.25 моль
V(NO) = V(NO2) = 0.125 моль · 22.4 л/моль = 2.8 л
m(р-ра) = 0.125·30 + 0.125·46 + 70.2·1.14 = 89.528 г
w%(NaNO2) = (0.25 моль · 69 г/моль) / 89.528 г ·100% = 19.27%
Решите: Какие объемы оксида азота (II) и оксида азота (IV) вступили в реакцию с 169.9 мл 16%-го раствора карбоната натрия ( = 1.17 г/мл) при охлаждении? Какова массовая доля нитрита натрия в растворе?
35. Какие объемы оксида азота (IV) и кислорода необходимо растворить в 100 мл воды, чтобы получить 20%-ный раствор азотной кислоты?
Решение:
4х моль х моль 4х моль
4NO2 + O2 + 2H2O = 4HNO3
4 моль 1 моль 4 моль
46 г/моль 32 г/моль 63 г/моль
m(р-ра HNO3) = (4х·46 + 32х + 100) = (216х + 100) г
0.2 = 4х·63 / (216х + 100); x =
V(O2) = 0.095785 моль · 22.4 л/моль = 2.146 л
V(NO2) = 4·2.146 л = 8.584 л
Решите: Какова массовая доля азотной кислоты, полученной при растворении 84 л смеси оксида азота (IV) и кислорода (молярное соотношение 4:1) в 500 мл 10%-го раствора азотной кислоты ( = 1.06 г/мл)?
36. Оксид азота (N2On) массой 2.64 г полностью реагирует при нагревании с 1.44 г магния. Определите формулу оксида азота.
Решение:
0.06/n моль 0.06 моль
N2On + nMg = N2 + nMgO
1 моль n моль
(28+16n) 24 г/моль
г/моль
n(Mg) = 1.44 г / 24 г/моль = 0.06 моль
0.06/n = 2.64 / (28+16n); n = 1, N2O – оксид азота (I), «веселящий газ»
Решите: Оксид азота (N2On) массой 2.76 г реагирует при нагревании с магнием с выделением 0.672 л азота. Определите формулу оксида азота. Сколько по массе оксида магния образовалось при этом?
37. Аммиак объемом 6.72 л (н.у.) полностью реагирует с 13.5 г оксида азота (N2On) при нагревании. Определите формулу оксида азота.
Решение:
0.3 моль 0.45/n моль
4nNH3 + 6N2On = (2n+6)N2 + 6nH2O
4n моль 6 моль
(28+16n) г/моль
n(NH3) = 6.72 л / 22.4 л/моль = 0.3 моль
0.45/n = 13.5 / (28+16n); n = 2, NO – оксид азота (II)
4NH3 + 6NO = 5N2 + 6H2O
Решите: Аммиак объемом 3.584 л (н.у.) полностью реагирует с 10.56 г оксида азота (N2On) при нагревании. Определите формулу оксида азота.
38. Металл массой 5.76 г полностью реагирует при нагревании с азотом. Полученный нитрид металла Me3Nn полностью реагирует с 83.1 мл 25%-го раствора соляной кислоты ( = 1.125 г/мл). Определите металл, массовые доли солей в растворе.
Решение:
0.48/n моль
6Me + nN2 = 2Me3Nn
6 моль 2 моль
х г/моль
0.16/n моль 0.64 моль
Me3Nn + 4nHCl = 3MeCln + nNH4Cl
1 моль 4n моль
36.5 г/моль
n(HCl) = (83.1 мл · 0.25 · 1.125 г/мл) / 36.5 г/моль = 0.64 моль
(0.48/n) = (5.76/x); x = 12n
n = 1 x = 12 –
n = 2 x = 24 – Mg, Mg3N2
3Mg + N2 = Mg3N2
0.08 моль 0.64 моль 0.24 моль 0.16 моль
Mg3N2 + 8HCl = 3MgCl2 + 2NH4Cl
1 моль 8 моль 3 моль 2 моль
100 г/моль 95 г/моль 53.5 г/моль
m(р-ра ) = 0.08·100 + 83.1·1.125 = 101.4875 г
w%(MgCl2) = (0.24 моль · 95 г/моль) / 101.4875 г ·100% = 22.47%
w%(NH4Cl) = (0.16 моль · 53.5 г/моль) / 101.4875 г ·100% = 8.43%
Решите: Металл массой 2,52 г полностью реагирует при нагревании с азотом. Полученный нитрид металла Me3Nn полностью реагирует с 85.5 мл 30%-го раствора азотной кислоты ( = 1.18 г/мл). Определите металл, массовые доли солей в растворе.
39. При взаимодействии оксида азота с раскаленной медью образовалось 3 г оксида меди (II) и выделилось 420 мл азота (н.у.). Определите формулу оксида.
Решение:
N2On + nCu = N2 + nCuO
1 моль n моль 1 моль n моль
80 г/моль
n(CuO) = 3 г / 80 г/моль = 0.0375 моль = n(Cu)
n(N2) = 0.42 л / 22.4 л/моль = 0.01875 моль
(1/n) = (0.01875 / 0.0375); n = 2, NO
2NO + 2Cu = N2 + 2CuO
Решите: При взаимодействии оксида азота с раскаленной медью образовалось 1.92 г оксида меди (II) и выделилось 134.4 мл азота (н.у.). Определите формулу оксида.
40. Для термического разложения 15.66 г нитрата металла (II) необходимо 30.48 кДж теплоты. Определите металл.
Me(NO3)2 = MeO + 2NO2 + 0.5O2 – 508 кДж
Решение:
Me(NO3)2 = MeO + 2NO2 + 0.5O2 – 508 кДж
1 моль
(x + 124) г/моль
n(Me(NO3)2) = (–30.48 кДж) / (–508 кДж/моль) = 0.06 моль
x + 124 = 15.66/0.06; x = 137, Ba, Ba(NO3)2
Решите: Для термического разложения 15.12 г нитрата металла (II) необходимо 16.88 кДж теплоты. Определите металл.
Me(NO3)2 = MeO + 2NO2 + 0.5O2 – 211 кДж
41. 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O + 350 кДж
Сколько теплоты выделится, если в реакцию вступило 7.2 г меди?
Решение:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
3 моль
64 г/моль
n(Cu) = 7.2 г / 64 г/моль = 0.1125 моль
3 моль Cu – 350 кДж
0.1125 моль Cu – x кДж
Q = (0.1125 моль·350 кДж) / 3 моль = 13.125 кДж
Решите: 5Zn + 12HNO3 = 5Zn(NO3)2 + N2 + 6H2O + 2072 кДж
Сколько теплоты выделится, если в реакцию вступило 5,2 г цинка?
42. При образовании аммиака согласно ТХУ N2 + 3H2 = 2NH3 + 92 кДж выделилось 115 кДж теплоты. Какой объем водорода (н.у.) вступил в реакцию?
Решение:
N2 + 3H2 = 2NH3 + 92 кДж
3 моль
3 моль H2 – 92 кДж
х моль H2 – 115 кДж
n(H2) = (3 моль·115 кДж) / 92 кДж = 3.75 моль
V(H2) = 3.75 моль · 22.4 л/моль = 84 л
Решите: При образовании аммиака согласно ТХУ 3Mg + N2 = Mg3N2 + 460 кДж выделилось 55.2 кДж теплоты. Сколько по массе магния вступило в реакцию?
43. В результате реакции, ТХУ которой 4NH3 (г) + 5O2 (г) = 4NO(г) + 6H2O(г) + 902 кДж выделилось 541.2 кДж теплоты. Определите объем образовавшегося оксида азота (II).
Решение:
4NH3 (г) + 5O2 (г) = 4NO(г) + 6H2O(г) + 902 кДж
4 моль
4 моль NO – 902 кДж
х моль NO – 541.2 кДж
n(NO) = (4 моль·541.2 кДж) / 902 кДж = 2.4 моль
V(NO) = 2.4 моль · 22.4 л/моль = 53.76 л
Решите: В результате реакции, ТХУ которой 4NH3 (г) + 3O2 (г) = 2N2(г) + 6H2O(г) + 1268 кДж выделилось 380.4 кДж теплоты. Определите объем вступившего в реакцию кислорода.
44. Железо массой 4.48 г реагирует с очень разбавленной азотной кислотой. Какой объем 25%-го раствора гидроксида калия ( = 1.24 г/мл) вступит в реакцию с полученным раствором при нагревании?
Решение:
0.08 моль 0.08 моль 0.02 моль
4Fe + 10HNO3 = 4Fe(NO3)2 + NH4NO3 + 3H2O
4 моль 4 моль 1 моль
56 г/моль
n(Fe) = 4.48 г / 56 г/моль = 0.08 моль
0.08 моль 0.16 моль
Fe(NO3)2 + 2KOH = Fe(OH)2 + 2KNO3
1 моль 2 моль
56 г/моль
0.02 моль 0.02 моль
NH4NO3 + KOH = NH3 + KNO3 + H2O
1 моль 1 моль
V(р-ра KOH) = ((0.16+0.02) моль · 56 г/моль) / (0.25 · 1.24 г/мл) = 32.5 мл
Решите: Алюминий массой 6.48 г реагирует с очень разбавленной азотной кислотой. Какой объем 25%-го раствора гидроксида натрия ( = 1.28 г/мл) вступит в реакцию с полученным раствором при нагревании?
45. Массовые доли азота в соединении Me(NO3)n равна – 17,355%. Выведите молекулярную формулу нитрата.
46. Массовые доли кислорода в соединении Me(NO3)n равна – 53,(3)%. Выведите молекулярную формулу нитрата.
47. Массовые доли металла в соединении Me(NO3)n равна – 21,849%. Выведите молекулярную формулу нитрата.
48. Выведите формулу соединения, имеющего состав: металла – 27,059%; азота – 16,471%; кислорода – 56,471%.
49. Выведите формулу соединения, имеющего состав: металла – 24,390%; азота – 17,073%; кислорода – 58,537%.
50. При разложении 17,04 г нитрата металла Me(NO3)n образовалось 4,08 г оксида металла Me2On. Определите формулу нитрата.
51. Массовая доля металла в кристаллогидрате Me(NO3)n.4H2O равна 36,(36)%. Выведите формулу кристаллогидрата.
52. Массовая доля азота в кристаллогидрате Cu(NO3)2.nH2O равна 11,57%. Выведите формулу кристаллогидрата.
53. Массовая доля кислорода в кристаллогидрате Al(NO3)3.nH2O равна 76,8%. Выведите формулу кристаллогидрата.
54. Какой объем 20%-го раствора азотной кислоты (ρ = 1,115 г/мл) вступит в реакцию с 7,68 г меди? Какой объем оксида азота (II) выделится в ходе реакции? Какова массовая доля нитрата меди (II) в растворе?
55. При взаимодействии раствора, содержащего 12,3 г Me(NOn)2, с раствором ортофосфата натрия образовалось 7,75 г осадка и 12,75 г NaNOn. Определите формулу Me(NOn)2.
56. Какой объем 50%-го раствора азотной кислоты (ρ = 1,31 г/мл) вступит в реакцию с 5,12 г меди? Какой объем оксида азота (IV) выделится в ходе реакции? Какова массовая доля нитрата меди (II) в растворе?
57. К 8,64 г оксида меди (I) прилили 95,2 мл 18%-го раствора азотной кислоты (ρ = 1,103 г/мл), в ходе реакции выделилось 0,896 л оксида азота (II). Вычислите массовые доли веществ в растворе.
58. При взаимодействии 8,16 г смеси меди и оксида меди (I) с 55%-го раствора азотной кислоты (ρ = 1,33 г/мл) выделилось 4,032 л оксида азота (IV). Какой объем кислоты вступил в реакцию? Какова массовая доля соли в растворе?
59. Какой объем 20%-го раствора гидроксида натрия (ρ = 1,22 г/мл) необходимо для нейтрализации 44 мл 25%-го раствора азотной кислоты (ρ = 1,146 г/мл)? Какова массовая доля соли в растворе?
60. Гидроксид металла Me(ОН)n массой 8,7 г полностью реагирует с 84,8 мл 20%-го раствора азотной кислоты (ρ = 1,115 г/мл). Определите формулу гидроксида металла, вычислите массовую долю соли в растворе.
61. Какой объем 20%-го раствора азотной кислоты (ρ = 1,115 г/мл) вступит в реакцию с 5,4 г оксида железа (II)? Какой объем оксида азота (II) выделится в ходе реакции? Какова массовая доля соли в растворе?
62. Сколько по массе оксида дижелеза (III) - железа (II) вступит в реакцию с 30 мл 60%-го раствора азотной кислоты
(ρ = 1,365 г/мл)? Какой объем оксида азота (IV) выделится в ходе реакции?
63. С 10 г карбоната металла (II) полностью реагирует с 62 мл 15%-го раствора азотной кислоты (ρ = 1,085 г/мл). Определите молекулярную формулу карбоната, вычислите массовую долю соли в растворе.
64. Какой объем 12%-го раствора азотной кислоты (ρ = 1,065 г/мл) вступит в реакцию с 25,4 г карбоната гидроксосвинца (II)? Какова массовая доля соли в растворе?
65. Какой объем 10%-го раствора азотной кислоты (ρ = 1,055 г/мл) вступит в реакцию с 11,85 г оксида марганца (II) при нагревании? Какова массовая доля нитрата марганца в фильтрате? Какова масса осадка оксида марганца (IV)?
66. Гидрид калия массой 8 г растворили в 60 мл воды. Какой объем 30%-го раствора азотной кислоты (ρ = 1,145 г/мл) вступит в реакцию с полученным раствором? Какова массовая доля соли в растворе?
67. Какой объем 20%-го раствора азотной кислоты (ρ = 1,115 г/мл) вступит в реакцию с 83 мл 25%-го раствора хромата натрия (ρ = 1,25 г/мл)? Каковы массовые доли веществ в растворе?
68. Какой объем газообразного аммиака (н.у.) вступит в реакцию с 42,4 мл 20%-го раствора азотной кислоты (ρ = 1,115 г/мл)? Какова массовая доля соли в растворе?
69. Какой объем 15%-го раствора аммиака (ρ = 0,901 г/мл) вступит в реакцию с 52,8 мл 25%-го раствора азотной кислоты
(ρ = 1,146 г/мл)? Какова массовая доля соли в растворе?
70. Какой объем 30%-го раствора азотной кислоты (ρ = 1,18 г/мл) вступит в реакцию с 11,84 г нитрида кальция? Каковы массовые доли веществ в растворе?
71. По термохимическому уравнению реакции КОН + HNO3 = KNO3 + H2O + 57 кДж рассчитайте объемы вступивших в реакцию растворов гидроксида калия (20%; ρ = 1,19 г/мл) и азотной кислоты (25%; ρ = 1,145 г/мл), если при их взаимодействии выделилось 4,56кДж теплоты?
72. Какие объемы 65%-го раствора азотной кислоты (ρ = 1,4 г/мл) и воды необходимы для приготовления 1 л 20%-го раствора азотной кислоты (ρ = 1,115 г/мл)?
73. Тетрагидрат нитрата бериллия массой 41 г растворили в 92 мл воды и получили раствор объёмом 117,300 мл. Определите массовую долю нитрата бериллия в растворе, его молярную концентрацию, плотность раствора.
74. К 25,2 мл 20 %-ного раствора бромида кальция (плотность 1,192 г/мл) прилили 28,5 мл 20 %-ного раствора нитрата серебра (I) (плотность 1,194 г/мл). Определите массовые доли веществ (%) в растворе после реакции.
75. В какой массе нитрата кальция содержится 3,1605·1023 атомов азота?
76. Для полного разложения смеси нитратов магния и бария необходимо 40,76 кДж теплоты. Полученные оксиды полностью реагируют с 50,7 мл 16%-ого раствора соляной кислоты (ρ = 1,08 г/мл). Вычислите массовые доли нитратов в исходной смеси и массовые доли хлоридов в растворе. Теплоты разложения нитратов магния и бария соответственно равны -256 и -507 кДж/моль.
77. При окислении кислородом смеси магния и кальция выделяется 110 кДж теплоты. Продукты окисления полностью реагируют с 113,1 мл 20%-ого раствора азотной кислоты (ρ = 1,115 г/мл). Вычислите массовые доли нитратов магния и кальция в растворе. Теплоты образования оксидов магния и кальция соответственно равны 600 и 635 кДж/моль.
78. Для полного разложения некоторого количества нитрата магния необходимо 30,72 кДж теплоты. Полученный оксид растворен в 64,5 мл 20%-ого раствора серной кислоты (ρ = 1,14 г/мл). Рассчитайте массовые доли веществ в полученном растворе. Теплота разложения нитрата магния равна -256 кДж/моль.
79. Для полного разложения 15,66 г нитрата металла необходимо 30,42 кДж теплоты. Теплота разложения нитрата металла равна -507 кДж/моль. Определите формулу нитрата металла.
80. Оксид металла Me2On массой 4,2 г полностью реагирует с 42,4 мл 20%-ого раствора азотной кислоты (ρ = 1,115 г/мл). Определите молекулярную формулу оксида.
81. При разложении 15,66 Me(NO3)n образовалось 9,18 г Me2On, оксид азота (IV) и кислород. Определите формулу нитрата.
82. Смесь нитрида Me3N2 и оксида металла MeO массой 9 г (υ(Me3N2) : υ(MeO) = 1 : 2) полностью реагирует с 99,6 мл 20%-ого раствора соляной кислоты (ρ = 1,1 г/мл). Определите металл, вычислите массовые доли веществ в растворе.
83. Смесь нитрида Me3N2 и оксида металла MeO массой 11,16 г (υ(Me3N2) : υ(MeO) = 1 : 4) полностью реагирует с 135,61 мл 20%-ого раствора азотной кислоты (ρ = 1,115 г/мл). Определите формулу вещества.
84. Смесь нитрида Me3N2 и карбоната металла MeCO3 массой 16,08 г (υ(Me3N2) : υ(MeCO3) = 1 : 2) полностью реагирует с 119,5 мл 20%-ого раствора соляной кислоты (ρ = 1,1 г/мл). Определите формулу вещества.
85. Смесь нитрида Me3N2 и карбоната металла MeCO3 массой 9,92 г (υ(Me3N2) : υ(MeCO3) = 1 : 1) полностью реагирует с 107,5 мл 25%-ого раствора бромоводородной кислоты (ρ = 1,206 г/мл). Определите формулу вещества.
86. 8 г свежеосажденного карбоната металла (II) полностью реагирует с 40,54 мл 20%-ого раствора хлорида аммония (ρ = 1,056 г/мл) при нагревании с образованием MeCl2, NH3, CO2 и вода.
87. Какой объем 20%-ого раствора азотной кислоты (ρ = 1,115 г/мл) вступит в реакцию с 7,5 г нитрида магния? Каковы массовые доли веществ в растворе после реакции?
88. Смесь оксида и нитрида магния массой 8 г полностью реагирует с 96,23 мл 20%-ого раствора соляной кислоты (ρ = 1,1 г/мл). Определите массовые доли веществ в исходной смеси и массовые доли солей в растворе после реакции.
89. К 54,96 г 20%-ого раствора нитрита бария прилили 58,9 г 22%-ого раствора бромида аммония (ρ = 1,135 г/мл). Реакцию провели при нагревании. Определите массовые доли веществ в растворе после реакции.
90. Сколько по массе гексагидрата нитрата магния и какой объем воды необходимы для приготовления 500 мл 18%-ого раствора нитрата магния (ρ = 1,145 г/мл)?
91. В 300 мл 10%-ого раствора нитрата магния (ρ = 1,076 г/мл) растворили 672 г гексагидрата нитрата магния и получили насыщенный при 20°С раствор нитрата магния. Определите массовую долю нитрата магния в насыщенном растворе, его растворимость.
92. Какой объем 8%-ого раствора нитрата магния (ρ = 1,06 г/мл) и сколько по массе гексагидрата нитрата магния необходимо взять для приготовления 750 мл 25%-ого раствора нитрата магния (ρ = 1, 21 г/мл)?
93. Газовая смесь, полученная при прокаливания 72,6 г смеси нитрата хрома (III) и карбоната кальция и оказавшая в 10,85 раз тяжелее гелия, пропущена через 137,5 мл 25%-ого раствора гидроксида натрия (ρ = 1,28 г/мл). Рассчитайте массовые доли веществ в полученном растворе.
94. Сколько по массе нитрата магния вступит в реакцию с 67,7 мл 24%-ого раствора сульфата аммония (ρ = 1,138 г/мл) при нагревании? Какова массовая доля сульфата магния в растворе? Какой объем азота (н.у.) выделится в ходе реакции?
95. Вычислите массовые доли веществ в растворе, полученном при взаимодействии 13,2 г нитрата кальция с 55 мл 22%-ого раствора хлорида аммония (ρ = 1,062 г/мл) при нагревании.
96. Какой объём 65% раствора HNO3 ( =1,4 г/мл) вступит в реакцию с 31,2 г смеси Cu2O, CuO, Cu (в молярном соотношении 1:2:5) при нагревании. Какой объём оксида азота (IV) при этом выделится?
97. Какие объёмы 20% раствора HNO3 ( =1,115 г/мл) и 80% раствора HNO3 ( =1,45 г/мл) необходимы для приготовления 750 мл 30% раствора HNO3 ( =1,18 г/мл)?
98. При прокаливании смеси нитратов меди (II) и железа (III) массой 10,75 г образовалось 4 г твёрдого остатка. Определите массовые доли нитратов в исходной смеси.
99. Какой объём N2O вступит в реакцию с 35 мл раствора KMnO4(0,14 моль/л) в присутствии серной кислоты? Какой объём оксида азота (II) при этом образуется?
100. Имеется смесь NO2 и O2 с относительной плотностью по водороду 21,6. С каким объёмом 30% раствора NaOH ( =1,328 г/мл) вступит в реакцию смесь NO2 и O2 объёмом 20,16 л?
101.Смесь меди и железа массой 7,76 г реагирует при нагревании с 70% азотной кислотой ( =1,413 г/мл) с выделением 7,392 л оксида азота (IV). Определите массовые доли металлов в исходной смеси и объём вступившей в реакцию кислоты.
102. В 93,2 мл воды растворили 25,2 л смеси NO2 и O2(молярное соотношение 4:1) и получили 113,8 мл раствора азотной кислоты. Определите плотность раствора, массовую долю азотной кислоты в растворе, молярную концентрацию азотной кислоты в растворе.
Азотная, азотистая, нитраты, нитриты
Массовые доли элементов в соединении равны: водорода – 2,28%; азота – 29,787%; кислорода – 68,085%. Выведите молекулярную формулу соединения.
Массовые доли элементов в соединении равны: водорода – 1,587%; неизвестного элемента – 22,222%; кислорода – 76,190%. Выведите молекулярную формулу соединения.
Массовые доли азота в соединении Me(NO3)n равна – 17,355%. Выведите молекулярную формулу нитрата.
Массовые доли кислорода в соединении Me(NO3)n равна – 53,(3)%. Выведите молекулярную формулу нитрата.
Массовые доли металла в соединении Me(NO3)n равна – 21,849%. Выведите молекулярную формулу нитрата.
Выведите формулу соединения, имеющего состав: металла – 27,059%; азота – 16,471%; кислорода – 56,471%.
Выведите формулу соединения, имеющего состав: металла – 24,390%; азота – 17,073%; кислорода – 58,537%.
При разложении 17,04 г нитрата металла Me(NO3)n образовалось 4,08 г оксида металла Me2On. Определите формулу нитрата.
Массовая доля металла в кристаллогидрате Me(NO3)n.4H2O равна 36,(36)%. Выведите формулу кристаллогидрата.
Массовая доля азота в кристаллогидрате Cu(NO3)2.nH2O равна 11,57%. Выведите формулу кристаллогидрата.
Массовая доля кислорода в кристаллогидрате Al(NO3)3.nH2O равна 76,8%. Выведите формулу кристаллогидрата.
Какой объем 20%-го раствора азотной кислоты (ρ = 1,115 г/мл) вступит в реакцию с 7,68 г меди? Какой объем оксида азота (II) выделится в ходе реакции? Какова массовая доля нитрата меди (II) в растворе?
При взаимодействии раствора, содержащего 12,3 г Me(NOn)2, с раствором ортофосфата натрия образовалось 7,75 г осадка и 12,75 г NaNOn. Определите формулу Me(NOn)2.
Какой объем 50%-го раствора азотной кислоты (ρ = 1,31 г/мл) вступит в реакцию с 5,12 г меди? Какой объем оксида азота (IV) выделится в ходе реакции? Какова массовая доля нитрата меди (II) в растворе?
К 8,64 г оксида меди (I) прилили 95,2 мл 18%-го раствора азотной кислоты (ρ = 1,103 г/мл), в ходе реакции выделилось 0,896 л оксида азота (II). Вычислите массовые доли веществ в растворе.
При взаимодействии 8,16 г смеси меди и оксида меди (I) с 55%-го раствора азотной кислоты (ρ = 1,33 г/мл) выделилось 4,032 л оксида азота (IV). Какой объем кислоты вступил в реакцию? Какова массовая доля соли в растворе?
Какой объем 20%-го раствора гидроксида натрия (ρ = 1,22 г/мл) необходимо для нейтрализации 44 мл 25%-го раствора азотной кислоты (ρ = 1,146 г/мл)? Какова массовая доля соли в растворе?
Гидроксид металла Me(ОН)n массой 8,7 г полностью реагирует с 84,8 мл 20%-го раствора азотной кислоты (ρ = 1,115 г/мл). Определите формулу гидроксида металла, вычислите массовую долю соли в растворе.
Какой объем 20%-го раствора азотной кислоты (ρ = 1,115 г/мл) вступит в реакцию с 5,4 г оксида железа (II)? Какой объем оксида азота (II) выделится в ходе реакции? Какова массовая доля соли в растворе?
Сколько по массе оксида дижелеза (III) - железа (II) вступит в реакцию с 30 мл 60%-го раствора азотной кислоты (ρ = 1,365 г/мл)? Какой объем оксида азота (IV) выделится в ходе реакции?
С 10 г карбоната металла (II) полностью реагирует с 62 мл 15%-го раствора азотной кислоты (ρ = 1,085 г/мл). Определите молекулярную формулу карбоната, вычислите массовую долю соли в растворе.
Какой объем 12%-го раствора азотной кислоты (ρ = 1,065 г/мл) вступит в реакцию с 25,4 г карбоната гидроксосвинца (II)? Какова массовая доля соли в растворе?
Какой объем 10%-го раствора азотной кислоты (ρ = 1,055 г/мл) вступит в реакцию с 11,85 г оксида марганца (II) при нагревании? Какова массовая доля нитрата марганца в фильтрате? Какова масса осадка оксида марганца (IV)?
Гидрид калия массой 8 г растворили в 60 мл воды. Какой объем 30%-го раствора азотной кислоты (ρ = 1,145 г/мл) вступит в реакцию с полученным раствором? Какова массовая доля соли в растворе?
Какой объем 20%-го раствора азотной кислоты (ρ = 1,115 г/мл) вступит в реакцию с 83 мл 25%-го раствора хромата натрия (ρ = 1,25 г/мл)? Каковы массовые доли веществ в растворе?
Какой объем газообразного аммиака (н.у.) вступит в реакцию с 42,4 мл 20%-го раствора азотной кислоты (ρ = 1,115 г/мл)? Какова массовая доля соли в растворе?
Какой объем 15%-го раствора аммиака (ρ = 0,901 г/мл) вступит в реакцию с 52,8 мл 25%-го раствора азотной кислоты (ρ = 1,146 г/мл)? Какова массовая доля соли в растворе?
Какой объем 30%-го раствора азотной кислоты (ρ = 1,18 г/мл) вступит в реакцию с 11,84 г нитрида кальция? Каковы массовые доли веществ в растворе?
По термохимическому уравнению реакции КОН + HNO3 = KNO3 + H2O + 57 кДж рассчитайте объемы вступивших в реакцию растворов гидроксида калия (20%; ρ = 1,19 г/мл) и азотной кислоты (25%; ρ = 1,145 г/мл), если при их взаимодействии выделилось 4,56кДж теплоты?
Какие объемы 65%-го раствора азотной кислоты (ρ = 1,4 г/мл) и воды необходимы для приготовления 1 л 20%-го раствора азотной кислоты (ρ = 1,115 г/мл)?
Соли аммония

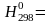 -
820
кДж/моль (- 1640)
-
820
кДж/моль (- 1640)