
- •Лабораторная работа №1
- •Галогенопроизводные алифатических углеводородов Опыт 1. Получение хлорэтана
- •Опыт 2. Щелочной гидролиз алкилгалогенидов (реакции нуклеофилыюго замещения)
- •Опыт 3. Свойства хлороформа
- •Опыт 5. Реакции окисления этилового спирта
- •Опыт 6. Получение простого диэтилового эфира
- •Опыт 7. Получение глицерата и гликолята меди
- •Фенолы Осторожно! Фенолы вызывают ожоги кожи. Опыт 8. Образование и разложение фенолятов
- •Опыт 9. Взаимодействие фенола с бромной водой
- •Опыт 10. Окисление фенола
- •Опыт 11. Реакция фенола с азотистой кислотой
- •Опыт 12. Цветные реакции фенолов
- •Опыт14. Некоторые способы получения альдегидов
- •Опыт 15. Реакции окисления альдегидов
- •Опыт 16. Альдольная и кротоновая конденсация уксусного альдегида и его осмоление
- •Опыт 17. Получение ацетона пиролизом ацетата кальция
- •Опыт 18. Реакция ацетона с гидросульфитом натрия (реакция нуклеофильного присоединения)
- •Опыт 19. Реакции замещения карбонильного кислорода
- •3.2.Ароматические карбонильные соединения Опыт 20. Окисление бензальдегида аммиачным раствором гидроксида серебра (реакция «серебряного зеркала»)
- •Опыт 21. Реакция с фенилгидразином (получение фенилгидразона бензойного альдегида)
- •Опыт 22. Получение беизальанилина (основание Шиффа)
- •Опыт 24. Некоторые свойства уксусной кислоты и ее солей
- •Опыт 25. Получение высших жирных кислот и их свойства
- •4.2. Ароматические кислоты и их производные Опыт 26. Взаимодействие бензойной, коричной и салициловой кислот с бромной водой
- •Опыт 27. Отношение бензойной и коричной кислот к перманганату калия
- •Опыт 28. Реакции бензойной и салициловой кислот с хлоридом железа (III)
- •Опыт 29. Взаимодействие эфиров салициловой кислоты с хлоридом железа (III)
- •4.3. Непредельные карбоновые кислоты Опыт 30. Свойства олеиновой кислоты
- •4.4. Двухосновные карбоновые кислоты Опыт 31. Получение щавелевой кислоты и ее свойства
- •Опыт 32. Получение ангидрида янтарной кислоты
- •Опыт 33. Образование фталевого ангидрида
- •4.5. Сложные эфиры предельных одноосновных кислот Опыт 34. Получение сложных эфиров предельных кислот (реакция этерификации)
- •Опыт 35. Гидролиз этилацетата
- •Жиры и масла Опыт 36. Определение непредельности растительного масла реакцией с бромной водой (тяга)
- •Опыт 37. Взаимодействие растительного масла с водным раствором перманганата калия (реакция Вагнера)
Опыт 15. Реакции окисления альдегидов
Реактивы и оборудование: 5%-ный раствор формальдегида, 10%-ный раствор гидроксида натрия, 2%-ный раствор сульфата меди(П), 1%-ный раствор нитрата серебра, 5%-ный раствор аммиака (в капельнице); водяные бани, термометры, пробирки.
15.1. Окисление формальдегида аммиачным раствором гидроксида серебра (реакция «серебряного зеркала»). Реакцию «серебряного зеркала» проводят в тщательно вымытой пробирке. Для этого в пробирку наливают 4—5 мл 10%-ного раствора гидроксида натрия и осторожно кипятят несколько минут на газовой горелке, затем ее промывают дистиллированной водой. В вымытой пробирке готовят аммиачный раствор гидроксида серебра. К 2—3 мл 1%-ного раствора нитрата серебра при встряхивании по каплям прибавляют 5%-ный раствор аммиака до тех пор, пока образующийся вначале осадок полностью не растворится:
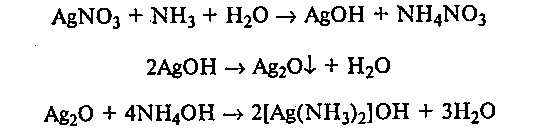
К прозрачному, бесцветному аммиачному раствору гидроксида серебра прибавляют несколько капель 5%-ного раствора формальдегида. Пробирку несколько минут нагревают на водяной бане при температуре воды 70—80 ОС или на газовой горелке до начала побурения раствора (до кипения не доводить). Далее реакция идет без нагревания, и металлическое серебро выпадает в виде черного осадка или осаждается на стенках пробирки в виде блестящего серебряного налета («серебряное зеркало»):
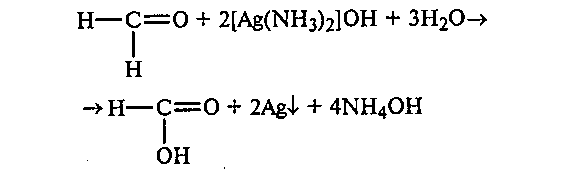
Вступают ли в эту реакцию кетоны? Приведите объяснение.
15.2. Окисление формальдегида гидроксидом меди (II). В пробирку наливают 1 мл 5%-ного раствора формальдегида и 1 мл 10%-ного раствора гидроксида натрия, а затем при встряхивании по каплям добавляют 2%-ный раствор сульфата меди (II) до появления неисчезающей взвеси гидроксида меди (II):
![]()
Верхнюю часть смеси нагревают до кипения. Наблюдают появление желтого осадка гидроксида меди (I), переходящего затем в красный осадок оксида меди (I):
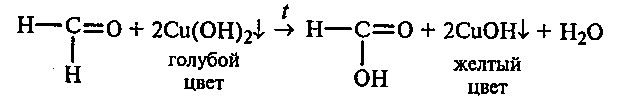
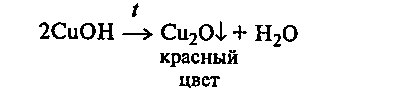
Гидроксид меди (II) может восстанавливаться формальдегидом до металлической меди. В этом случае при использовании очень чистой пробирки можно наблюдать образование на ее стенках «медного зеркала».
Ацетон и другие кетоны не окисляются мягкими окислителями, в том числе и гидроксидом меди (II). Поэтому при нагревании гидроксид меди (II) дегидратируется с образованием черного осадка оксида меди (II):

Опыт 16. Альдольная и кротоновая конденсация уксусного альдегида и его осмоление
Реактивы и оборудование: уксусный альдегид, 10%-ный раствор гидроксида натрия; пробирки.
В пробирку наливают 3 мл 10%-ного раствора гидроксида натрия и добавляют 5—6 капель уксусного альдегида. Полученную смесь нагревают на газовой горелке. Сначала образуется альдоль (приятный запах), а затем непредельный кротоновый альдегид — соединение с резким неприятным запахом (нюхать осторожно). При достаточно длительном нагревании жидкость становится бурой, образуется смола.
Альдольная конденсация уксусного альдегида (реакция Бородина):
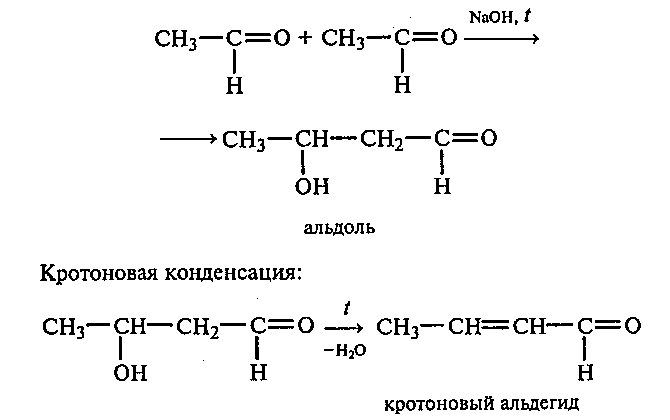
Рассмотрите механизмы реакций альдольной и кротоновой конденсации в щелочной среде. Какие продукты получатся при конденсации пропионового и триметилуксусного альдегидов?
