
Міністерство освіти і науки, молоді та спорту України
Київський національний університет технологій та дизайну
Методичні вказівки до лабораторних робіт з фізики
АТОМНА ФІЗИКА
(Модуль 4)
Лабораторна робота № 72
ДОСЛІДЖЕННЯ СПЕКТРА АТОМА ВОДНЮ
Затверджено на засіданні кафедри
від 31.08.2012 протокол №1
Київ-2012
Лабораторна робота № 72
ДОСЛІДЖЕННЯ СПЕКТРА АТОМА ВОДНЮ
Теоретичні відомості
Дослідження спектрів випромінювання розріджених газів і окремих атомів показали, що кожному газу властивий цілком певний, характерний тільки для нього лінійчатий спектр, який складається з окремих спектральних ліній чи груп близько розташованих ліній, кожній з яких відповідає певна частота випромінювання. Найпростішу структуру має спектр найпростішого атома - атома водню, який випромінює тільки в оптичному діапазоні (ультрафіолетова, видима та інфрачервона частина спектра електромагнітного випромінювання).
Всі спектральні лінії спектра атома водню групуються у серії. Сукупність спектральних ліній, які у своїй послідовності частот (або довжин хвиль) і в розподілі інтенсивності виявляють певну закономірність, називають спектральною серією. В межах кожної серії частоти спектральних ліній підлягають спільним на вигляд закономірностям, що свідчить про однаковий механізм випромінювання атома водню в різних областях оптичного спектра.
Перші дослідження закономірностей випромінювання атома водню у видимій частині спектра у 1885 р. зробив швейцарський вчений Й. Бальмер. Він підібрав емпіричну формулу, яка добре визначала довжини хвиль відомих на той час спектральних ліній випромінювання водню у видимій області:
![]() ,
,
![]() (1)
(1)
де
![]() –
довжина
хвилі,
–
довжина
хвилі,
![]() =
1,1 • 10-7
м
– постійна
Рідберга;
=
1,1 • 10-7
м
– постійна
Рідберга;
![]() –
цілі числа.
–
цілі числа.
Врахувавши,
що
![]() ,
де
,
де
![]() =
3 • 108
м/с –
швидкість світла у вакуумі,
попередню
формулу можна записати у вигляді:
=
3 • 108
м/с –
швидкість світла у вакуумі,
попередню
формулу можна записати у вигляді:
![]() (1*)
(1*)
де
величина
![]() 3,29
• 1015
с-1
– також
називається постійною
Рідберга;
3,29
• 1015
с-1
– також
називається постійною
Рідберга;
Спектральні лінії,
які підлягають залежностям (1) і (1*),
утворюють серію ліній, яка називається
серією
Бальмера.
На нинішній час у спектрі випромінювання
водню виявлено 37 ліній серії Бальмера.
Зі збільшенням
лінії
серії зближуються; значення
![]() визначає границю серії, до якої з боку
більших частот прилягає суцільний
спектр:
визначає границю серії, до якої з боку
більших частот прилягає суцільний
спектр:
![]() .
Крім того, виявляється, що зі збільшенням
номера лінії її інтенсивність зменшується.
Якщо схематично зобразити розміщення
спектральних ліній відповідно до формули
.
Крім того, виявляється, що зі збільшенням
номера лінії її інтенсивність зменшується.
Якщо схематично зобразити розміщення
спектральних ліній відповідно до формули
![]() ,
,
а довжиною штриха виразити інтенсивність спектральної лінії, то отримуємо картину, зображену на рис. 1.

На початку ХХ ст. у спектрі водню було виявлено ще декілька серій випромінювання, які знаходяться поза видимою областю.
В ультрафіолетовій області – серія Лаймана:
![]() ,
,
![]() ;
;
в інфрачервоній області – серія Пашена:
![]() ,
,
![]() ;
;
серія Брекета:
![]() ,
,
![]() ;
;
серія Пфунда:
![]() ,
,
![]() ;
;
серія Хемфрі:
![]() ,
,
![]() .
.
Всі серії у спектрі водню можуть бути описані однією формулою, яка називається узагальненою формулою Бальмера:
![]() ,
,
де число
![]() =1,
2, 3, 4, 5, 6 визначає серію, а число
=1,
2, 3, 4, 5, 6 визначає серію, а число
![]() визначає окремі лінії кожної серії.
визначає окремі лінії кожної серії.
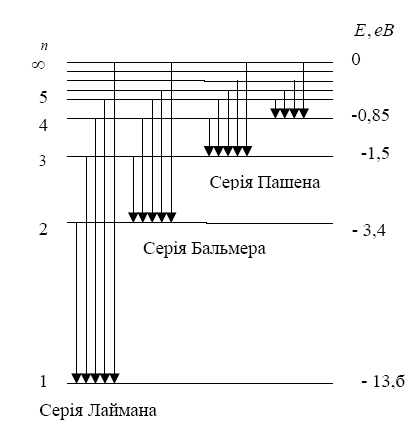
Спектральні серії водню наведені на рис. 2.
Р.Рідберг показав, що не лише в спектрі водню, але і в спектрах інших елементів, лінії утворюють закономірні серії, частоти яких можуть бути представлені у вигляді різниці двох функцій
![]() і
і
![]() ,
,
які називаються спектральними термами, тобто
![]() .
.
Для певної серії число має стале значення. Зміна числа дає всі лінії цієї серії.
Наведені серіальні формули підібрані емпірично і довгий час не мали теоретичного обґрунтування.
Перша спроба побудови якісно нової теорії атома була зроблена в 1913 р. данським ученим Н.Бором. Він поставив перед собою мету зв’язати в єдине ціле емпіричні закономірності лінійчатих спектрів, ядерну модель атома Резерфорда і квантовий характер випромінювання та поглинання світла.
Теорія Бора
застосовна до атома водню і воднеподібних
систем – іонів, які складається з ядра
з зарядом
![]() і одного
електрона, що обертається навколо ядра:
і одного
електрона, що обертається навколо ядра:
![]() ,
,
![]() ,….
,….
В основу своєї теорії Бор поклав три постулати.
Перший постулат
Бора (постулат стаціонарних станів):
в атомі існують певні стаціонарні стани
з відповідними значеннями енергії
![]() перебуваючи в яких, атом не випромінює
енергії.
перебуваючи в яких, атом не випромінює
енергії.
Цим стаціонарним станам відповідають стаціонарні орбіти, по яких рухаються електрони, які, незважаючи на наявність у них прискорення, електромагнітних хвиль не випромінюють.
Другий постулат Бора (правило квантування орбіт): у стаціонарному стані атома електрон, рухаючись по коловій орбіті, має квантовані значення моменту імпульсу, які відповідають умові
![]() ,
,
![]() ,
,
![]() ,
,
де m
– маса електрона,
![]() – його швидкість,
– його швидкість,
![]() – радіус орбіти електрона,
– радіус орбіти електрона,
![]() -
постійна Планка, ħ=
-
постійна Планка, ħ=![]() -
постійна Дірака.
-
постійна Дірака.
Третій постулат
Бора (правило частот):
при переході атома з одного стаціонарного
стану в інший випромінюється або
поглинається один квант енергії – фотон
з енергією
![]() ,
яка дорівнює різниці енергій відповідних
стаціонарних станів.
,
яка дорівнює різниці енергій відповідних
стаціонарних станів.
Випромінювання
фотона відбувається при переході атома
зі стану з більшою енергією
![]() у стан з меншою енергією
у стан з меншою енергією
![]() ,
тобто при переході електрона з орбіти
більш віддаленої від ядра на ближчу до
ядра орбіту. Поглинання енергії
супроводжується переходом атома у стан
з більшою енергією, і електрон
переходить на більш віддалену від ядра
орбіту. Набір можливих частот
,
тобто при переході електрона з орбіти
більш віддаленої від ядра на ближчу до
ядра орбіту. Поглинання енергії
супроводжується переходом атома у стан
з більшою енергією, і електрон
переходить на більш віддалену від ядра
орбіту. Набір можливих частот
![]() квантових переходів і визначає лінійчатий
спектр атома.
квантових переходів і визначає лінійчатий
спектр атома.
Постулати, висунуті Бором, дозволили побудувати теорію, яка дає можливість розрахувати спектр атома водню і воднеподібних систем.
Враховуючи припущення Резерфорда, що електрон у воднеподібній системі рухається по коловій орбіті радіусом r під дією доцентрової кулонівської сили, запишемо (формула Резерфорда):
![]() .
.
Звідси
![]()
 .
.
Підставивши сюди
величину
з виразу
![]() ,
отримаємо:
,
отримаємо:
![]() і
і
![]() ,
,
де n=1, 2, 3,…
Радіуси орбіт зростають пропорційно квадратам цілих чисел.
Для атома водню
(Z=1)
радіус першої орбіти електрона при n=1
називається першим борівським радіусом
![]() і дорівнює
і дорівнює
![]()
Тоді
![]() .
.
Оскільки експериментально виміряти радіуси орбіт неможливо, то для перевірки правильності теорії потрібно знайти такі величини, які можна виміряти експериментально. Такою величиною може бути, зокрема, енергія, яку випромінюють або поглинають атоми.
Енергія електрона у воднеподібній системі дорівнює сумі його кінетичної і потенціальної енергій в електростатичному полі ядра:
![]() .
.
Врахувавши, що
![]() (формула
Резерфорда),
(формула
Резерфорда),
отримаємо:
![]() -
-
кінетична енергія електрона на стаціонарній орбіті дорівнює половині потенціальної.
Тоді
![]() .
.
Підставимо в цей вираз значення :
![]() .
.
Знак „–“ означає, що електрон знаходиться у зв’язаному стані.
Енергетичні стани атома утворюють сукупність енергетичних рівнів, що змінюються залежно від значення n, яке виражає номер енергетичного рівня атома і називається головним квантовим числом. Енергетичний стан з n=1 є основним станом, а стани з n>1 – збуджені.
Надаючи n
різні цілочислові значення, отримаємо
для атома водню (Z=1)
можливі рівні енергії (Рис. 3). Енергія
атома водню зі збільшенням n
зростає (зменшується її від’ємна
величина), і енергетичні рівні наближаються
до границі, що відповідає значенню
![]() .
Атом водню має мінімальну енергію
.
Атом водню має мінімальну енергію
![]() при n=1
і максимальну
при n=1
і максимальну
![]() при
при
![]() .
Значення
.
Значення
![]() відповідає енергії іонізації атома
(відриву від нього електрона). Енергія
іонізації з певного стану дорівнює
за абсолютною величиною енергії зв’язку
електрона в атомі в цьому стані
відповідає енергії іонізації атома
(відриву від нього електрона). Енергія
іонізації з певного стану дорівнює
за абсолютною величиною енергії зв’язку
електрона в атомі в цьому стані
![]() .
.
Згідно з третім постулатом Бора при переході електрона з n-ї орбіти на k-у випромінюється фотон з енергією
![]() ,
,
звідки частота випромінювання
![]() ,
,
де
![]() -
(2)
-
(2)
стала Рідберга.
Значення
![]() обчислене з формули (2) добре узгоджується
з експериментально отриманим
обчислене з формули (2) добре узгоджується
з експериментально отриманим
![]() в емпіричних формулах для атома водню.
Це підтверджує правильність формули
Бора для енергетичних рівнів воднеподібної
системи.
в емпіричних формулах для атома водню.
Це підтверджує правильність формули
Бора для енергетичних рівнів воднеподібної
системи.
Теорія Бора не позбавлена внутрішніх протиріч, тому що з одного боку, застосовує закони класичної фізики, з іншого – ґрунтується на квантових постулатах. Вона змогла пояснити спектри водню і воднеподібних систем і обчислити частоти спектральних ліній, але не змогла пояснити їх інтенсивність і не дала відповіді на запитання: чому здійснюються ті чи інші переходи? Теорія Бора не спроможна описати атом гелію – наступний за воднем атом, де на орбітах два електрони.
Для спостереження спектральних ліній і вимірювання відповідних їм довжин хвиль використовується призмовий монохроматор УМ-2 (рис. 4). Світло від досліджуваного джерела Л концентрується з допомогою конденсора К на щілині 1 коліматора, ширина якої регулюється мікрометричним гвинтом 9. Сфокусований з допомогою гвинта 8 коліматорним об'єктивом 2 вузький промінь напрямляється на систему скляних призм Р1-Р3, з допомогою яких він розкладається у спектр. Розкладене внаслідок дисперсії у призмах світло
потрапляє в зорову трубу, через окуляр 5 якої спостерігається спектр.
 Рис.4.
Рис.4.
З допомогою мікрометричного гвинта, пов'язаного з відліковим барабаном 7, можна обертати навколо вертикальної осі столик 6, на якому розташовані призми. Це потрібно для того, щоб сумістити потрібну лінію спостережуваного спектра з вістрям покажчика 10, розташованого в центрі фокальної площини об'єктива 4 зорової труби. Покажчик і суміщена з ним спектральна лінія спостерігаються через окуляр 5. Кут, на який відхиляється призмою світло певної довжини хвилі, завжди залишається сталим. Величина цього кута визначається кутом повороту відлікового барабана мікрогвинта 7 і вимірюється числом поділок на шкалі барабана.
При дослідженні спектру водню у роботі використовуються газорозрядні трубки, які для збудження електричного розряду підключаються до джерела високої напруги. Тому під час виконання роботи не можна дотикатися руками до оголених
Щоб
визначити довжину хвилі спектральної
лінії, потрібно спочатку проградуювати
шкалу спектрометра, тобто установити
однозначну відповідність між показами
монохроматора –
поділками шкали барабана
![]() і довжиною хвилі спектральної лінії,
що потрапляє на покажчик об’єктива
зорової труби. Для побудови такого
графіка використаємо газорозрядну
лампу, наповнену неоном. В
лінійчатому спектрі неону
довжини
хвиль спектральних
ліній добре
відомі.
Можна
також використати відому для цього
монохроматора функціональну залежність
між довжиною хвилі і поділками барабана
і довжиною хвилі спектральної лінії,
що потрапляє на покажчик об’єктива
зорової труби. Для побудови такого
графіка використаємо газорозрядну
лампу, наповнену неоном. В
лінійчатому спектрі неону
довжини
хвиль спектральних
ліній добре
відомі.
Можна
також використати відому для цього
монохроматора функціональну залежність
між довжиною хвилі і поділками барабана
![]() .
.
