
- •Москва, 2002
- •Глава 1. Биохимические основы церебрального энергетического обмена
- •Заключение
- •Глава 2. Современные методы оценки церебрального энергетического обмена
- •Заключение
- •Глава 3. Использование электрофизиологических показателей для оценки церебрального энергетического обмена
- •3.1. История изучения уровня постоянных потенциалов головного мозга
- •Глава 4. Современные методы регистрации и анализа уровня постоянных потенциалов головного мозга человека
- •Глава 5. Энергетический обмен при развитии и старении мозга
- •5.2. Церебральный энергетический обмен в среднем возрасте
- •5.3. Церебральный энергетический обмен при старении
- •Глава 6. Закономерности изменения церебрального энергетического обмена при различных функциональных состояниях
- •6.4. Влияние гипервентиляции на показатели энергетического обмена мозга
- •Глава 7. Изменение церебрального энергетического обмена при заболеваниях центральной нервной системы
- •7.1.1. Нарушения энергетического обмена при заикании
- •7.3. Энергетический обмен мозга при болезни Альцгеймера
- •Глава 8. Связь церебрального энергетического обмена с функциональной активностью и гемодинамикой мозга
- •Глава 9. Взаимосвязь церебрального энергетического обмена с характеристиками иммунитета
- •Глава 10. Церебральный энергетический обмен и некоторые психофизиологические характеристики личности
- •Глава 11. Энергетические характеристики деятельности мозга и функциональная межполушарная асимметрия (фма)
- •Предисловие
- •Глава 1
- •Общие представления об энергетическом обмене
- •1.2. Особенности энергетического обмена мозга
- •1.5. Специфические механизмы регуляции рН ликвора и мозга
- •Заключение
- •Глава 2
- •2.1. Неинвазивные методы исследования энергетического обмена мозга (пэт, ямр-спектроскопия и др.)
- •2.2. Электрофизиологические методы для определения энергетического обмена
- •Глава 3
- •3.1. История изучения уровня постоянного потенциала головного мозга
- •3.4. Потенциалы сосудистого происхождения
- •3.5. Что мы регистрируем от кожи головы с помощью неполяризуемых электродов и усилителя постоянного тока?
- •3.6. Форма распределения упп по поверхности головы. Принципы интерпретации упп
- •Глава 4.
- •4.1. Виды постоянных потенциалов
- •4.2. Принципы регистрации упп и возможные артефакты
- •4.3. Современная аппаратура для изучения постоянных потенциалов
- •4.4. Процедура регистрации упп
- •4.5. Семиотика основных параметров упп
- •4.6. Пространственно-временной анализ упп
- •4.7. Нормативное шкалирование упп
- •Глава 5
- •5.1. Церебральный энергетический обмен в детстве
- •5.2. Церебральный энергетический обмен в среднем возрасте
- •5.3. Церебральный энергетический обмен при старении
- •5.4. Динамика упп мозга при развитии и старении
- •5.6. Нейрофизиологические предикторы смерти
- •Заключение
- •Глава 6
- •6.3. Изменение церебрального энергетического обмена при обучении
- •6.6. Изменения церебрального энергетического обмена при стрессе
- •6.6.3. Исследование взаимосвязи между параметрами упп головного мозга и уровнем гормона стресса кортизола
- •6.7.1. Упп у мужчин-спортсменов до и после тренировочной нагрузки
- •6.7.2. Упп у женщин-спортсменок до и после тренировочной нагрузки
- •6.7.4. Упп мозга и прогноз спортивных достижений
- •Заключение
- •Глава 7
- •7.1.2. Динамика церебрального энергетического обмена у больных заиканием при гипнозе
- •7.2.2. Изменения церебрального энергетического обмена у больных наркоманиями при гипнозе
- •7.3. Энергетический обмен мозга при болезни Альцгеймера
- •7.3.3. Стресс и энергетический обмен при ба
- •Покампе, то у больных ба эта зависимость нарушена (m.J. De Leon et al., 1997), что свидетельствует о десенситизации нейронов гиппокампа к глюкокортикоидам.
- •7.3.4. Стресс и перекисное окисление липидов при ба
- •7.3.5. Упп и вызванные потенциалы при ба
- •7.6. Церебральный энергетический обмен у больных с опухолями мозга
- •Заключение
- •Глава 8
- •8.1.1. Взаимосвязь параметров упп и ээг у здоровых испытуемых в состоянии спокойного бодрствования
- •8.1.2. Взаимосвязь параметров упп и ээг у здоровых испытуемых при гипервентиляции
- •8.1.3. Взаимосвязь ээг и церебрального энергетического обмена у родственников больных болезнью Альцгеймера в состоянии спокойного бодрствования
- •8.1.4. Взаимосвязь ээг и церебрального энергетического обмена у родственников больных болезнью Альцгеймера при гипервентиляции
- •8.2 Взаимосвязь церебрального энергетического обмена и вызванных потенциалов
- •8.2.1. Связь упп в затылочной области с компонентами зрительных вызванных потенциалов
- •8.2.2. Интегральная оценка взаимосвязи между распределением упп и характеристиками звп. Энергоинформационные состояния
- •Коэффициенты корреляции между латентными периодами звп и упп мозга после акупрессуры биологически активных зон
- •8.3. Вызванные потенциалы мозгового ствола и упп
- •Коэффициенты корреляции между параметрами упп и свпмс
- •8.4. Реоэнцефалограмма и характеристики упп
- •Заключение
- •Глава 9
- •Заключение
- •Глава 10
- •10.1. Функциональные энергетические состояния мозга и процесс обучения у младших школьников
- •10.2. Психофизиология успеха и избегания неудач у детей
- •10.3. Психофизиология старения
- •Глава 11
- •11.1. История изучения упп головного мозга и фма
- •11.2 Современный этап изучения динамической функциональной межполушарной асимметрии с помощью упп головного мозга
- •11.3. Межполушарная разность упп в височных областях у мужчин и женщин разного возраста
- •11.4. Динамика межполушарной асимметрии упп у правшей в течение дня
- •11.5. Различия в распределении упп у правшей и левшей
- •11.6. Анализ связи между различными видами асимметрий и распределением упп
- •11.7. Устойчивость межполушарной асимметрии упп при различных нагрузках
- •Устойчивость межполушарной разности упп в височных отведениях при различных нагрузках
- •11.8. Устойчивость межполушарной асимметрии при нагрузках в условиях патологии
- •11.9. Особенности характеристик звп, биохимических и иммунологических показателей в трех группах лиц с различной функциональной асимметрией
- •11.9.1. Характеристики звп
- •11.9.2. Иммунологические характеристики
- •Заключение
- •Общее заключение
- •Литература
6.6. Изменения церебрального энергетического обмена при стрессе
Стресс (общий адаптационный синдром) – это совокупность стереотипных приспособительных реакций, которые возникают в организме в ответ на действие чрезвычайного раздражителя любой природы. Факторы, вызывающие реакцию стресса, получили название стрессоров. В качестве стрессоров могут выступать эмоциональное напряжение, значительные умственные и физические усилия, травмы, интоксикации, любая болезнь и т.д.
Основополагающие исследования, положившие начало концепции стресса, были сделаны канадским физиологом Гансом Селье (1960). Автор описал три основных стадии стресса: (1) тревога, (2) резистентность и (3) истощение. Он показал также, что центральную роль в механизмах стресса играет активация гипоталамо-гипофизарно-надпочечниковой системы (ГГНС), приводящая к существенным изменениям гормонального фона в организме.
Реакция тревоги характеризует остро протекающую мобилизацию адаптационных процессов в ответ на действие стрессора. На стадии резистентности устанавливается повышенная сопротивляемость организма к стрессору. При сильном и длительном стрессе общий адаптационный синдром переходит в стадию истощения, когда резистентность организма резко падает.
В дальнейшем было обнаружено, что в регуляции активности ГГНС принимают большое участие гиппокамп и миндалина – структуры лимбической системы, участвующие в регуляции тревоги, страха и депрессии. Центральное ядро миндалины усиливает активность ГГНС (L.D Van de Kar et al., 1991; W.C. Drevets, M.E. Raichle, 1992). Оно имеет прямые проекции в паравентрикулярное ядро гипоталамуса, где находятся тела нейронов, содержащих кортикотропин-рилизинг фактор - вещество, обеспечивающее выброс АКТГ гипофизом (T.S. Gray et al., 1989). Гиппокамп через кортикогипоталамический тракт имеет прямые проекции к паравентрикулярному ядру и проекции к ядрам терминальной полоски, которые также связаны с паравентрикуляр
114
ным ядром гипоталамуса (A.J. Silverman et al., 1981). Гиппокамп, в целом, оказывает тормозное влияние на активность ГГНС, осуществляя контроль по механизму отрицательной обратной связи (L. Jacobson, R. Sapolsky, 1991).
Рассмотрим последовательность событий при развитии стресса. Под влиянием чрезвычайного раздражителя (стрессора) из мозгового вещества надпочечников и образований симпатической нервной системы усиливается выброс «аварийного» гормона адреналина. Повышается также активность норадренергической системы. Хотя ГЭБ препятствует попаданию в головной мозг адреналина и норадреналина, выделяемого окончаниями симпатических нервных волокон и мозговым веществом надпочечников, эти вещества способны проникать через ГЭБ в некоторых его участках – в так называемых циркумвентрикулярных областях. Адреналин и норадреналин вызывают активацию структур лимбико-ретикулярного комплекса, в частности миндалины и коры мозга. В результате этого происходит активация ГГНС, опосредованная возбуждающим медиатором - оксидом азота (NO) (S.M. McCann, 1997). Из паравентрикулярного ядра гипоталамуса выделяется кортикотропин-рилизинг фактор, запускающий выброс из гипофиза АКТГ, который увеличивает секрецию глюкокортикоидов корой надпочечников (К. Лишшак, Э. Эндреци, 1967). Эти гормоны, в частности кортизол, воздействуют на нейроны гиппокампа. В свою очередь он тормозит активность гипоталамо-гипофизарно-надпочечниковой оси по механизму отрицательной обратной связи.
Гормоны стресса провоцируют многообразные изменения в деятельности организма: развивается гипертрофия надпочечников, происходит инволюция вилочковой железы и лимфатических узлов, тормозится реакция воспаления, изменяется функциональное состояние ЦНС. (Подробное рассмотрение этих изменений выходит за пределы данной работы, а в этом разделе будут рассмотрены энергетические аспекты этой проблемы.)
Достижение адаптации при стрессе осуществляется прежде всего за счет перестройки энергетических обменных процессов в организме. Адреналин вызывает гипергликемию и торможение секреции инсулина. Снижение концентрации инсулина благодаря уменьшению антилиполитического эффекта обеспечивает интенсификацию липолиза под действием липолитических “стрессорных” гормонов. В результате этого энергетические потребности организма обеспечиваются за счет неэтерифицированных жирных кислот. Даже в мозге в качестве энергетического источника кроме глюкозы начинают использоваться продукты распада жирных кислот – кетоновые тела. Под влиянием кортизола усиливается глюконеогенез, структурным субстратом для которого являются главным образом аминокислоты. В целом, кортизол обладает катаболичес
115
ким действием (В.М. Дильман, 1987). Защитные реакции при стрессе могут осуществляться при усилении кровотока, что обеспечивается повышением артериального давления под влиянием активации симпато-адреналовой системы.
При стрессе закономерно изменяются функциональное состояние мозга и его энергетический метаболизм. С помощью ПЭТ у людей в этом состоянии выявлено повышение мозгового кровотока в различных отделах мозга, в частности в лобных областях (R. Soufer et al., 1998; M. Iadarola et al., 1998). Гормоны стресса глюкокортикоиды повышают возбудимость мозговых структур вплоть до снижения судорожного порога (К. Лишшак, Э. Эндреци, 1967). В гиппокампе при стрессе увеличивается активность глютаматергических нейронов, и этот эффект, по крайней мере отчасти, опосредован глюкокортикоидами, так как он уменьшается у животных с удаленными надпочечниками (B.S. McEwen, A.M. Magarinos, 1997). Глютамат является возбуждающим медиатором, который играет важную роль в процессах памяти. Это было показано, в частности на моделях посттетанической потенциации. Однако в повышенных концентрациях этот медиатор оказывает нейротоксическое действие, опосредованное избыточной активацией NMDA-рецепторов, накоплением внутриклеточного кальция и активацией Ca-зависимых фосфолипаз, протеаз, эндонуклеаз. Под действием этих ферментов происходит деградация важнейщих структур нейронов и их гибель. Нейротоксическое действие глютамата при повышении уровня глюкокортикоидов усиливается. Так, у животных в условиях естественного социального стресса, как и при хроническом введении им кортикостерона в дозе, соответствующей его повышению при стрессе, наблюдается развитие атрофических изменений в гиппокампе; результатом является нарушение процесса обучения, причем этот эффект наблюдается только у пожилых животных (S.R. Bodnoff et al., 1995). Повышенная концентрация глюкокортикоидов запускает в мозге процессы запрограммированной клеточной смерти – апоптоза.
При стрессе увеличивается роль гликолиза в энергетическом обмене. Этот фактор, а также использование мозгом в качестве энергетического субстрата кетоновых тел приводит к повышению концентрации кислых продуктов метаболизма в мозге (Н.А. Емельянов, И.А. Герасимова, 1990).
Снижение внутриклеточного рН нарушает работу дыхательной цепи митоходрий, что усиливает процессы свободно-радикального окисления (H. Nohl, V. Koltover, 1994). Кроме того, ацидоз повышает содержание внутриклеточного кальция и является фактором, способствующим апоптозу (E. Roberts, 1996; R. Gottlieb et al., 1996).
116
6.6.1. Исследование изменений параметров УПП мозга при стрессе, связанном с ожиданием сигнала тревоги
В нашем исследовании сравнивались параметры УПП у горноспасателей Подмосковья, работа которых связана с ликвидацией аварий в шахтах и характеризуется высоким уровнем стресса, и у контрольной группы здоровых испытуемых – строительных рабочих, чья профессиональная деятельность не сопряжена со значительным психоэмоциональным напряжением.
Характерной особенностью работы горноспасателей является ожидание сигнала "тревоги", - необходимостью внезапно и быстро переключаться с одного вида деятельности, как правило, безопасного, на другой вид, связанный с риском и опасностью для жизни при ликвидации аварии на шахтах. Постоянное ожидание сигнала тревоги приводит к развитию стресса («Методические указания по организации и проведению профессионального отбора оперативных работников военизированных горноспасательных частей», 1973).
Обследовано 13 горноспасателей (средний возраст 38,1 + 2,1 лет) и 24 строительных рабочих того же возраста (36,4 + 2,5 лет). Кроме исследования УПП в обеих группах оценивали состояние вегетативной нервной системы, измеряя частоту сердечных сокращений, артериальное давление и индекс Кердо, величина которого позволяет судить о преобладании тонуса симпатической или парасимпатической нервной системы.
Анализ вегетативных показателей позволил подтвердить наличие стресса у горноспасателей. В этой группе пульс был достоверно повышен по сравнению с контрольной группой нестрессированных здоровых людей того же возраста. У них был достоверно выше, чем в контроле, индекс Кердо, что свидетельствовало о большей активации симпатической нервной системы (табл. 6.1.). Показатели артериального давления в обеих группах достоверно не различались.
Таблица 6.1.
Вегетативные показатели у горноспасателей и в контрольной группе здоровых испытуемых
Вегетативные показатели |
Группы |
Средние значения |
Ошибка средней |
F-критерий |
Уровень значимости (p) |
Пульс |
Горноспасатели Контроль |
76,3 65,3 |
1,98 1,85 |
13,6 |
0,0008 |
Индекс Кердо |
Горноспасатели Контроль |
-0,07 -0,26 |
0,01 0,05 |
7,0 |
0,0128 |
У горноспасателей, находящихся в состоянии стресса, УПП был достоверно повышен во всех монополярных отведениях, от
117
мечалось также увеличение усредненного УПП (рис. 6.8). Кроме того, у них выявлена корреляция между величиной индекса Кердо и уровнем потенциала в лобной области, измеренным монополярно (r = 0,6; p<0,05). В контрольной группе нестрессированных здоровых испытуемых такой взаимосвязи не было.
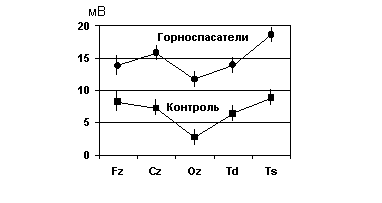
Рис. 6.8. УПП у горноспасателей и в контрольной группе здоровых испытуемых.
По оси ординат – значения УПП в мВ, по оси абсцисс – различные отведения УПП
Повышение УПП у горноспасателей, очевидно, связано с тем, что при стрессе усиливаются церебральный энергетический метаболизм и мозговой кровоток, возрастает роль гликолиза и других метаболических путей, сопровождающихся накоплением в мозговых структурах кислых продуктов обмена. Достоверное повышение УПП отмечено во всех областях, кроме лобной, что свидетельствует об увеличении энергетического обмена и снижении рН в большинстве отделов мозга.
6.6.2. Предоперационный стресс
Практически все больные в период, непосредственно предшествующий операционному вмешательству, даже если угроза жизни мала, испытывают сильное волнение, и у них имеют место характерные признаки стресса. Показано, что в это время значительно перестраиваются биохимические процессы, электрическая активность головного мозга, а также целый ряд психофизиологических характеристик (Л.Р. Зенков, П.В. Мельничук, 1985). Естественно, что в этом случае энергетические процессы головного мозга значительно меняются, поскольку происходит активация ГГНС и связанные с этим явления.
Мы регистрировали УПП у 8 больных с пояснично-крестцовым радикулитом в возрасте 44 - 50 лет, находившихся в клинике нервных болезней Московской медицинской академии им. И.М. Сеченова. Неврологическое обследование не выявило у них патологических изменений со стороны ЦНС. Измерение УПП осуществлялось в 17 отведениях по стандартной методике непосредственно перед премедикацией для оперативного лечения - декомпрессии корешков спинного мозга, сдавливавшихся грыжами дисков.
У больных имелись признаки эмоционального напряжения, связанные с предстоящей операцией. У всех УПП был существен
118
но повышен по сравнению с возрастной нормой, кроме того, не наблюдалось достоверного повышение УПП в доминантном полушарии, по сравнению с субдоминантным (рис. 6.9).
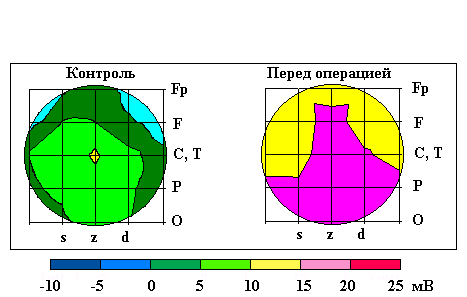
Рис. 6.9. Картирование УПП у больных с пояснично-крестцовым радикулитом перед операцией и в контрольной группе здоровых испытуемых.
Fp – нижнелобная, F – лобная, С – центральная, Т –височная, Р – теменная, О – затылочная области регистрации; s, z, d – левая парасагиттальная, сагиттальная и правая парасагиттальная линии соответственно. Для картирования использованы средние значения УПП по группам больных и здоровых испытуемых. Цветовая шкала УПП представлена в нижней части рисунка
Нарушения УПП у больных в состоянии предоперационного стресса имели значительное сходство с изменениями этого показателя у горноспасателей, ожидающих сигнал тревоги (см. раздел 6.6.1. Это указывает на однотипный характер изменений церебрального энергообмена, сопровождающийся закислением мозга при стрессах различной природы.
