- •Фогель ф., Мотульски а. Генетика человека: в 3-х т. Т. 2: Пер. С англ. – м.: Мир, 1990. – 378 с.
- •Ф. Фогель, а.Мотульски генетика человека
- •4. Действие генов
- •4.1. Развитие менделевской парадигмы
- •4.2. Гены и ферменты
- •4.2.1. Гипотеза «один ген – один фермент»
- •Модель Бидла и Татума. Статья этих исследователей начиналась так:
- •4.2.2. Гены и ферменты у человека: современный уровень знаний
- •4.2.2.1. Обнаружение и анализ ферментативных нарушений
- •4.2.2.2. Типичные нарушения функций ферментов: ферменты эритроцитов
- •4.2.2.3 Мукополисахаридозы
- •4.2.2.5. Влияние кофакторов на активность ферментов [182]
- •4.2.2.6. Сцепленная с х-хромосомой недостаточность гипоксантин-гуанин—фосфорибозилтрансферазы (30800) [7055]
- •4.2.2.7. Фенилкетонурия: пример успешного лечения метаболического заболевания [182; 203]
- •4.2.2.8. Выявление гетерозигот
- •4.2.2.9. Лечение наследственных метаболических заболеваний [1289; 1057; 1058]
- •4.2.2.10. Необнаруженные дефекты ферментов
- •4.3. Гемоглобин человека [119; 31; 97а]
- •4.3.1. История изучения гемоглобина
- •4.3.2. Генетика гемоглобина
- •4.3.4. Талассемии [31; 972; 138; 1253; 222; 97а]
- •4.3.5. Популяциоииая генетика генов гемоглобина (см. [972], разд. 6.1.2.3)
- •4.3.6. Пренатальная диагностика гемоглобинопатии [966; 2269; 2322; 2361]
- •4.4. Генетика антител и системы антиген/рецептор
- •4.5. Фармакогенетика и экогенетика 4.5.1. Фармакогенетика
- •4.5.2. Экогенетика [143; 969; 1228; 1250]
- •4.6. Механизм аутосомной доминантности
- •4.6.1. Аномальная агрегация субъединиц
- •4.6.2. Аномальные субъединицы нарушают функции мультимерных белков
- •4.6.3. Аномальное ингибирование ферментов по типу обратной связи и структурно аномальные ферменты
- •4.6.4. Мутации рецепторов
- •4.6.5. Наследственные дефекты клеточных мембран
- •4.6.6. Накопление аномальных фибриллярных белков: наследственные амилоидозы (10480 10525) [1102]
- •4.6.7. Доминантно наследуемые опухолевые заболевания
- •4.7. Генетика эмбрионального развития
- •4.7.1. Активность генов в раннем развитии
- •4.7.2. Поздние стадии эмбрионального развития; фенокопии
- •4.7.3. Регуляция активности генов у бактерий и эукариот
- •4.7.4. Соотношения генотипа и фенотипа при хромосомных аберрациях у человека [1176]
- •4.7.4.1. Эффект дозы генов при трисомиях и картирование генов
- •4.7.4.2. Другие биохимические аномалии при хромосомных аберрациях
- •4.7.4.3. Изучение хромосомных аберраций на уровне клеток
- •4.7.5. Определение поля
- •5. Мутации
- •5.1. Спонтанные мутации
- •5.1.1. Генетические изменения, обусловленные мутациями de novo
- •5.1.2. Геномные и хромосомные мутации у человека
- •5.1.2.1. Частота возникновения мутаций (скорость мутирования)
- •5.1.2.2. Нерасхождение хромосом и возраст матери
- •5.1.2.3. У какого пола и в каком из мейотических делений происходит нерасхождение хромосом?
- •5.1.2.4. Нерасхождение, хромосомные варианты и сателлитные ассоциации
- •5.1.3. Генные мутации: анализ на фенотипическом уровне
- •5.1.3.1. Методы оценки частот мутаций
- •5.1.3.2. Результаты оценки частот мутаций
- •5.1.3.3. Частота мутаций и возраст отца
- •5.1.3.4. Возможные различия частот возникновения мутаций у индивидов разного пола
- •182 5. Мутации
- •5.1.3.5. Герминативноклеточные и соматоклеточные мозаики по доминантным и х-сцепленным мутациям
- •5.1.4. Генные мутации: анализ на молекулярном уровне
- •5.1.4.1. Частоты кодонных мутаций
- •5.1.4.2. Проблема оценки общей частоты мутаций на геном и на поколение
- •5.1.4.3. Мутации в гемоглобиновых генах и генетический код
- •5.1.4.4. Мутации у микроорганизмов: их вклад в понимание механизма мутаций у человека
- •5.1.5. Изучение генных мутаций в отдельных клетках
- •5.1.6. Соматические мутации
- •5.1.6.1. Образование мозаиков по геномным мутациям
- •5.1.6.2. Наследственные синдромы с повышенной нестабильностью хромосом [1465; 1464; 1634]
- •5.1.6.3. Молекулярные механизмы хромосомной нестабильности и образование опухоли, обусловленное соматической мутацией
- •5.1.6.4. Другие факты, свидетельствующие о роли соматической мутации в механизме канцерогенеза [1520]
- •5.1.6.5. Онкогены [1686; 1690, 1691, 1696}
- •5.1.6.6. Рак у человека с точки зрения генетики
- •5.1.6.7. Соматические мутации и старение
- •5.2. Мутации, индуцированные облучением и химическими мутагенами
- •5.2.1. Мутации, индуцированные радиацией
- •5.2.1.1. Основные факты и проблемы, поставленные в ходе их анализа
- •5.2.1.2. Проблема оценки генетического риска, обусловленного радиацией и другими мутагенными факторами окружающей среды
- •5.2.1.3. Результаты изучения мутагенного действия радиации на млекопитающих [1377]
- •5.2.1.4. Облучение популяции человека ионизирующей радиацией
- •5.2.1.5. Насколько может увеличиться частота возникновения спонтанных мутаций9
- •Данные о соматических хромосомных мутациях, возникающих под воздействием радиации.
- •5.2.2. Химически индуцированные (мутации)
- •5.2.2.1. Суть проблемы
- •5.2.2.2. Исследовательские стратегии при оценке генетического риска, обусловленного химическими мутагенами
- •5.2.2.3. Каким образом химические мутагены действуют на генетический материал?
- •5.2.2.4. Насколько широким является воздействие агента на человеческую популяцию?
- •5.2.2.5. Какого увеличения частоты спонтанных мутаций, обусловленного химическими мутагенами, следует ожидать?
- •6. Популяционная генетика
- •6.1. Описание популяций
- •6.1.1. Закон Харди—Вайнберга: генные частоты
- •6.1.2. Генетический полиморфизм
- •6.1.3. Наследственные болезни
- •6.2. Систематические изменения генных частот: мутации и отбор
- •6.2.1. Естественный отбор
- •6.2.1.1. Математические модели отбора: дарвиновская приспособленность
- •6.2.1.2. Отбор, приводящий к изменению генных частот в одном направлении
- •6.2.1.3. Отбор, приводящий к генетическому равновесию
- •6.2.1.4. Отбор, приводящий к нестабильному равновесию
- •6.2.1.5. Другие формулы отбора
- •6.2.1.6. Отбор, обусловленный инфекционными болезнями [1831; 211]
- •История некоторых инфекционных заболеваний.
- •6.2.1.7. Естественный отбор и история популяций: НbЕ и β-талассемия 1)
- •6.2.1.8. Отбор по системе групп крови аво и другим полиморфным системам
- •6.3. Отклонение от случайного скрещивания
- •6.3.1. Кровнородственные браки
- •6.3.1.1. Коэффициент инбридинга [103]
- •6.3.1.2. Инбридинг, размер изолята и наследственные заболевания
- •6.3.2. Концепция генетического груза
- •6.3.2.1. Теория
- •6.3.2.2. Практическое применение теории
- •6.3.2.3. Критическая оценка
- •6.3.2.4. Более прямые подходы к оценке числа рецессивных генов на индивид
- •6.3.3. Дифференциация субпопуляций: генетическое расстояние
- •6.3.4. Поток генов
- •6.4. Случайные флуктуации генных частот
- •6.4.1. Генетический дрейф
- •6.4.2. Генетический дрейф в сочетании с мутационным процессом и отбором
- •Оглавление
- •Глава 4 Действие генов 5
- •Глава 5. Мутации 142
- •Глава 6. Популяционная генетика 278
- •Электронное оглавление
- •4. Действие генов 5
- •4.1. Развитие менделевской парадигмы 5
- •4.2. Гены и ферменты 8
- •4.7. Генетика эмбрионального развития 126
- •5. Мутации 142
- •5.1. Спонтанные мутации 142
- •5.2. Мутации, индуцированные облучением и химическими мутагенами 222
- •6. Популяционная генетика 278
- •6.1. Описание популяций 279
- •6.2. Систематические изменения генных частот: мутации и отбор 294
- •6.3. Отклонение от случайного скрещивания 339
- •6.4. Случайные флуктуации генных частот 367
4.2.2.6. Сцепленная с х-хромосомой недостаточность гипоксантин-гуанин—фосфорибозилтрансферазы (30800) [7055]
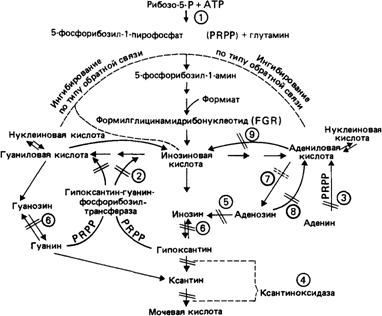
Дефекты ферментов и их роль в изучении механизмов действия генов. Некоторые дефекты ферментов сыграли заметную роль в изучении самых общих вопросов, касающихся действия генов и возникновения мутаций. Особенно важные результаты были получены при исследовании нарушений метаболизма пуринов, обусловленных недостаточностью гипоксантин-гуанин—фосфорибозилтрансферазы (HPRT) (рис. 4.21) [1294].
Синдром Леша-Найхана [1293]. В 1964 г. Леш и Найхан описали специфический синдром [1198], характеризующийся
|
Рис. 4.21. Известные дефекты метаболизма пуринов у человека. (1) Повышенная активность фосфорибозилпирофосфат —синтетазы у больных с избыточным синтезом мочевой кислоты и подагрой. (2) Почти полная недостаточность гипоксантин-гуанин — фосфорибозилтрансферазы (HPRT) у детей с синдромом Леша—Найхана и частичная недостаточность этого фермента у больных с избыточным синтезом мочевой кислоты при подагре. (3) Недостаточность аденинфосфорибозилтрансферазы (APRT) у больных с камнями в почках. В этом случае камни состоят из 2,8-диоксиаденина (не путать с мочекислыми камнями). (4) Недостаточность ксантиноксидазы у больных ксантонурией, для которых повышен риск образования камней в мочевыводящих путях и, в некоторых случаях, риск миалгии, обусловленной присутствием кристаллов ксантина в мышцах. (5) Недостаточность аденозиндезаминазы, связанная с общей тяжелой иммунной недостаточностью. (6) Недостаточность пуриннуклеозидфосфорилазы, связанная с дефектом Т-лимфоцитов. (7) Активность пурин-5-нуклеозидазы снижена в лимфоцитах больных агаммаглобулинемией, которая может быть вторичной при утрате В-клеток. (8) Недостаточность аденозинкиназы до сих пор наблюдалась только в культурах лимфобластов человека. Соответствующее заболевание еще предстоит идентифицировать. (9) Недостаточность миоаденилатдезаминазы у некоторых больных связана с явлениями слабости и судорогами в мышцах после сильных нагрузок, а также с отсутствием повышения концентрации ионов аммония в венозной крови в ответ на мышечные нагрузки [1294]. Эти дефекты ферментов служат замечательными примерами более, а часто менее характерных фенотипических последствий различных генетических блоков в единой цепи реакций. |
46 4. Действие генов
атетозом, гиперрефлексией и непременным самодеструктивным поведением, которое может выражаться даже в откусывании губ и пальцев [1164]. У всех пациентов (болеют только мальчики) наблюдается гиперурикемия и повышенная концентрация мочевой кислоты в моче, что приводит к образованию камней в почках и закупорке мочевых путей. Признак сцеплен с полом (разд. 3.1.4). Гетерозиготы клинически здоровы, однако поддаются выявлению.
В 1967 г. Сигмиллер и др. [1295] при обследовании больных с синдромом Леша - Найхана обнаружили практически полную недостаточность одного из ферментов метаболизма пуринов - гипоксантин-гуанин—фосфорибозилтрансферазы (HPRT) (у трех больных - в лизатах эритроцитов, у одного больного - в культуре фибробластов). Впоследствии дефект фермента был выявлен во многих тканях: печени, лейкоцитах и в мозге. Инозин-5'монофосфат образуется в нескольких реакциях, принадлежащих к разным метаболическим путям. Однако клетки могут использовать также готовые пуриновые основания и нуклеозиды, образующиеся при расщеплении нуклеиновых кислот. В этом пути «использования вторичного сырья» свободные пуриновые основания превращаются в соответствующие 5'-мононуклеотиды. Имеются два фермента, один специфичен для гипоксантина, второй для аденина (рис. 4.21). Если первый фермент дефектен, то вторичного использования гипоксантина и гуанина не происходит, вместо этого они превращаются в мочевую кислоту. В результате развивается гиперурикемия с образованием камней в почках; однако остается неясным, чем обусловлены симптомы со стороны ЦНС. Дефекты HPRT удобно изучать в культуре фибробластов, вот почему этот фермент использовали в качестве модели при решении ряда проблем.
Гетерогенность на молекулярном уровне. В разных семьях обычно встречаются различные мутации. Об этом свидетельствуют результаты изучения таких характеристик фермента, как остаточная активность, константа Михаэлиса—Ментен, термолабильность, ингибирование конечными продуктами - GMP и IMP и других. Иногда выраженная недостаточность HPRT имела место и в отсутствие признаков синдрома Леша-Найхана. Дефектная гипоксантингуанин—фосфорибозилтрансфераза была выявлена у некоторых взрослых больных подагрой [1162; 1294]. Однако подавляющее большинство людей, страдающих этим заболеванием, обладают нормальной HPRT. У тех немногих больных подагрой, которые имеют дефектный фермент, этот признак наследуется сцепленно с Х-хромосомой. Это еще раз указывает, что мутации действительно затрагивают один и тот же локус.
Доказательства инактивации Х-хромосомы. Одно из наиболее убедительных доказательств гипотезы Лайон (разд. 2.2.3.3) было получено при изучении активности фермента на уровне отдельных клеток у гетерозигот с мутациями по HPRT [1164]. Более того, эти исследования позволили по-новому взглянуть на метаболические взаимоотношения между клетками.
Метаболическая кооперация. Изучение культуры фибробластов кожи дает возможность идентифицировать гетерозиготных носителей мутации Если получить клоны из отдельных фибробластов и определить активность фермента, измерив с помощью радиоавтографии количество поглощаемого клетками гипоксантина, меченного тритием, то оказывается, что примерно у половины клонов активность HPRT нормальная, а у половины фермент дефектен. Однако в культурах фибробластов, которые получены без клонирования, подавляющее большинство гетерозиготных клеток обладали активностью. Очевидно, при контакте клеток, дефектных по HPRT, с нормальными клетками их метаболический дефект подвергается коррекции [1090]. Этот вывод подтверждается опытами, в которых нормальные и дефектные клетки смешивали в одной культуре. Феномен назвали «метаболической кооперацией».
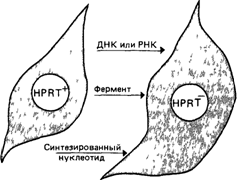
Рассмотрим три возможных механизма такой кооперации (рис. 4.22).
4 Действие генов 47
|
Рис. 4.22. Возможные механизмы метаболической кооперации между клетками с активной HPRT и с неактивным ферментом в культуре гетерозиготных клеток |
1 Нормальные клетки снабжают дефектные клетки ДНК или мРНК, в результате последние приобретают способность синтезировать функционально активный фермент
2 Дефектные клетки получают от нормальных готовый фермент. В основе этого предположения аналогия с коррекцией дефектов при мукополисахаридозах (разд. 4 2 2 3). Инкубация культуры фибробластов, дефектных по HPRT, с нормальными клетками, разрушенными ультразвуком, приводила к частичному восстановлению функции фермента.
3. Нормальные клетки синтезируют нуклеотид (конечный продукт), который переносится в дефектные клетки Большинство экспериментальных данных свидетельствует в пользу этого механизма. Если дефектные фибробласты отделить от нормальных клеток, их мутантный фенотип быстро восстанавливается, несмотря на то что нормальная гипоксантин-гуанин—фосфорибозилтрансфераза стабильна в этих условиях в течение многих часов. В другом эксперименте лимфоциты нормальной женщины инкубировали в среде, содержащей меченный тритием гипоксантин. Затем такие клетки смешивали в обычной среде с лимфоцитами мужчины, страдающего синдромом Леша—Найхана. Спустя некоторое время Y-хромосомы мужских клеток с дефектным ферментом, окрашивали акрихинипритом, после чего проводили радиоавтографию. В мужских клетках обнаруживалась метка, что указывало на перенос нуклеотидов из нормальных клеток в дефектные В подобных опытах метаболическая кооперация была продемонстрирована также между преинкубированными нормальными эритроцитами и мутантными лимфоцитами или фибробластами. Оказалось, что в дефектные клетки переносится инозимонофосфат или одно из его производных; по-видимому, активную роль в этом процессе играет мембрана клетки [1053].
Другие проблемы, связанные с недостаточностью HPRT. Дефектная HPRT стала важной модельной системой для изучения мутационного процесса. 1. Эта система дает возможность идентифицировать гемизигот и гетерозигот, измеряя активность фермента в фибробластах, и таким образом сравнивать частоты спонтанных мутаций у мужчин и женщин (разд. 5.15). 2 Ген HPRT экспрессируется в клетках амниотической жидкости, поэтому недостаточность гипоксантин-гуанин—фосфорибозилтрансферазы удается диагностировать с помощью амниоцентеза. Этим дефект HPRT в корне отличается от других патологических состояний, наследуемых сцепленно с Х-хромосомой, например гемофилии или мышечной дистрофии Дюшенна, при которых биохимический дефект не проявляется в клетках амниотической жидкости. 3. Разработана система отбора точковых мутаций в культурах фибробластов, основанная на использовании необычного субстрата, 8-азагуанина. Она позволяет изучать на клеточном уровне возникновение спонтанных и индуцированных мутаций. В нормальных клетках 8-азагуанин утилизируется HPRT, что приводит к гибели клеток. Клетки, дефектные по HPRT, не способны метаболизировать это соединение и выживают.
Иммунная недостаточность, связанная с дефектами аденозиндезаминазы и нуклеозидфосфорилазы (рис 4 21) Дефект другого фермента, участ-
48 4. Действие генов
вующего в метаболизме нуклеозидов, приводит к иному фенотипу. Этот случай тем более интересен, что дефектной является редкая форма полиморфного фермента. Дефекты одного или нескольких компонентов иммунной системы могут обусловливать повышенную восприимчивость к бактериальным инфекциям. Классическим примером такой патологии является гипогаммаглобулинемия, которая наследуется сцепленно с полом и обусловлена дефектом созревания В-лимфоцитов [1092; 1261]. В-лимфоциты служат местом образования гуморальных антител, и их отсутствие приводит к нарушению синтеза γ-глобулинов. Т-лимфоциты обеспечивают клеточный иммунитет и при этом заболевании остаются интактными.
Различают несколько форм иммунной недостаточности. Одна из них, называемая острой комбинированной обусловливает повышенную восприимчивость к заражению самыми разнообразными бактериями, вирусами и грибами. При этой форме нарушены функции как В-, так и Т-лимфоцитов. Иногда оказываются дефектными только Т-лимфоциты. Оказалось, что в основе таких дефектов лежит нарушение дифференцировки стволовых клеток в зрелые лимфоидные клетки [1274; 1267]. Эта группа заболеваний гетерогенна по этиологии, поскольку известны как случаи с аутосомно-рецессивным наследованием, так и варианты, которые наследуются сцепленно с Х-хромосомой. Среди вариантов с аутосомно-рецессивным наследованием обнаружена дополнительная гетерогенность. Так, комбинированная иммунная недостаточность может быть вызвана дефектом аденозиндезаминазы (24275) или нуклеозидфосфорилазы (16405) [1294].
Аденозиндезаминаза (ADA) катализирует необратимое дезаминирование и гидролиз аденозина до инозина и иона аммония. Нуклеозидфосфорилаза катализирует превращение инозина в гипоксантин и гуанозина в гуанин. Она обладает также небольшой активностью, обеспечивающей превращение аденозина в аденин. Эти ферменты играют ключевую роль в метаболизме РНК и ДНК.
Аденозиндезаминаза кодируется геном, локализованным в 20-й хромосоме (разд. 3.4). Электрофорез в крахмальном геле продемонстрировал полиморфизм этого фермента. Наиболее распространенный аллель обозначается ADA1 часто встречающийся полиморфный вариант ADA2. В западных популяциях аллель ADA2 встречается с частотой около 0,05 [1309]. Описаны и другие варианты ADA [1294]. Недостаточность ADA является аутосомно-рецессивным признаком. У больных детей в эритроцитах и других тканях активность аденозиндезаминазы полностью отсутствует [1098]. У их родителей, как правило, обнаруживаются промежуточные количества фермента, при этом клинически они вполне нормальны. У больных родителей выявляется остаточная активность ADA [1294]. Оказалось, что дефекты обусловлены структурными мутациями в гене ADA, которые приводят к почти полной потере функциональной активности фермента у больных гомозигот. Разработана пренатальная диагностика недостаточности аденозиндезаминазы [1126].
Нуклеозидфосфорилаза кодируется локусом в 14-й хромосоме [1096]. Обнаружено несколько редких вариантов фермента [1064]. У больных активность нуклеозидфосфорилазы полностью отсутствует, у родителей активность фермента промежуточная [1294]; заболевание наследуется по аутосомно-рецессивному типу. Иммунологическими методами показано, что по меньшей мере две мутации вызывают недостаточность нуклеозидфосфорилазы [1256]. При одной из них имеется перекрестно реагирующий материал (ПРМ), при другой его нет (см. разд. 4.2.2.2). Предполагается, что это мутации в структурном гене фермента. Вполне возможно, что больные являются не истинными гомозиготами, а составными гетерозиготами с двумя различными мутациями.
Обычно у больных с недостаточностью аденозиндезаминазы сильно нарушена функция В- и Т-лимфоцитов [1294], в то же время при нарушении нуклеозидфосфорилазы функция В-клеток интактна и синтез иммуноглобулинов происходит нормально. При дефекте обоих ферментов наблюдается поразительная дисфункция Т-лимфоцитов. Это проявляется в лимфопении, неспособности лимфоцитов реагировать на митогены и ненормальных кожных реакциях на различные антигены.
Точный биохимический механизм, который приводит к иммунологическим нарушениям в этих случаях, не установлен. Высказывались предположения о том, что недостаточность аденозиндезаминазы обусловливает накопление дезокси-АТР, который ингибирует образование пиримидиновых дезоксирибонуклеотидов, что влечет за собой нарушение синтеза ДНК, пролиферации лимфоцитов и, наконец, иммунного ответа. Недостаточность нуклеозидфосфорилазы может иметь сходный механизм [1294].
Наиболее эффективный метод исправления этих нарушений - пересадка костного мозга. В ряде случаев ослабления клинических симптомов, вызванных недостаточностью аденозиндезаминазы, удавалось добиться переливанием нормальных эритроцитов, которые служили источником недостающего фермента [1266].
4. Действие генов 49