
- •Общая характеристика работы
- •Материалы и методы
- •Результаты исследований
- •Обнаружение типоспецифических антител к вирусу гриппа а птиц.
- •Разработка тест–системы для определения антител к поверхностным антигенам h5 вируса гриппа птиц методом ифа.
- •Получение моноспецифических гипериммунных антисывороток против иммуноглобулинов кур класса g и приготовление иммуноспецифического конъюгата.
- •Подтверждение специфичности результатов иммуноферментного анализа методом иммуноблотинга
- •Ртга для выявления антител к гемагглютининам вируса различных подтипов: h5n1, h7n7, h3n8, h1n1, h13n2, h12n5, h2n3, h4n6, h6n2, h8n4, h9n2, h11n6
- •Выявление антител у кур к общим поверхностным антигенам гетеротипичных вирусов гриппа лошадей.
- •Обсуждение
- •Ретроспективной диагностики гриппа птиц подтипов h7 и h3. Практические предложения
- •Список работ опубликованных по теме диссертации
Результаты исследований
В Таджикистане проблема гриппа птиц изучена не достаточно. В различные годы были обнаружены штаммы нескольких подтипов ВГП: 6-й (1972 г.), 7-й (1976-1978 гг.) и 4-й (1978-1979, 1983-1984 гг.) (Салимов Т.М., Фатхудинова М. Ф. 2008г.).
Исследования, проведенные совместно с сотрудниками Национального центра ветеринарной диагностики и Таджикского научно-исследовательского института профилактической медицины (3945 проб сыворотки крови, 51 трупа птиц - оседлых и перелётно-гнездящиеся видов; 226 трахеальных и клоачных мазков от домашних, диких и синантропных птиц), свидетельствовали об отсутствии в Таджикистане вируса с антигенной формулой H5N1. Однако, полученные результаты нельзя считать окончательными, учитывая неблагополучие по гриппу птиц сопредельных государств, и маршруты перелетных птиц, пролегающих через территорию Республики. Указанное послужило основанием для продолжения наших исследований.
Обнаружение типоспецифических антител к вирусу гриппа а птиц.
Использовали коммерческий набор для ИФА на основе «FLOCKSREEN Avian Influenza virus ELISA KIT (AI)», производитель «x-OvO» Великобритания. Сыворотки для исследования были получены из районов Вахдат, Рашт, Файзобад, Шахринав. Результаты представлены на рис.1.
Как видно из данных на рис. 1, антитела к типоспецифическому белку гриппа А в достоверно- диагностических титрах выявляли в пробах, полученных в 4-х административных районах (Вахдат, Рашт, Файзабад, Шахринав). Наиболее высокие титры антител обнаруживали в сыворотках, полученных из района: Шахринав и в более низких титрах - в пробах из других 3-х районов.
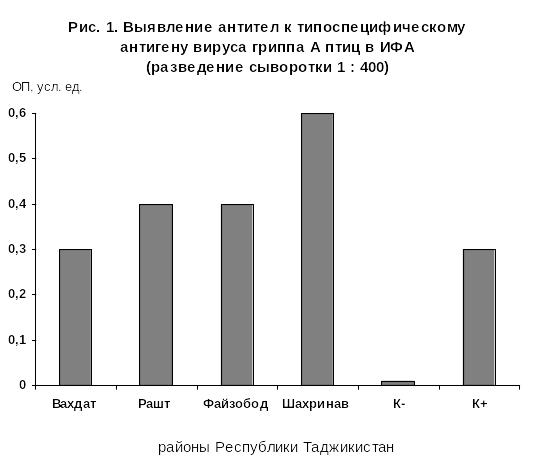
Наличие иммунного ответа у кур на типоспецифический белок вируса гриппа А свидетельствует о циркуляции возбудителя гриппа в популяции птиц на территории Республики Таджикистан. Полученные результаты послужили основанием для продолжения исследований с целью выяснения в плане ретроспективной диагностики подтиповой принадлежности вирусов гриппа птиц.
Первостепенное значение придавали изучению возможной циркуляции высокопатогенного вируса гриппа птиц H5N1. В связи с этим нами была разработана тест система ИФА для выявления антител к поверхностным антигенам этого вируса.
Разработка тест–системы для определения антител к поверхностным антигенам h5 вируса гриппа птиц методом ифа.
Получение антигена. В качестве исходного вируссодержащего материала использовали штамм вируса гриппа птиц «А/сk/Skot/59» (H5N1), предоставленный Центром ВОЗ в порядке научно-технической помощи Республике Таджикистан по программе «Проект по контролю за птичьим гриппом» из музея вирусных штаммов Научно – производственного предприятия «Биологические препараты» Республики Таджикистан.
Для заражения вирусом гриппа птиц использовали 9-10 дневные СПФ куриные эмбрионы. Собранную вируссодержащую жидкость использовали для приготовления антисыворотки (антител) для иммуноферментного анализа (ИФА). Для этого вирус очищали следующим методом: для избавления от дебриса вируссодержащ уюэмбриональную жидкость осветляли низкоскоростным центрифугированием в роторе J2-21N/E (центрифуга BECKMAN) в течение 20 минут при 6 000 об/мин. Из декантированного супернатанта готовили концентрированный вируссодержащий осадок, который был получен после центрифугирования в роторе J2-21N/E (центрифуга BECKMAN) в течение 2-х часов при 20 000 об/мин. Частично очищенную находящуюся в осадке вирусную массу ресуспендировали в физиологическом растворе и наслаивали на градиент 30% - 65% сахарозы. Ультрацентрифугирование проводили в роторе 41 (центрифуга BECKMAN) при 35 000 об/мин, в течение 2-х часов. Опалесцирующую зону отбирали и анализировали в иммуноферментном анализе методом шахматного титрования. По результатом шахматного титрования были определены оптимальные разведения антигена для его дальнейшего использования в иммуноферментном диагностикуме.
