
- •1.Теоретическая часть
- •1.1. Основные понятия электрохимии
- •1.2. Электролиз расплавов и растворов
- •Перемена валентности ионов в растворе в сторону увеличения положительного заряда (или уменьшения отрицательного заряда):
- •1. Масса вещества, образовавшегося в результате электрохимической реакции, прямопропорциональна количеству пропущенного электричества.
- •2. Если через два раствора пропускать одинаковое количество электричества, то массы веществ, образовавшихся при электролизе раствора, пропорциональны их эквивалентным массам.
- •1.3. Теория электролитической диссоциации
- •В полярном растворителе
- •1.4. Закон разведения Оствальда
- •1.5. Активность. Коэффициент активности электролитов
- •1.6. Теория кислот и оснований
- •1.7. Теория сильных электролитов Дебая - Гюккеля
- •1. 8. Удельная электропроводность
- •1.9. Эквивалентная электропроводность
- •1.10. Абсолютная и относительная скорость движения ионов
- •Сила трения выражается формулой Стокса: , (59)
- •Когда обе силы уравновешиваются, то: .
- •1.11. Способы определения чисел переноса
- •1.11.1. Определение чисел переноса по изменению концентрации ионов в приэлектродных слоях
- •1.11.2. Определение чисел переноса по смещению движущейся границы
- •1.12. Кондуктометрический метод анализа
- •1.12.1. Прямая кондуктометрия
- •1.12.2. Кондуктометрическое титрование
- •1.12.2.1.Титрование сильной кислоты сильным основанием
- •1.12.2.2. Титрование слабой кислоты сильным основанием
- •1.12.2.3. Титрование слабой кислоты слабым основанием
- •1.12.2.4. Титрование смеси сильной и слабой кислот сильным основанием
- •1.12.2.5. Титрование соли солью, сопровождающееся образованием осадка
- •2. Тесты
- •3. Контрольные вопросы
- •Список использованной литературы
- •Приложение
- •400131 Волгоград. Просп. Ленина, 28, корп. 1
- •400131 Волгоград. Просп. Ленина, 28, корп. 1
Рис.1 Схема
диссоциации молекулы электролита на
ионы
В полярном растворителе

На диссоциацию влияет не только величина диэлектрической постоянной среды. Большое значение имеет химическое взаимодействие между молекулами растворенного вещества и растворителя (сольватация), сопровождающаяся выделением или поглощением теплоты сольватации. Поэтому одинаково диссоциированные в воде соли по-разному ведут себя в различных растворителях, даже если их диэлектрическая проницаемость будет одинаковой.
1.4. Закон разведения Оствальда
Как уже указывалось, теория электролитической диссоциации, не смотря на ее явные недостатки, со временем добавлялась, расширялась и надстраивалась многими учеными. Вначале был предложен механизм процесса диссоциации. Электролит стали рассматривать как фазу переменного состава. А это означает, что раствор обладает одинаковыми интенсивными свойствами во всех частях и состав его можно менять непрерывно. Однородность раствора является следствием равномерного статистического распределения ионов в среде растворителя. Образование ионов из нейтральных молекул электролита протекает с участием молекул растворителя. Более того, само появление ионов зависит от природы растворителя. Ниже приведенные примеры ярко свидетельствуют о том, что сила электролита зависит не только от растворенного вещества, но и от растворителя (см. табл.2):
Зависимость силы электролита от природы растворителя
и растворенного вещества
Таблица 2
Растворенное вещество |
растворитель |
Тип электролита |
HCl |
вода H2O |
сильный электролит |
HCl |
бензол C6H6 |
неэлектролит |
HCl |
циклогексан C6H12 |
неэлектролит |
CH3COOH |
вода H2О |
слабый электролит |
CH3COOH |
жидкий аммиак NH3 |
сильный электролит |
Об ионизирующей способности растворителя можно судить по электрической проводимости раствора. Замечено, что, наряду с водой, хорошей ионизирующей способностью обладают жидкости с высокой диэлектрической проницаемостью, например, жидкие N - амиды, диметилформамид.
 Диссоциация слабых электролитов –
это обратимый процесс. При любой
температуре в растворе слабого электролита
находятся катионы, анионы и молекулы.
Диссоциация слабых электролитов –
это обратимый процесс. При любой
температуре в растворе слабого электролита
находятся катионы, анионы и молекулы.
Рассмотрим вывод закона Оствальда на примере диссоциации слабого электролита (уксусной кислоты):
CH3COOH = CH3COO- + H+.
Определяем константу диссоциации по формуле:
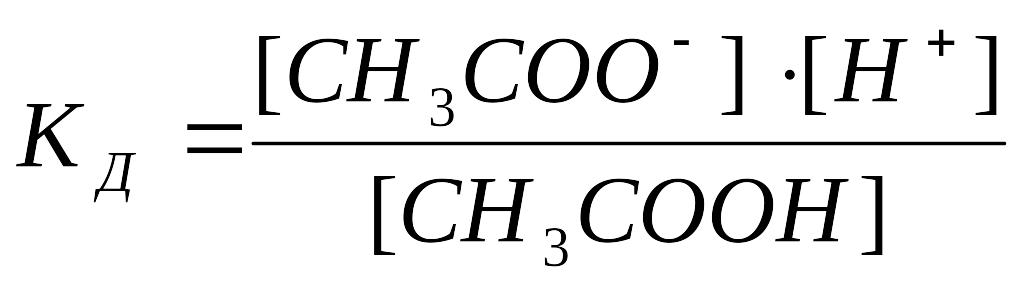 .
.
Допустим, что в V мл раствора содержится а моль вещества уксусной кислоты (CH3COOH), тогда исходная концентрация уксусной кислоты равна:
![]() .
.
Обозначим через X - число молей CH3COOH , распавшихся на ионы, тогда концентрация ионов будет равна:
![]() = [H+] = [CH3COO-
] ,
= [H+] = [CH3COO-
] ,
А концентрация непродиссоциировавших молекул определится как:
![]() = [ CH3COOH] ;
= [ CH3COOH] ;
отсюда константа равновесия равна:
 .
.
Обозначим «Х» через степень
диссоциации:
![]() ,
тогда:
,
тогда:
![]() ,
,
![]() ,
,
![]() .
.
Учитывая,
что
![]() ,
получаем уравнение, которое называется
законом разведения Оствальда:
,
получаем уравнение, которое называется
законом разведения Оствальда:
![]() .
(13)
.
(13)
Для слабых электролитов << 0, тогда знаменатель приблизительно равен 1 и упрощенная форма закона разведения Оствальда будет иметь вид:
КД = 2 ∙C . (14)
Находим отсюда степень диссоциации:
![]() . (15)
. (15)
Степень диссоциации изменяется обратнопропорционально корню квадратному из концентрации. Так, при уменьшении концентрации в 100 раз, степень диссоциации возрастет в 10 раз.
