
- •Потенциометрия
- •Процесс диссоциации и рекомбинации
- •Буферные свойства растворов
- •Измерительная ячейка при потенциометрических измерениях.
- •Водородный электрод
- •Вспомогательный электрод
- •Индикаторные или измерительные электроды
- •Стеклянный электрод
- •Некоторые особенности стеклянных электродов
- •4. Аномалия стеклянных электродов в сильно – кислой и сильно – щелочной области
4. Аномалия стеклянных электродов в сильно – кислой и сильно – щелочной области
Н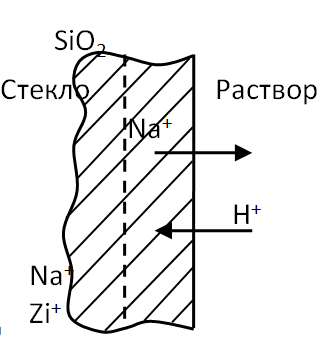 аиболее
полной и общепризнанной в настоящее
время считается теория стеклянного
электрода, созданная советским ученым
Б.П. Никольским.
аиболее
полной и общепризнанной в настоящее
время считается теория стеклянного
электрода, созданная советским ученым
Б.П. Никольским.
Исходным в теории Никольского является предположение о доминирующей роли ионного обмена, являющегося причиной появления разности потенциалов на границе стекло – раствора.
Т.е. потенциал стеклянного электрода изменяется лишь под влиянием ионов, способных передвигаться в стекле. Структура стекла представляется как неподвижный анионовый скелет, внутри которого могут двигаться только катионы, анионы же вследствие одноименности зарядов в стекло не проникают.
Щелочные металлы (Na+, Zi+ ) располагаются внутри силикатной решетки. При погружении стеклянного электрода в раствор эти ионы вытесняются более подвижными и имеющими L меньший радиус ионами водорода, т.е. происходит процесс выщелачивания стекла.
Такой процесс продолжается до наступления состояния равновесия, которое зависит от активной концентрации ионов щелочного металла и ионов водорода в растворе, а также от прочности их связи в стекле и растворе.
Слайд 13
Если раствор кислый и в избытке содержатся ионы Н2 то процесс выщелачивания происходит очень полно и стеклянный электрод приобретает полностью свойства водородного. Иной результат при погружении в щелочную среду, особенно при большой концентрации щелочного металла. Здесь свободные места в кристаллической решетке стекла будут занимать не ионы водорода, а щелочного металла. И процесс идет тем интенсивнее, чем меньше радиус катиона из раствора по сравнению с радиусом катиона щелочного металла стекла.
Щелочные ионы Li+ – 0,78 Å; Na+ – 0,98 Å; К+ – 1,38 Å; Cs+ – 1,65 Å.
Н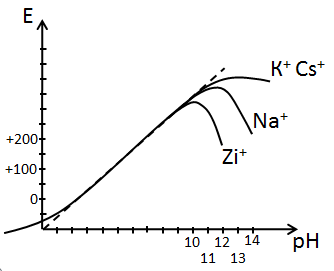 аименее
восприимчиво по отношению к щелочным
катионам в растворе должно быть литиевое
стекло. Наибольшее отклонение имеют
натриевые стекла в растворах содержащих
ионы Na+
и
Zi+
.
аименее
восприимчиво по отношению к щелочным
катионам в растворе должно быть литиевое
стекло. Наибольшее отклонение имеют
натриевые стекла в растворах содержащих
ионы Na+
и
Zi+
.
Отсюда видно почему в значительной области изменения рН характеристика стеклянного электрода полностью совпадает с характеристикой водородного электрода. И лишь в сильно кислых и сильно щелочных областях у водородной функции стеклянного электрода наблюдаются отклонения, называемые соответственно кислотной и щелочной ошибкой, которые зависят главным образом от химического состава стекла.
Слайд 14
По мере развития теоретических и экспериментальных исследований были созданы специальные сорта стекла, пригодные для измерения во всей области значений от 0 до 14 рН, в том числе и при высоких температурах растворов.
Беневольский предложил ряд рецептур стекол марки 5079 для применения в различных условиях:

В сильно щелочных растворах, особенно при большой концентрации в них ионов Na равновесный потенциал устанавливается при почти полном сохранении своих мест ионами Na в поверхностном слое стекла и здесь электрод проявляет натриевую функцию.
Слайд 15
Поэтому
на основании изложенных представлений
Никольский предложил уравнение для
потенциала стеклянного электрода:
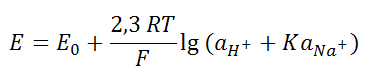
где
![]() и
и
![]() – активность ионов Н и Na
в растворе; К – константа равновесия
или обмена ионов водорода и натрия,
характеризующая разницу в проточности
связи указанных ионов со стеклом по
сравнению со связью из с растворителем
в растворе:
– активность ионов Н и Na
в растворе; К – константа равновесия
или обмена ионов водорода и натрия,
характеризующая разницу в проточности
связи указанных ионов со стеклом по
сравнению со связью из с растворителем
в растворе:

а – активность ионов в растворе
с – концентрация ионов в стекле
Константа «К» характеризует относительное сродство к стеклу ионов водорода и ионов щелочного металла и зависит от состава стекла.
Как показывают исследования при наличии в стекле одних компонентов «сродство стекла» по отношению к ионам щелочного металла будет мало по сравнению с ионами водорода.
При
этом «К» будет иметь малое значение:
![]()
Слайд 16
При этом потенциал стеклянного электрода в широкой области рН будет определяться уравнением:
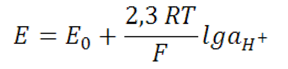
Таким образом ионообменная теория стеклянного электрода теоретически обосновывает возможность перехода стеклянного электрода от водородной фракции к натриевой.
Слайд 17






