
- •Типи хімічних зв’язків та їх основні характеристики
- •Будова атома карбону
- •Метод валентних зв’язків
- •Метод мо лкао
- •Класифікація органічних реакцій
- •Класифікація органічних реакцій за типами хімічних перетворень зв’язків
- •Класифікація органічних реакцій за типами розриву зв’язку
- •Класифікація органічних реакцій за типами реагентів
- •Проміжні частинки в органічних реакціях. Взаємний вплив атомів молекулах
- •Алкани (парафіни)
- •Способи одержання алканів
- •Хімічні властивості алканів
- •Окиснення
- •Алкени (олефіни)
- •Способи добування алкенів
- •Дегідратація спиртів (відщеплення води).
- •Дегалогенування віцинальних дігалогеналканів (відщеплення галогенів)
- •Часткове гідрування (відновлення) алкінів (ацетиленів)
- •Хімічні властивості
- •Це явище обумовлене високою стабілізацією алільного проміжного радикалу за рахунок ефекту спряження. Внаслідок, при термічному хлоруванні пропілену:
- •Алкадієни
- •Методи добування
- •Дегідрування бутан-бутиленової бо пентан-пентенової фракції:
- •Дегідратація 1,3- та 1,4- гліколей:
- •Промисловий метод Лєбєдєва із спирту:
- •Електронна бувова спряжених дієнів
- •Хімічні властивості
- •Гідрування.
- •Приєднання галогенів
- •Алкіни (ацетиленові вуглеводні)
- •Методи добування алкінів
- •Аліциклічні сполуки
- •Ароматичні вуглеводні
- •Ароматичні вуглеводні ряду бензолу
- •Добування бензолу та його гомологів
- •Хімічні властивості
- •Прaвила орієнтації електрофільного замііщення в бензольному ядрі
- •Гетероциклічні сполуки
- •Пятичленні гетероциклічні сполуки
- •Способи одержання
- •Хімічні властивості
- •Реакції електрофільного заміщення
- •Шестичленні гетероциклічні сполуки
- •Ароматичні вуглеводні з конденсованими бензольними ядрами нафталін
- •Хімічні властивості
- •Антрацен
- •Загальні методи одержання
- •Хімічні властивості мос (загальні реакції) Магнійорганічні сполуки
- •Перегрупування Арбузова:
- •Галогенпохідні вуглеводнів Галогенпохідними називають сполуки, які містять зв’язки карбон-галоген. Поділяють на
- •Методи добування моногалогенпохідних
- •Хімічні властивості
- •Ароматичні сульфокислоти
- •Хімічні властивості сульфокислот визначаються наявністю сульфогрупи і їх можна розділити на три типи:
- •Реакції сульфогрупи
- •Реакції заміщення сульфогрупи на групи –он; –cn; –nh2.
- •Одно- і багатоатомні спирти
- •Методи одержання спиртів
- •V. Гідрування кетонів.
- •Феноли. Хінони. Методи одержання фенолів
- •Рекція Кольбе-Шмідта – одержання саліцилової кислоти (аспірин)
- •Альдегіди і кетони
- •Способи одержання альдегідів і кетонів
- •Азотовмісні органічні сполуки нітросполуки
- •Способи одержання нітросполук
- •Способи одержання жирно-ароматичних нітросполук
- •Рідкофазне нітруваня за Коноваловим
- •Нуклеофільне заміщення галогену на нітрогрупу
- •Одержання ароматичних нітросполук
- •Хімічні властивості
- •Реакції відновлення з утворенням амінів
- •Класифікація
- •Способи одержання амінів для первинних амінів
- •Для вторинних амінів
- •Для третинних амінів
- •Хімічні властивості
- •Основність амінів
- •Порівняння основності амінів
- •Ароматичні діазо- і азосполуки
- •Реакції діазосполук з виділенням азоту
- •Реакції без виділення азоту
- •Карбонові кислоти
- •Методи одержання одноосновних карбонових кислот
- •6. Реакції окиснення: насичених, ароматичних вуглеводнів, альдегідів і кетонів
- •Гідроліз галогенопохідних
- •Хімічні властивості карбонових кислот
- •Ненасичені кислоти Найпростіші ненасичені одноосновні кислоти:
- •Двохосновні карбонові кислоти
- •Способи одержання двохосновних карбонових кислот
- •Хімічні властивості
- •Кислотні властивості.
- •Реакції за карбоксильною групою
- •Реакції за карбоксильною групою
- •Особливості хімічних властивостей дикарбонових кислот
- •Хімічні властивості
- •Хімічні властивості.
- •Аминокислоты с неполярными или гидрофобными r – группами
- •Аминокислоты с незаряженными полярными r – группами.
Хімічні властивості алканів
Для алканів характерні реакції заміщення та розщеплення. Розщеплення по зв’язку С-С вимагає меншої енергії (350 кДж/моль), ніж по зв’язку С-Н (413,7 кДж/моль). Але хімічні реакції здебільшого проходять по зв’язку С-Н, оскільки ці зв’язки більш доступні для реагентів.
І. Реакції заміщення. Місце входження замісники в молекулу насиченого вуглеводню визначається в першу чергу енергією зв’язку, вірогідність утворення та відносною стабільністю в ряду трет > втор > перв за рахунок прояву ефекту надспряження, то і енергія зв’язку С-Н збільшується у цьому ж напрямку:
Енергія звязку, кДж/моль |
422,9 |
401,9 |
393,6 |
372,6 |
Сполука |
|
|
|
|
Галогенування. Реакційна здатність зменшується в ряду F>Cl>Br>I. Реакція з F2 проходить з вибухом, тому потрібно розведення інертним газом, наприклад, аргоном. Реакція з Cl2 та Br2 вже потребує високої температури (3000С) або ініціювання світлом. Реакція з I2 практично не відбувається.
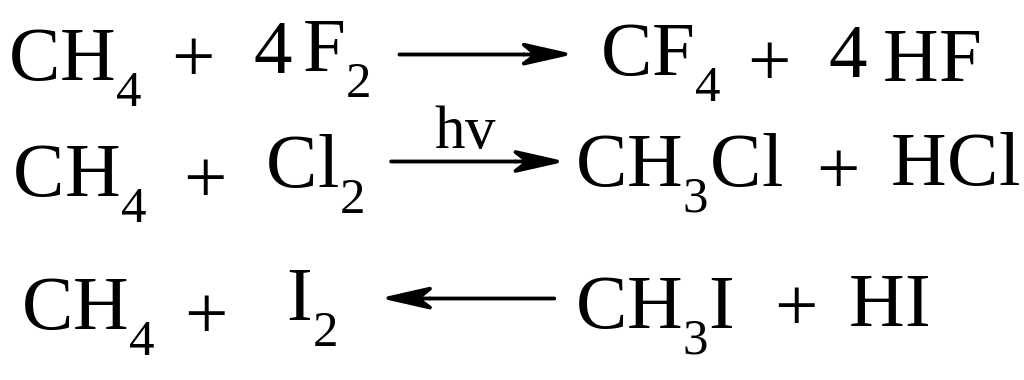
Відносна швидкість заміщення при хлоруванні: перв. (1); втор. (3,25); трет.(4,3)
Механізм реакції галогенування:
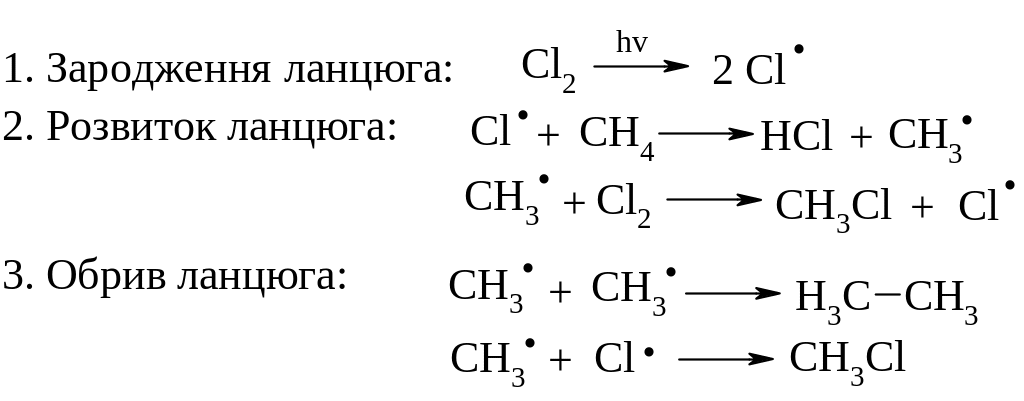
Нітрування розведеною нітратною кислотою за Коноваловим, парофазне нітрування при 250-5000С
![]()
Механізм реакції:
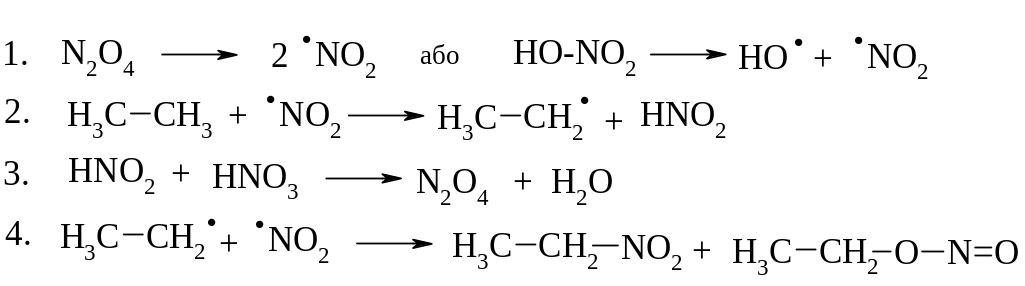
3. Сульфохлорування
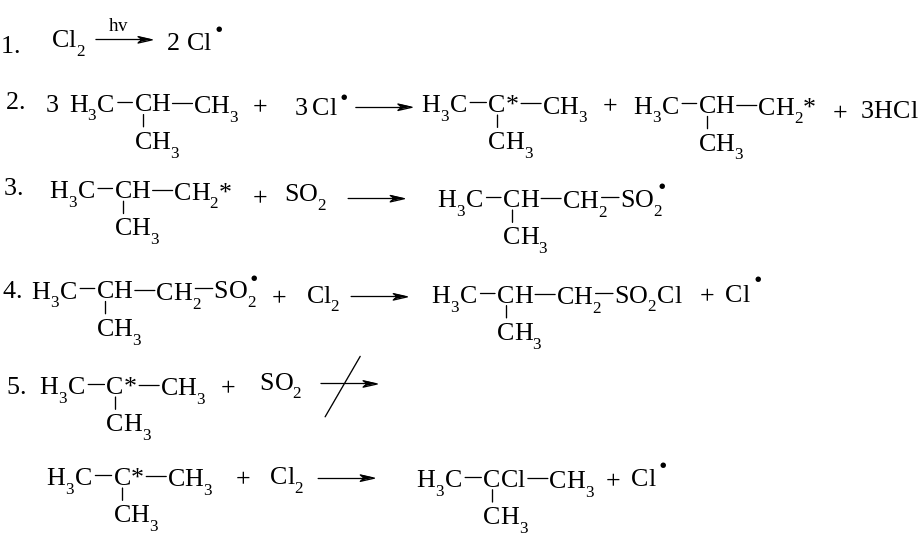
Сульфохлорування відбуваєтьтся лише за первинними та вторинними атомами карбону. Із-за просторових затруднень воно не можливе для третинних атомів карбону.
Сульфоокиснення:
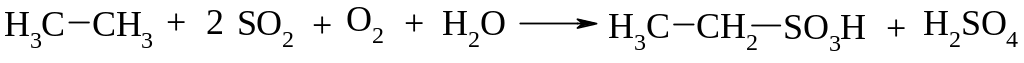
Окиснення
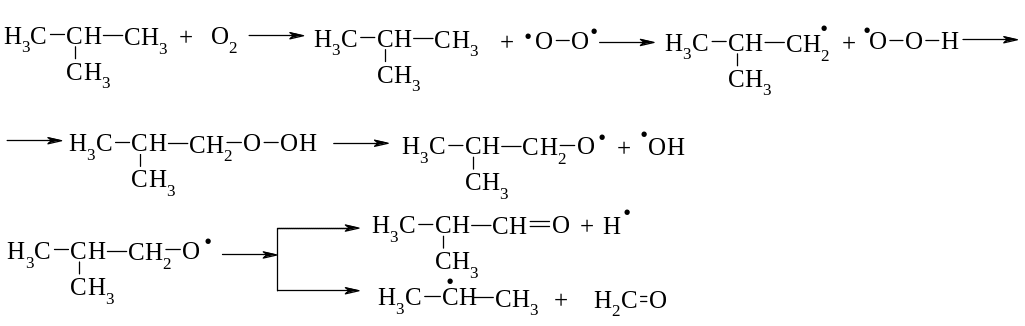
Крекінг:
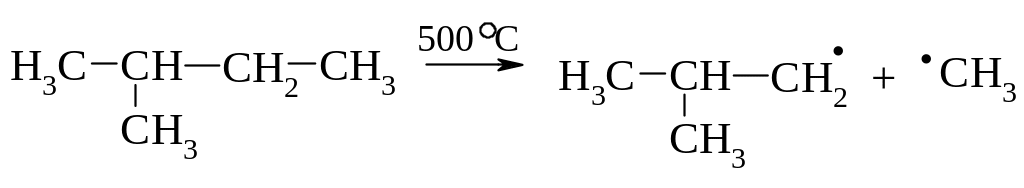
Диспропорціювання; 2. Рекомбінація; 3. β-розклад
Алкени (олефіни)
Алкенами називають вуглеводні, в молекулах яких знаходяться атоми вуглецю, які витрачають на з’єднання з сусіднім атомом карбону дві валентності, тобто утворюють подвійний зв’язок. Алкени утворюють гомологічний ряд загальної формули CnH2n
Способи добування алкенів
І. Реакції відщеплення
Дегідрування та піроліз алканів (промисловий спосіб) - відщеплення водню. Швидкість утворення алкенів та їх відносна стабільність зменшується в ряду:
R2C=CR2 > R2C=CHR > R2C=CH2 > RCH=CHR > RCH=CH2 > H2C=CH2 , тобто із зменшенням числа замісників у подвійного зв’язку. Чим стабільніший алкен, тим легше він утворюється.
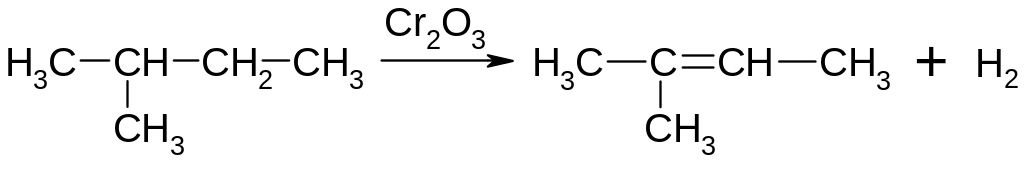
Дегідратація спиртів (відщеплення води).
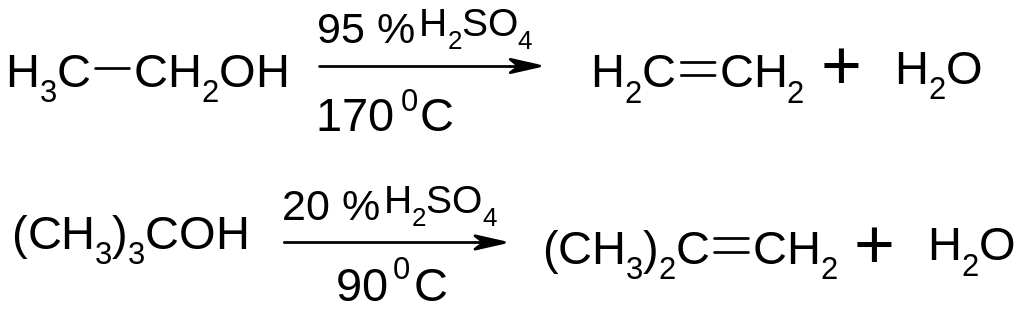
Легкість дегідратації спиртів зростає в ряду первинний вторинний третинний. Правило Зайцева: в реакціях дегідратації або дегідрогалогенування найбільш легко відщеплюється атом водню від найменш гідрогенізованого (насиченого воднем) атому карбону, сусіднього по відношенню до атому карбону, який несе гідроксильну групу або атом галогену.
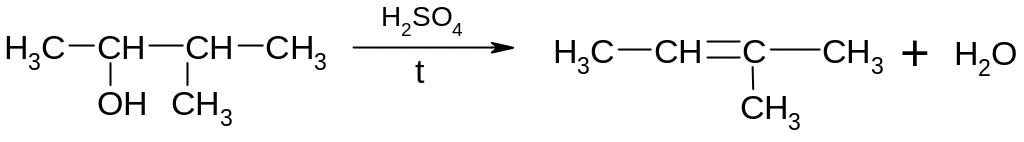
Причини цього явища:
Міцність зв’язків С-Н зменшується в ряду:
первинний атом Карбону > вторинний атом Карбону > третинний атом Карбону
Зростає стабільність алкенів, що утворилися, так як утворюється більш розгалужений алкен, який потребує меншої енергії активації процесу відщеплення.
Дегідрогалогенування галогеналканів (відщеплення галогеноводнів). Відбувається за правилом Зайцева.

