
- •Типи хімічних зв’язків та їх основні характеристики
- •Будова атома карбону
- •Метод валентних зв’язків
- •Метод мо лкао
- •Класифікація органічних реакцій
- •Класифікація органічних реакцій за типами хімічних перетворень зв’язків
- •Класифікація органічних реакцій за типами розриву зв’язку
- •Класифікація органічних реакцій за типами реагентів
- •Проміжні частинки в органічних реакціях. Взаємний вплив атомів молекулах
- •Алкани (парафіни)
- •Способи одержання алканів
- •Хімічні властивості алканів
- •Окиснення
- •Алкени (олефіни)
- •Способи добування алкенів
- •Дегідратація спиртів (відщеплення води).
- •Дегалогенування віцинальних дігалогеналканів (відщеплення галогенів)
- •Часткове гідрування (відновлення) алкінів (ацетиленів)
- •Хімічні властивості
- •Це явище обумовлене високою стабілізацією алільного проміжного радикалу за рахунок ефекту спряження. Внаслідок, при термічному хлоруванні пропілену:
- •Алкадієни
- •Методи добування
- •Дегідрування бутан-бутиленової бо пентан-пентенової фракції:
- •Дегідратація 1,3- та 1,4- гліколей:
- •Промисловий метод Лєбєдєва із спирту:
- •Електронна бувова спряжених дієнів
- •Хімічні властивості
- •Гідрування.
- •Приєднання галогенів
- •Алкіни (ацетиленові вуглеводні)
- •Методи добування алкінів
- •Аліциклічні сполуки
- •Ароматичні вуглеводні
- •Ароматичні вуглеводні ряду бензолу
- •Добування бензолу та його гомологів
- •Хімічні властивості
- •Прaвила орієнтації електрофільного замііщення в бензольному ядрі
- •Гетероциклічні сполуки
- •Пятичленні гетероциклічні сполуки
- •Способи одержання
- •Хімічні властивості
- •Реакції електрофільного заміщення
- •Шестичленні гетероциклічні сполуки
- •Ароматичні вуглеводні з конденсованими бензольними ядрами нафталін
- •Хімічні властивості
- •Антрацен
- •Загальні методи одержання
- •Хімічні властивості мос (загальні реакції) Магнійорганічні сполуки
- •Перегрупування Арбузова:
- •Галогенпохідні вуглеводнів Галогенпохідними називають сполуки, які містять зв’язки карбон-галоген. Поділяють на
- •Методи добування моногалогенпохідних
- •Хімічні властивості
- •Ароматичні сульфокислоти
- •Хімічні властивості сульфокислот визначаються наявністю сульфогрупи і їх можна розділити на три типи:
- •Реакції сульфогрупи
- •Реакції заміщення сульфогрупи на групи –он; –cn; –nh2.
- •Одно- і багатоатомні спирти
- •Методи одержання спиртів
- •V. Гідрування кетонів.
- •Феноли. Хінони. Методи одержання фенолів
- •Рекція Кольбе-Шмідта – одержання саліцилової кислоти (аспірин)
- •Альдегіди і кетони
- •Способи одержання альдегідів і кетонів
- •Азотовмісні органічні сполуки нітросполуки
- •Способи одержання нітросполук
- •Способи одержання жирно-ароматичних нітросполук
- •Рідкофазне нітруваня за Коноваловим
- •Нуклеофільне заміщення галогену на нітрогрупу
- •Одержання ароматичних нітросполук
- •Хімічні властивості
- •Реакції відновлення з утворенням амінів
- •Класифікація
- •Способи одержання амінів для первинних амінів
- •Для вторинних амінів
- •Для третинних амінів
- •Хімічні властивості
- •Основність амінів
- •Порівняння основності амінів
- •Ароматичні діазо- і азосполуки
- •Реакції діазосполук з виділенням азоту
- •Реакції без виділення азоту
- •Карбонові кислоти
- •Методи одержання одноосновних карбонових кислот
- •6. Реакції окиснення: насичених, ароматичних вуглеводнів, альдегідів і кетонів
- •Гідроліз галогенопохідних
- •Хімічні властивості карбонових кислот
- •Ненасичені кислоти Найпростіші ненасичені одноосновні кислоти:
- •Двохосновні карбонові кислоти
- •Способи одержання двохосновних карбонових кислот
- •Хімічні властивості
- •Кислотні властивості.
- •Реакції за карбоксильною групою
- •Реакції за карбоксильною групою
- •Особливості хімічних властивостей дикарбонових кислот
- •Хімічні властивості
- •Хімічні властивості.
- •Аминокислоты с неполярными или гидрофобными r – группами
- •Аминокислоты с незаряженными полярными r – группами.
Алкани (парафіни)
Алкани або насичені вуглеводні – це такі сполуки карбону з гідрогеном, в молекулах яких кожний атом карбону на з’єднання з любим сусіднім атомом карбону витрачає лише один зв’язок; при цьому всі вільні валентності насичені гідрогеном. Всі атоми карбону знаходяться в sp3-гібридизованому стані.
Насичені вуглеводні утворюють гомологічний ряд з загальною формулою CnH2n+2. Члени гомологічного ряду відрізняються один від іншого на гомологічну різницю (СН2)Х.
Починаючи з бутану вуглеводні: утворюють структурні ізомери – сполуки, які мають одну брутто-формулу, але різну структуру внаслідок різного взаємного з’єднання атомів карбону. Наприклад, бутан та ізобутан. Структурні ізомери мають різні фізичні та хімічні властивості.
Окрім
структурної ізомерії алкани мажуть
мати оптичну ізомерію, при якій утворюються
стереоізомери
– молекули з однаковою брутто-формулою
та структурною формулою, які відрізняються
взаємним просторовим розташуванням
атомів в молекулах. Наприклад:
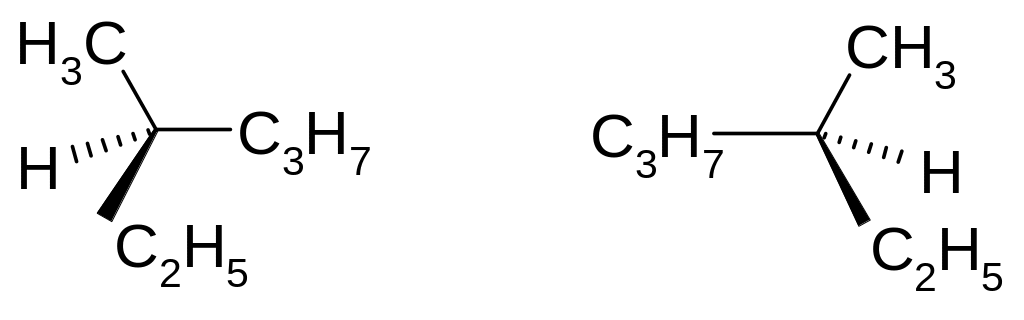 .
Стереоізомери не можна сумістити в
просторі. Стереоізомери, які відносяться
один до одного як дзеркальні відображення,
називаються енантіомерами.
Енантіомери мають центр
асиметрії або
хіральний центр
– атом карбону, який має чотири різних
замісники. Енантіомери мають майже всі
однакові хімічні та фізичні властивості.
З фізичної точки зору енантіомери
відрізняються лише знаком кута оптичного
обертання: один енантіомер відхиляє
плоскополяризований промінь світла
вправо (+ енантіомер), другий – вліво (-
енантіомер). Хімічні властивості
енантіомерів в ахіральному (не
асиметричному) середовищі однакові, в
хоральному (асиметричному) відрізняються
швидкістю здійснення реакції.
.
Стереоізомери не можна сумістити в
просторі. Стереоізомери, які відносяться
один до одного як дзеркальні відображення,
називаються енантіомерами.
Енантіомери мають центр
асиметрії або
хіральний центр
– атом карбону, який має чотири різних
замісники. Енантіомери мають майже всі
однакові хімічні та фізичні властивості.
З фізичної точки зору енантіомери
відрізняються лише знаком кута оптичного
обертання: один енантіомер відхиляє
плоскополяризований промінь світла
вправо (+ енантіомер), другий – вліво (-
енантіомер). Хімічні властивості
енантіомерів в ахіральному (не
асиметричному) середовищі однакові, в
хоральному (асиметричному) відрізняються
швидкістю здійснення реакції.
Стереоізомери які мають два або більше хіральних атомів карбону і не являються енантіомерами називають діастереомерами. Наприклад:
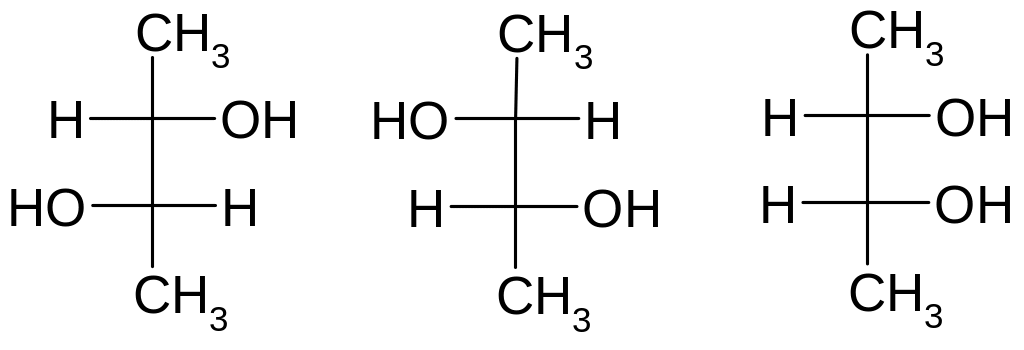 -
Проекційні
формули Фішера
-
Проекційні
формули Фішера
Діастереомери, на відміну від енантіомерів мають різні фізичні і хімічні властивості.
Для алканів характерне також явище поворотної ізомерії, яке реалізується внаслідок вільного обертання груп атомів навколо простого зв’язку С-С. Поворотні ізомери називаються конформерами. Серед безлічі конформерів, які можливі для молекули, починаючи з етану, відрізняють два конформери, які мають спеціальні назви. Це найбільш енергетично вигідний конформер, який має найменшу внутрішню енергію – загальмований конформер, та найменш вигідний конформер – заслонений конформер.
Проекційна
формула Ньюмена:
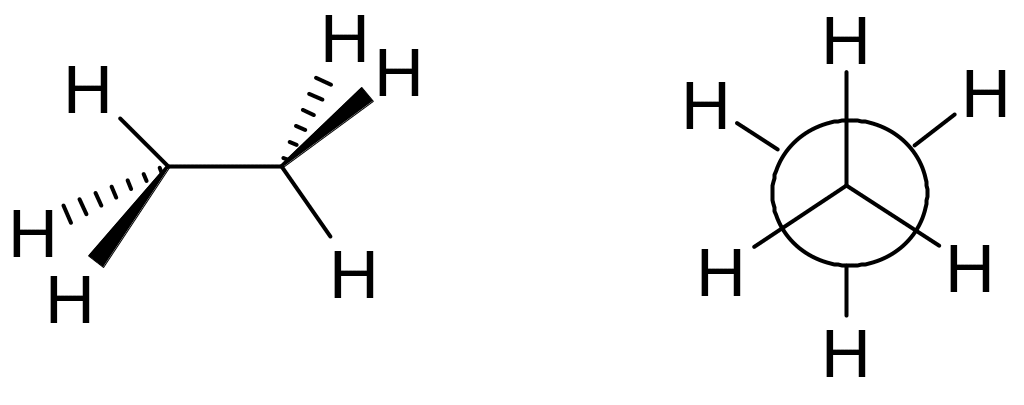
Різниця в енергіях конформерів обумовлена не валентними взаємодіями, тобто різним відштовхуванням електронів σ- зв’язків та атомів один від одного.
Способи одержання алканів
І. Промислові способи
З природних джерел – газ, нафта та методи їх переробки.
Синтез Фішера-Тропша з карбон (ІІ) оксиду та гідрогену:
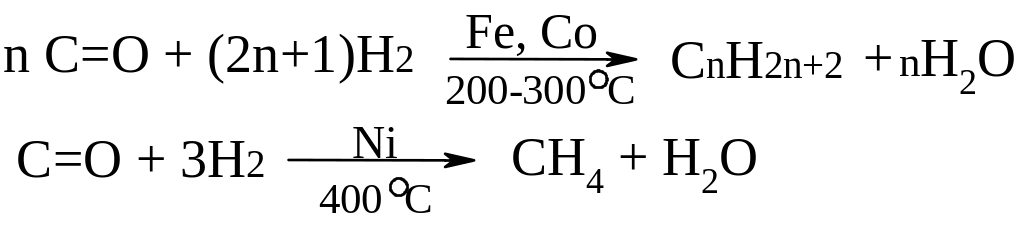
ІІ. Лабораторні способи
Реакція Вюрца
![]()
Схема реакції:
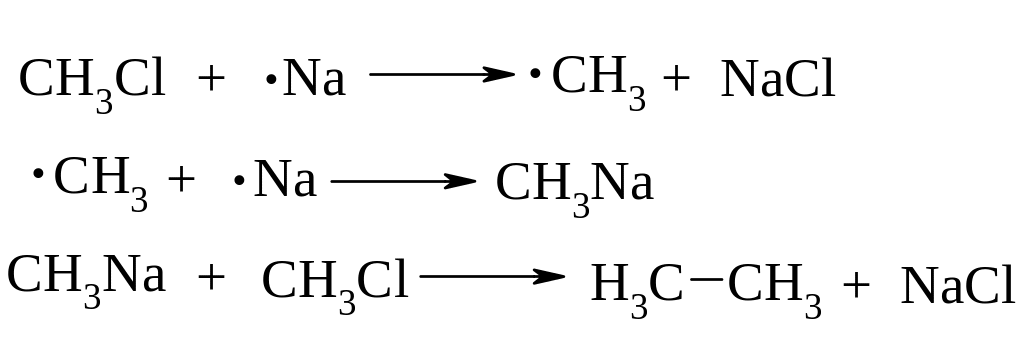
В
реакцію Вюрца переважно вступають
нерозгалужені галоїдні алкіли. При
взаємодії з Na
суміші алоїдних алкілів утворюється
суміш алканів. Наприклад:
![]()
Реакція Кольбе – електрохімічне відновлення солей карбонових кислот
![]()
Схема реакції:
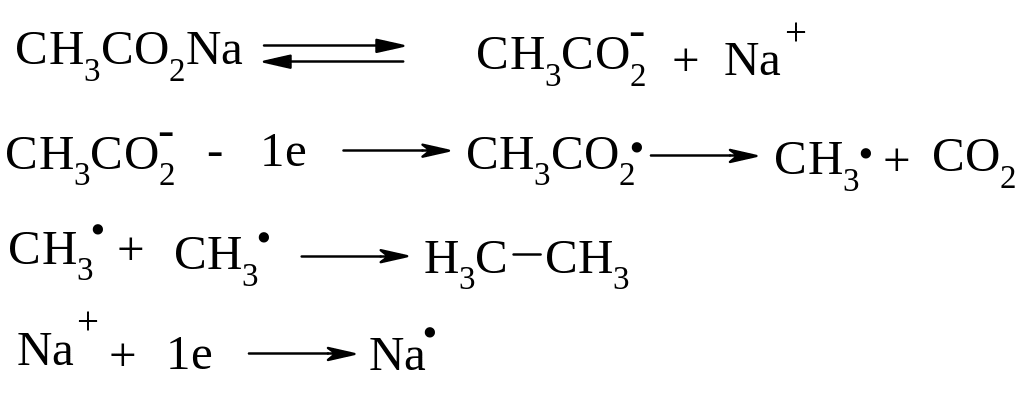
Декарбоксилування солей карбонових кислот
![]()
