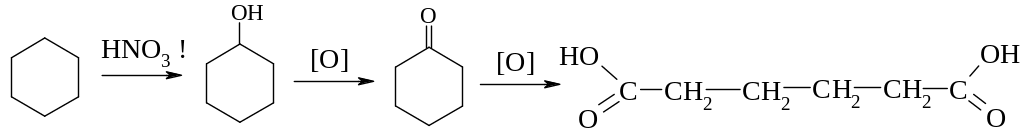- •Типи хімічних зв’язків та їх основні характеристики
- •Будова атома карбону
- •Метод валентних зв’язків
- •Метод мо лкао
- •Класифікація органічних реакцій
- •Класифікація органічних реакцій за типами хімічних перетворень зв’язків
- •Класифікація органічних реакцій за типами розриву зв’язку
- •Класифікація органічних реакцій за типами реагентів
- •Проміжні частинки в органічних реакціях. Взаємний вплив атомів молекулах
- •Алкани (парафіни)
- •Способи одержання алканів
- •Хімічні властивості алканів
- •Окиснення
- •Алкени (олефіни)
- •Способи добування алкенів
- •Дегідратація спиртів (відщеплення води).
- •Дегалогенування віцинальних дігалогеналканів (відщеплення галогенів)
- •Часткове гідрування (відновлення) алкінів (ацетиленів)
- •Хімічні властивості
- •Це явище обумовлене високою стабілізацією алільного проміжного радикалу за рахунок ефекту спряження. Внаслідок, при термічному хлоруванні пропілену:
- •Алкадієни
- •Методи добування
- •Дегідрування бутан-бутиленової бо пентан-пентенової фракції:
- •Дегідратація 1,3- та 1,4- гліколей:
- •Промисловий метод Лєбєдєва із спирту:
- •Електронна бувова спряжених дієнів
- •Хімічні властивості
- •Гідрування.
- •Приєднання галогенів
- •Алкіни (ацетиленові вуглеводні)
- •Методи добування алкінів
- •Аліциклічні сполуки
- •Ароматичні вуглеводні
- •Ароматичні вуглеводні ряду бензолу
- •Добування бензолу та його гомологів
- •Хімічні властивості
- •Прaвила орієнтації електрофільного замііщення в бензольному ядрі
- •Гетероциклічні сполуки
- •Пятичленні гетероциклічні сполуки
- •Способи одержання
- •Хімічні властивості
- •Реакції електрофільного заміщення
- •Шестичленні гетероциклічні сполуки
- •Ароматичні вуглеводні з конденсованими бензольними ядрами нафталін
- •Хімічні властивості
- •Антрацен
- •Загальні методи одержання
- •Хімічні властивості мос (загальні реакції) Магнійорганічні сполуки
- •Перегрупування Арбузова:
- •Галогенпохідні вуглеводнів Галогенпохідними називають сполуки, які містять зв’язки карбон-галоген. Поділяють на
- •Методи добування моногалогенпохідних
- •Хімічні властивості
- •Ароматичні сульфокислоти
- •Хімічні властивості сульфокислот визначаються наявністю сульфогрупи і їх можна розділити на три типи:
- •Реакції сульфогрупи
- •Реакції заміщення сульфогрупи на групи –он; –cn; –nh2.
- •Одно- і багатоатомні спирти
- •Методи одержання спиртів
- •V. Гідрування кетонів.
- •Феноли. Хінони. Методи одержання фенолів
- •Рекція Кольбе-Шмідта – одержання саліцилової кислоти (аспірин)
- •Альдегіди і кетони
- •Способи одержання альдегідів і кетонів
- •Азотовмісні органічні сполуки нітросполуки
- •Способи одержання нітросполук
- •Способи одержання жирно-ароматичних нітросполук
- •Рідкофазне нітруваня за Коноваловим
- •Нуклеофільне заміщення галогену на нітрогрупу
- •Одержання ароматичних нітросполук
- •Хімічні властивості
- •Реакції відновлення з утворенням амінів
- •Класифікація
- •Способи одержання амінів для первинних амінів
- •Для вторинних амінів
- •Для третинних амінів
- •Хімічні властивості
- •Основність амінів
- •Порівняння основності амінів
- •Ароматичні діазо- і азосполуки
- •Реакції діазосполук з виділенням азоту
- •Реакції без виділення азоту
- •Карбонові кислоти
- •Методи одержання одноосновних карбонових кислот
- •6. Реакції окиснення: насичених, ароматичних вуглеводнів, альдегідів і кетонів
- •Гідроліз галогенопохідних
- •Хімічні властивості карбонових кислот
- •Ненасичені кислоти Найпростіші ненасичені одноосновні кислоти:
- •Двохосновні карбонові кислоти
- •Способи одержання двохосновних карбонових кислот
- •Хімічні властивості
- •Кислотні властивості.
- •Реакції за карбоксильною групою
- •Реакції за карбоксильною групою
- •Особливості хімічних властивостей дикарбонових кислот
- •Хімічні властивості
- •Хімічні властивості.
- •Аминокислоты с неполярными или гидрофобными r – группами
- •Аминокислоты с незаряженными полярными r – группами.
Ненасичені кислоти Найпростіші ненасичені одноосновні кислоти:
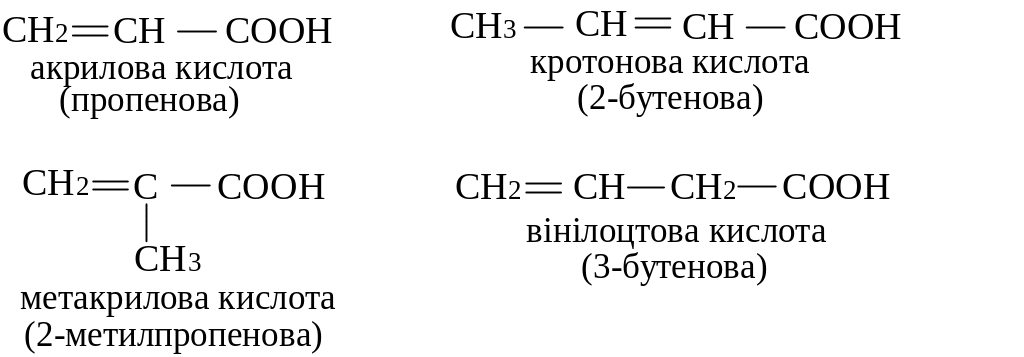
Ненасичені кислоти можуть існувати у вигляді двох геометричних ізомерів – цис-транс:
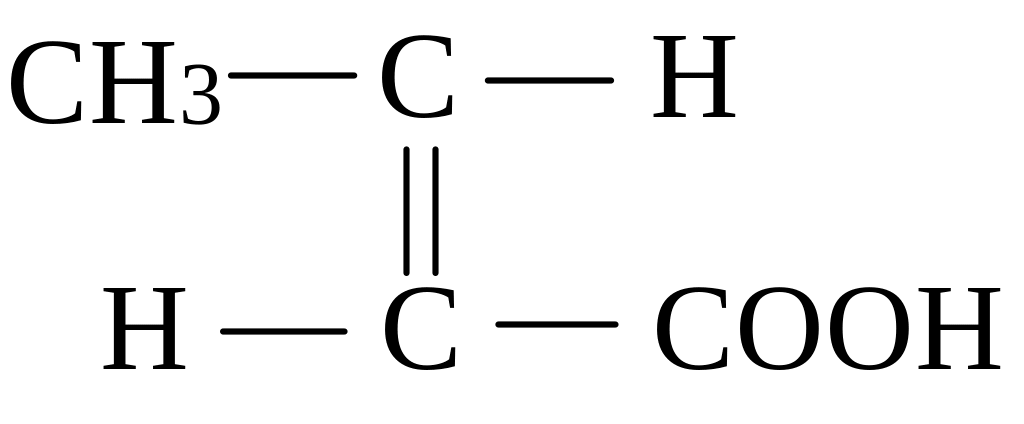
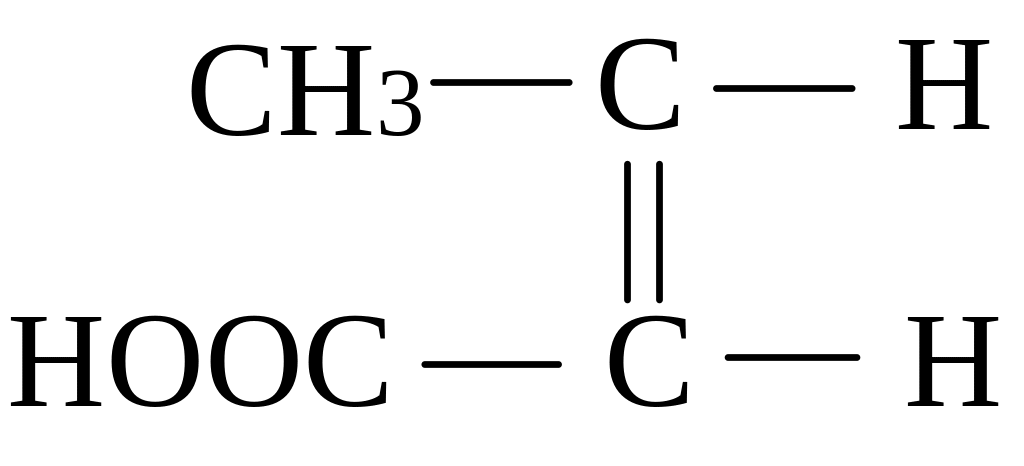
транс-ізомер (кротонова кислота) цис-ізомер (ізокротонова кислота)
(tпл. = 720С, tкип. = 1890С) (tпл. = 15,50С, tкип. = 1720С)
Найчастіше одноосновні кислоти мають вищі кислотні властивості, ніж відповідні насичені. Пояснюється це взаємним впливом (спряженням) карбоксильної групи та подвійного зв’язку. Вплив подвійного зв’язку на кислотність зменшується по мірі віддалення подвійного зв’язку від карбоксильної групи. Тому вінілоцтова кислота сильніша за аллілоцтову.
![]()
Ка = 4,6·10 -5 Ка = 2,1·10 -5
Характерною особливістю ненасичених кислот та їх ефектів є полімеризація з утворенням полімерів (органічного скла) з цінними технологічними властивостями. Такі полімери мають ланцюгову структуру:
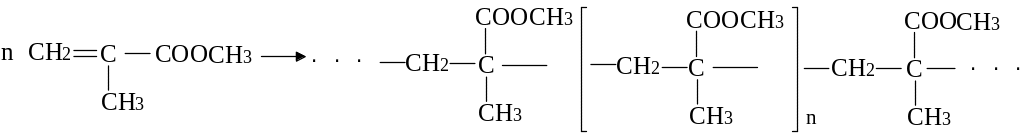
метиловий ефір метакрилової кислоти
(метилметакрилат)
Важливе похідне акрилової кислоти її нітрил (акрилонітрил), який застосовується в реакціях полімеризації та співполімеризації при синтезі, наприклад, бутадієн-нітрильного каучуку.
Ненасичені двохосновні кислоти – малеїнові та фумарова теж існують як два структурні ізомери:
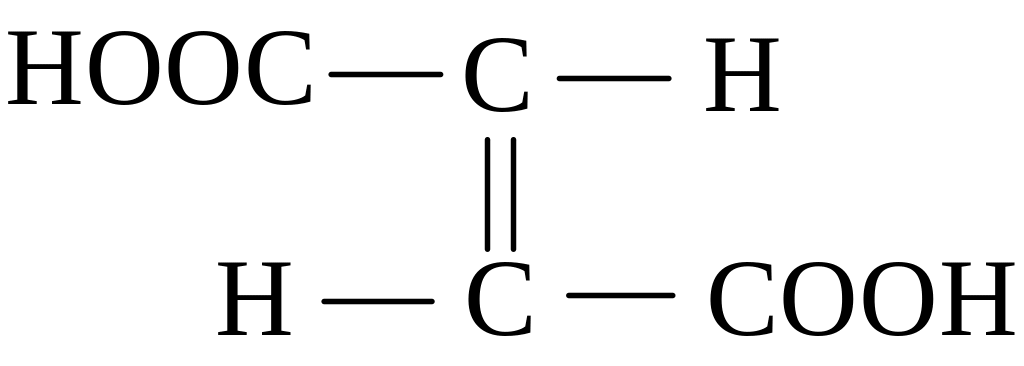
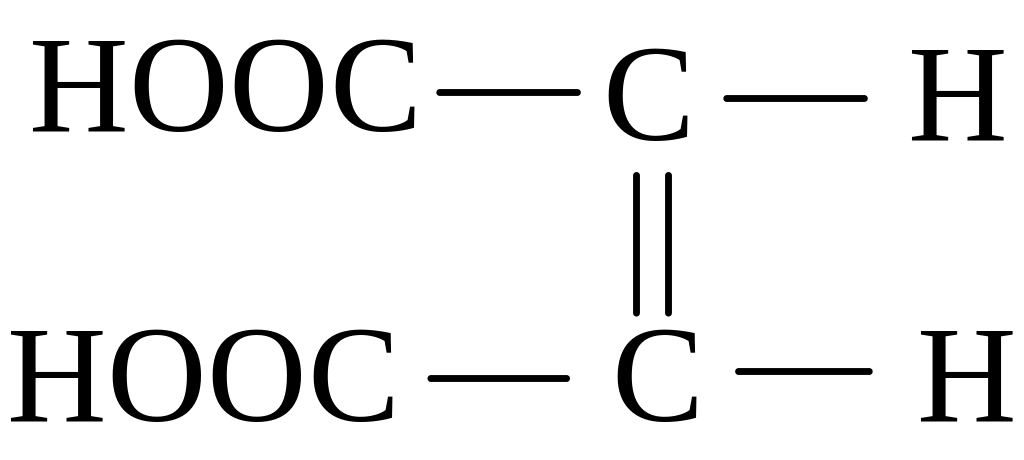
транс-ізомер (фумарова кислота) цис-ізомер (малеїнова кислота)
(tпл. = 2880С) (tпл. = 1300С)
Обидві кислоти дають характерні реакції на подвійний зв’язок (знбарвлюють бромну воду, перманганат калію), а також реакції за карбоксильної групою (моно - або - дипохідні).
Особливість малеїнової кислоти – утворення циклічного ангідриду:
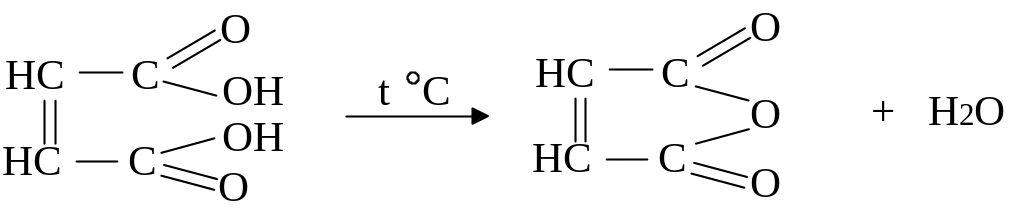
малеїнова кислота малеїновий ангідрид
Двохосновні карбонові кислоти
-
Назва
Формула
Т пл.
Щавлева
HOOC-COOH
189,5
Малонова
HOOC-CH2-COOH
135,6
Бурштинова
HOOC-(CH2)2-COOH
185
Глутарова
HOOC-(CH2)3-COOH
97,5
Адіпінова
HOOC-(CH2)4-COOH
153
Фталева (о)
C6H4(COOH)2
213
Ізофталева (м)
C6H4(COOH)2
300
Трефталева (н)
C6H4(COOH)2
350
Способи одержання двохосновних карбонових кислот
Специфічні способи одержання
Щавлевої кислоти
З мурашиної кислоти
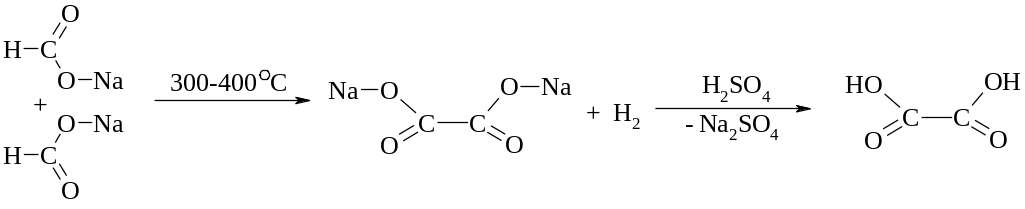
Окиснення етиленгліколю
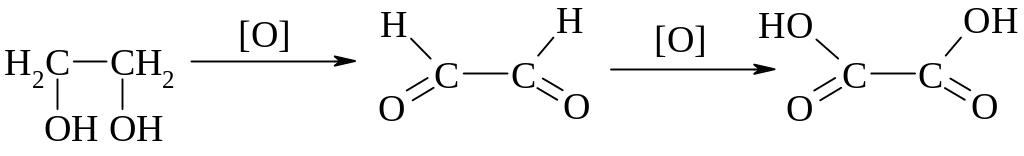
Малонової кислоти
Окиснення циклопропану
![]()
Гідроліз нітрилів
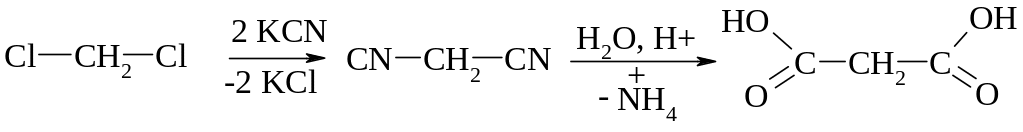
Бурштинової кислоти
Перегонка бурштину (технічний спосіб)
Гідроліз нітрилів
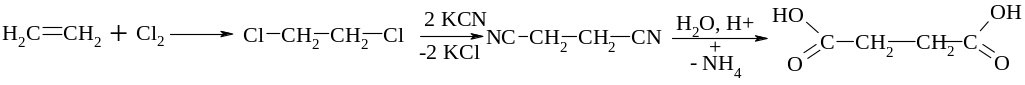 4. Глутарової
кислоти
4. Глутарової
кислоти
Окиснення циклічного кетону циклопентанону
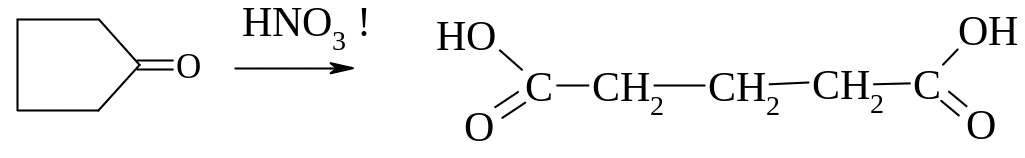
Адипінової кислоти
Окиснення відповідного циклічного кетону циклогексанону