- •Типи хімічних зв’язків та їх основні характеристики
- •Будова атома карбону
- •Метод валентних зв’язків
- •Метод мо лкао
- •Класифікація органічних реакцій
- •Класифікація органічних реакцій за типами хімічних перетворень зв’язків
- •Класифікація органічних реакцій за типами розриву зв’язку
- •Класифікація органічних реакцій за типами реагентів
- •Проміжні частинки в органічних реакціях. Взаємний вплив атомів молекулах
- •Алкани (парафіни)
- •Способи одержання алканів
- •Хімічні властивості алканів
- •Окиснення
- •Алкени (олефіни)
- •Способи добування алкенів
- •Дегідратація спиртів (відщеплення води).
- •Дегалогенування віцинальних дігалогеналканів (відщеплення галогенів)
- •Часткове гідрування (відновлення) алкінів (ацетиленів)
- •Хімічні властивості
- •Це явище обумовлене високою стабілізацією алільного проміжного радикалу за рахунок ефекту спряження. Внаслідок, при термічному хлоруванні пропілену:
- •Алкадієни
- •Методи добування
- •Дегідрування бутан-бутиленової бо пентан-пентенової фракції:
- •Дегідратація 1,3- та 1,4- гліколей:
- •Промисловий метод Лєбєдєва із спирту:
- •Електронна бувова спряжених дієнів
- •Хімічні властивості
- •Гідрування.
- •Приєднання галогенів
- •Алкіни (ацетиленові вуглеводні)
- •Методи добування алкінів
- •Аліциклічні сполуки
- •Ароматичні вуглеводні
- •Ароматичні вуглеводні ряду бензолу
- •Добування бензолу та його гомологів
- •Хімічні властивості
- •Прaвила орієнтації електрофільного замііщення в бензольному ядрі
- •Гетероциклічні сполуки
- •Пятичленні гетероциклічні сполуки
- •Способи одержання
- •Хімічні властивості
- •Реакції електрофільного заміщення
- •Шестичленні гетероциклічні сполуки
- •Ароматичні вуглеводні з конденсованими бензольними ядрами нафталін
- •Хімічні властивості
- •Антрацен
- •Загальні методи одержання
- •Хімічні властивості мос (загальні реакції) Магнійорганічні сполуки
- •Перегрупування Арбузова:
- •Галогенпохідні вуглеводнів Галогенпохідними називають сполуки, які містять зв’язки карбон-галоген. Поділяють на
- •Методи добування моногалогенпохідних
- •Хімічні властивості
- •Ароматичні сульфокислоти
- •Хімічні властивості сульфокислот визначаються наявністю сульфогрупи і їх можна розділити на три типи:
- •Реакції сульфогрупи
- •Реакції заміщення сульфогрупи на групи –он; –cn; –nh2.
- •Одно- і багатоатомні спирти
- •Методи одержання спиртів
- •V. Гідрування кетонів.
- •Феноли. Хінони. Методи одержання фенолів
- •Рекція Кольбе-Шмідта – одержання саліцилової кислоти (аспірин)
- •Альдегіди і кетони
- •Способи одержання альдегідів і кетонів
- •Азотовмісні органічні сполуки нітросполуки
- •Способи одержання нітросполук
- •Способи одержання жирно-ароматичних нітросполук
- •Рідкофазне нітруваня за Коноваловим
- •Нуклеофільне заміщення галогену на нітрогрупу
- •Одержання ароматичних нітросполук
- •Хімічні властивості
- •Реакції відновлення з утворенням амінів
- •Класифікація
- •Способи одержання амінів для первинних амінів
- •Для вторинних амінів
- •Для третинних амінів
- •Хімічні властивості
- •Основність амінів
- •Порівняння основності амінів
- •Ароматичні діазо- і азосполуки
- •Реакції діазосполук з виділенням азоту
- •Реакції без виділення азоту
- •Карбонові кислоти
- •Методи одержання одноосновних карбонових кислот
- •6. Реакції окиснення: насичених, ароматичних вуглеводнів, альдегідів і кетонів
- •Гідроліз галогенопохідних
- •Хімічні властивості карбонових кислот
- •Ненасичені кислоти Найпростіші ненасичені одноосновні кислоти:
- •Двохосновні карбонові кислоти
- •Способи одержання двохосновних карбонових кислот
- •Хімічні властивості
- •Кислотні властивості.
- •Реакції за карбоксильною групою
- •Реакції за карбоксильною групою
- •Особливості хімічних властивостей дикарбонових кислот
- •Хімічні властивості
- •Хімічні властивості.
- •Аминокислоты с неполярными или гидрофобными r – группами
- •Аминокислоты с незаряженными полярными r – группами.
Азотовмісні органічні сполуки нітросполуки
Похідні вуглеводнів в молекулах яких є група –NO2.
Гомологічний ряд: R–NO2 CnH2n+1NO2 .
КЛАСИФІКАЦІЯ
АЛІФАТИЧНІ |
ЖИРНО-АРОМАТИЧНІ |
АРОМАТИЧНІ |
|
|
|
нітрометан |
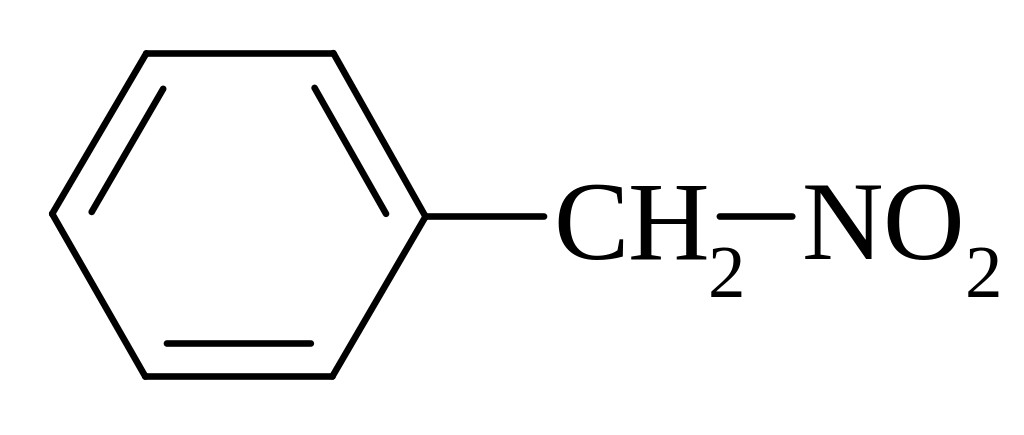
α-нітротолуол, фенілнітрометан |
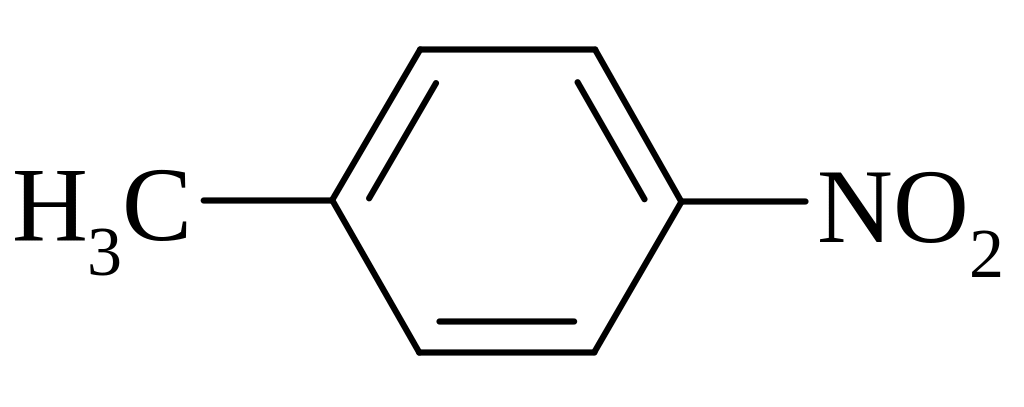
п-нітротолуол |
ІЗОМЕРІЯ І НОМЕНКЛАТУРА
В залежності від характеру атома карбону з яким зв’язана нітрогрупа аліфатичні нітросполуки бувають:
первинні |
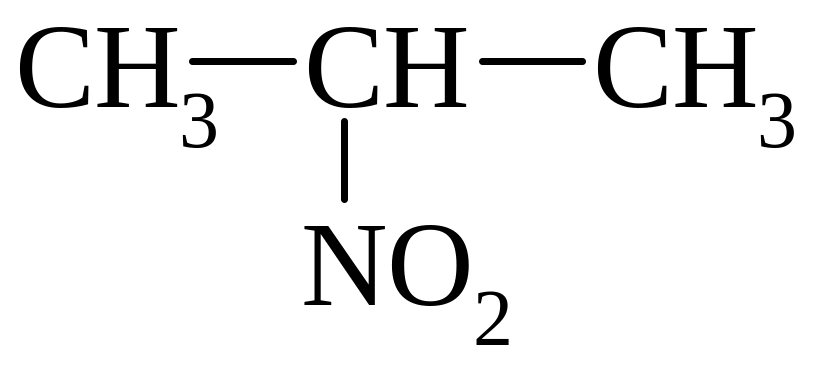
вторинні |
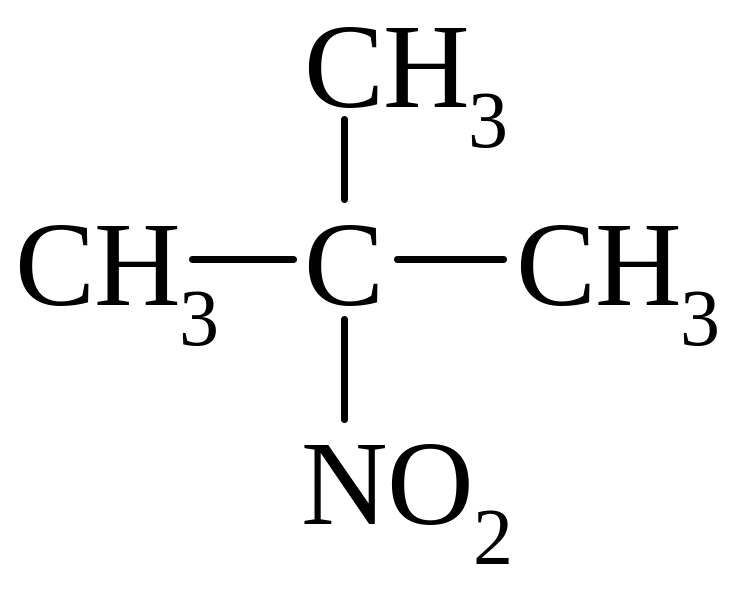
третинні |
|
|
|
нітроетан |
2-нітропропан |
2-нітро-2-метилпропан |
Для нітросполук характерна структурна ізомерія, що обумовлена розгалуженням вуглецевого ланцюга та ізомерія положення нітрогрупи.
Способи одержання нітросполук
Одержання аліфатичних нітросполук
Рідкофазне нітрування алканів за Коноваловим
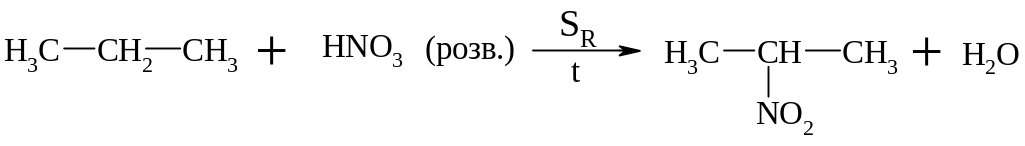
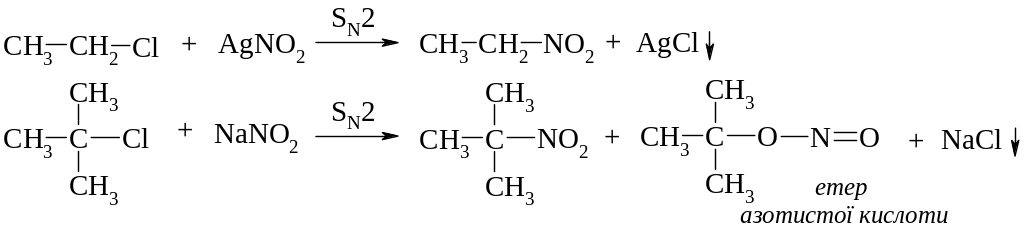
Нуклеофільне заміщення галогену на нітрогрупу – алкілування галоїдними алкілами солей азотистої кислоти
У промислвості проводять парофазне нітрування алканів t = 300-4000C, концентрована сірчана кислота, але таке нітрування супроводжується деструкцією алканів (окисненя і крекінг).
Способи одержання жирно-ароматичних нітросполук
Рідкофазне нітруваня за Коноваловим
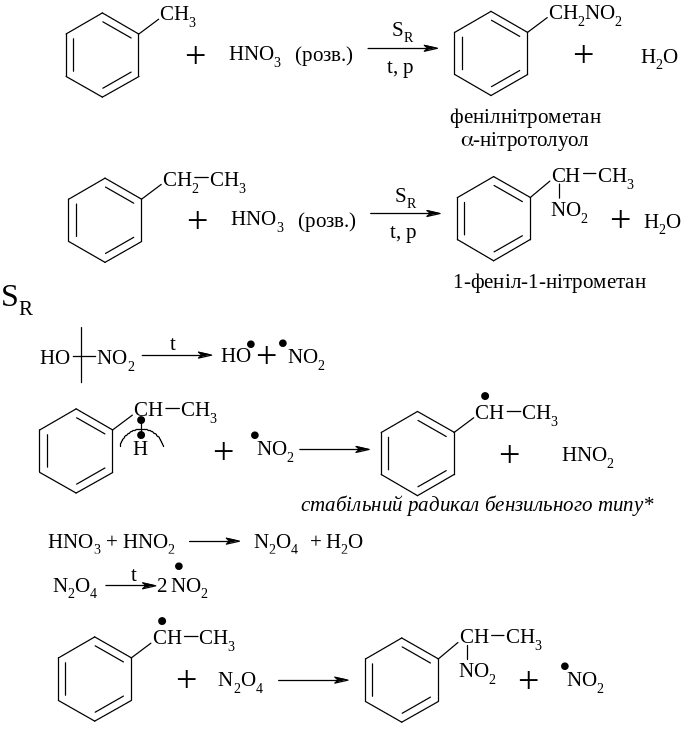
При нітруванні бокового ланцюга з двома і більше атомами карбону легше всього реакція проходить за -вуглецевим атомом бокового ланцюга у звязку із більшою стабілізацією радикалу бензільного типу* (цей радикал стабільний за рахунок супряження неспаренного електрону атома карбону бокового ланцюга з -електронним секстетом ароматичного ядра).
Нуклеофільне заміщення галогену на нітрогрупу
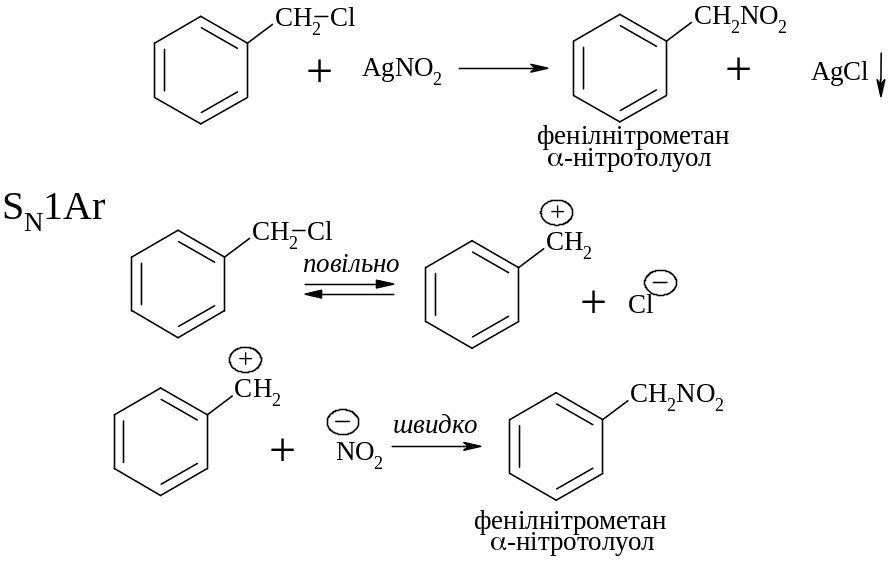
Одержання ароматичних нітросполук
Одержуються реакцією електрофільного заміщення – нітруванням.
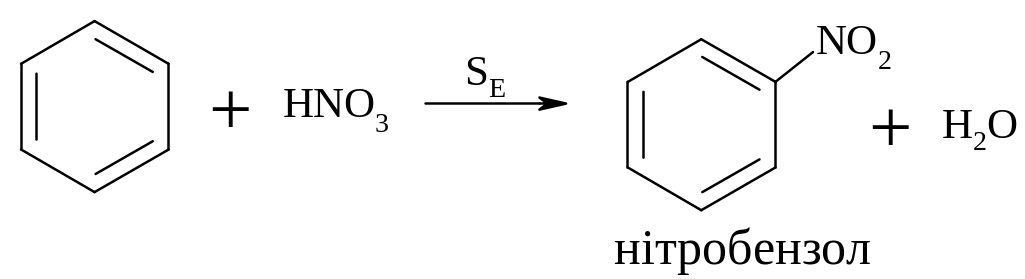
Як нітруючий засіб використана азотна кислота, яка диссоциює у водному розчині, але концентрація +NO2 у даному випадку дуже мала із-за зворотньої ракції.
![]()
Ароматичні сполука частіше всього нітрують нітруючою сумішшю. Роль сірчаної кислоти зводиться до збільшення в рівноважній суміші концентрації +NO2 за семою:
![]()
Гомологи бензолу нітруються легше ніж сам бензол. Для одержання ди- і три- ароматичних нітропохідних нітрування проводять в більш жорстких умовах.
Хімічні властивості
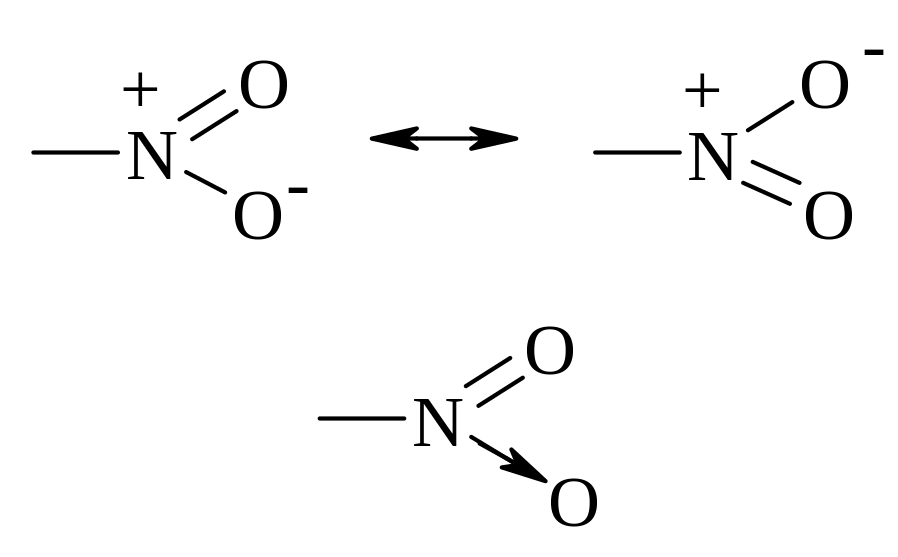
БУДОВА НІТРОГРУПИ
|
Атом нітрогену має п’ять валентних електронів: один електрон витрачає на утворення ковалентного зв’язку з любим радикалом; два електрони витрачає на утворення ковалентного полярного зв’язку з одним із атомів оксигену і два електрони витрачає на утворення донорно-акцепторного (семіполярного) зв’язку з іншим атомом оксигену. |
Нітрогрупа є одним із найбільш сильних акцепторів електронів, так як на атомі нітрогену локалізований цілий позитивний заряд, що з одного боку приводить до різкого збільшення рухливості протону у α-вуглецевого атому (більш сильному ніж цей ефект у альдегідах і кетонах), а з іншого боку до дезактивації ароматичного кільця до реакцій електрофільного заміщення і полегшення реакцій нуклеофільного заміщення.
І. РЕАКЦІЇ ЗА НІТРОГРУПОЮ