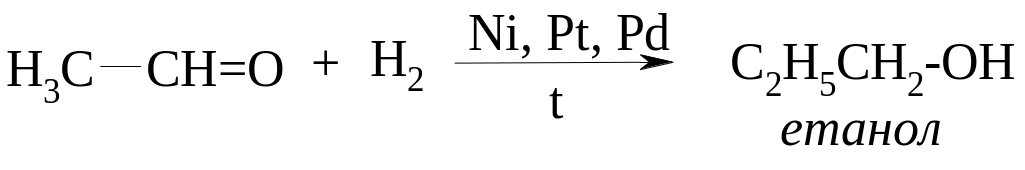- •Типи хімічних зв’язків та їх основні характеристики
- •Будова атома карбону
- •Метод валентних зв’язків
- •Метод мо лкао
- •Класифікація органічних реакцій
- •Класифікація органічних реакцій за типами хімічних перетворень зв’язків
- •Класифікація органічних реакцій за типами розриву зв’язку
- •Класифікація органічних реакцій за типами реагентів
- •Проміжні частинки в органічних реакціях. Взаємний вплив атомів молекулах
- •Алкани (парафіни)
- •Способи одержання алканів
- •Хімічні властивості алканів
- •Окиснення
- •Алкени (олефіни)
- •Способи добування алкенів
- •Дегідратація спиртів (відщеплення води).
- •Дегалогенування віцинальних дігалогеналканів (відщеплення галогенів)
- •Часткове гідрування (відновлення) алкінів (ацетиленів)
- •Хімічні властивості
- •Це явище обумовлене високою стабілізацією алільного проміжного радикалу за рахунок ефекту спряження. Внаслідок, при термічному хлоруванні пропілену:
- •Алкадієни
- •Методи добування
- •Дегідрування бутан-бутиленової бо пентан-пентенової фракції:
- •Дегідратація 1,3- та 1,4- гліколей:
- •Промисловий метод Лєбєдєва із спирту:
- •Електронна бувова спряжених дієнів
- •Хімічні властивості
- •Гідрування.
- •Приєднання галогенів
- •Алкіни (ацетиленові вуглеводні)
- •Методи добування алкінів
- •Аліциклічні сполуки
- •Ароматичні вуглеводні
- •Ароматичні вуглеводні ряду бензолу
- •Добування бензолу та його гомологів
- •Хімічні властивості
- •Прaвила орієнтації електрофільного замііщення в бензольному ядрі
- •Гетероциклічні сполуки
- •Пятичленні гетероциклічні сполуки
- •Способи одержання
- •Хімічні властивості
- •Реакції електрофільного заміщення
- •Шестичленні гетероциклічні сполуки
- •Ароматичні вуглеводні з конденсованими бензольними ядрами нафталін
- •Хімічні властивості
- •Антрацен
- •Загальні методи одержання
- •Хімічні властивості мос (загальні реакції) Магнійорганічні сполуки
- •Перегрупування Арбузова:
- •Галогенпохідні вуглеводнів Галогенпохідними називають сполуки, які містять зв’язки карбон-галоген. Поділяють на
- •Методи добування моногалогенпохідних
- •Хімічні властивості
- •Ароматичні сульфокислоти
- •Хімічні властивості сульфокислот визначаються наявністю сульфогрупи і їх можна розділити на три типи:
- •Реакції сульфогрупи
- •Реакції заміщення сульфогрупи на групи –он; –cn; –nh2.
- •Одно- і багатоатомні спирти
- •Методи одержання спиртів
- •V. Гідрування кетонів.
- •Феноли. Хінони. Методи одержання фенолів
- •Рекція Кольбе-Шмідта – одержання саліцилової кислоти (аспірин)
- •Альдегіди і кетони
- •Способи одержання альдегідів і кетонів
- •Азотовмісні органічні сполуки нітросполуки
- •Способи одержання нітросполук
- •Способи одержання жирно-ароматичних нітросполук
- •Рідкофазне нітруваня за Коноваловим
- •Нуклеофільне заміщення галогену на нітрогрупу
- •Одержання ароматичних нітросполук
- •Хімічні властивості
- •Реакції відновлення з утворенням амінів
- •Класифікація
- •Способи одержання амінів для первинних амінів
- •Для вторинних амінів
- •Для третинних амінів
- •Хімічні властивості
- •Основність амінів
- •Порівняння основності амінів
- •Ароматичні діазо- і азосполуки
- •Реакції діазосполук з виділенням азоту
- •Реакції без виділення азоту
- •Карбонові кислоти
- •Методи одержання одноосновних карбонових кислот
- •6. Реакції окиснення: насичених, ароматичних вуглеводнів, альдегідів і кетонів
- •Гідроліз галогенопохідних
- •Хімічні властивості карбонових кислот
- •Ненасичені кислоти Найпростіші ненасичені одноосновні кислоти:
- •Двохосновні карбонові кислоти
- •Способи одержання двохосновних карбонових кислот
- •Хімічні властивості
- •Кислотні властивості.
- •Реакції за карбоксильною групою
- •Реакції за карбоксильною групою
- •Особливості хімічних властивостей дикарбонових кислот
- •Хімічні властивості
- •Хімічні властивості.
- •Аминокислоты с неполярными или гидрофобными r – группами
- •Аминокислоты с незаряженными полярными r – группами.
Ароматичні сульфокислоти
Ароматичними сульфокислотами називають сполуки, в яких атом сірки сульфогрупи –SO3H сполучений з атомом вуглецю ароматичного ядра. У молекулу бензолу можна ввести одну, дві або три сульфогрупи. Прикладом ароматичної моносульфокислоти є бензолсульфокислота:
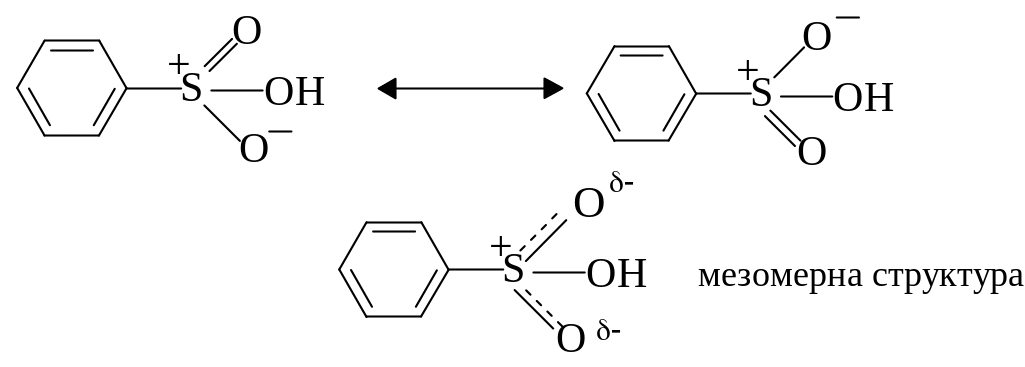
У відповідності до октетної формули сульфогрупа має два ковалентних і два семіполярних зв’язків. Останні утворені за участю тільки електронів атому сірки. Однак, для сульфокислот може використовуватися формула з шістьма ковалентними зв’язками (двома одинарними та двома подвійними), так як атоми сірки мають вільні d-орбіталі, на яких можуть бути розміщені електрони (з розширенням октету).
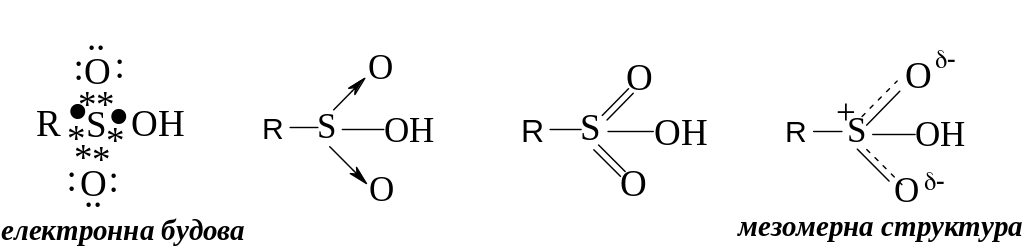
Дійсна будову атому сірки – проміжна між станами, які відповідають цим двом формам (Див. “мезомерна структура”).
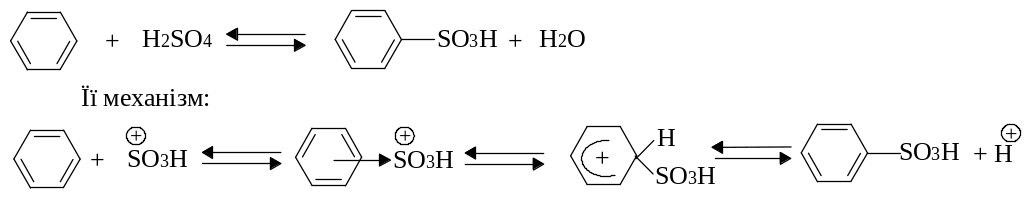
Ароматичні сульфокислоти добувають переважно реакцією сульфування ароматичних сполук сульфуючими реагентами (концентрована H2SO4, олеум: SO3+H2SO4; SO3 ; хлорсульфонова кислота HОSO2Cl; хлористий сульфурил SO2Cl2 , та інш.).
Сульфування – це реакція електрофільного заміщення. При сульфуванні сірчаною кислотою сульфуючою частинкою є катіон гідросульфонію, який утворюється з концентрованої кислоти за схемою:
![]()
Треба мати на увазі, що реакція сульфування є зворотною:
 π-комплекс
σ-комплекс
π-комплекс
σ-комплекс
Подібно до сірчаної кислоти сульфокислоти є сильними кислотами.
Хімічні властивості сульфокислот визначаються наявністю сульфогрупи і їх можна розділити на три типи:
реакції сульфогрупи;
реакції заміщення сульфогрупи;
реакції за участю бензольного ядра.
Реакції сульфогрупи
утворення солей
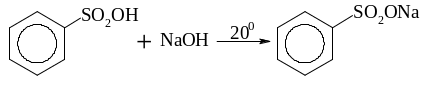
утворення хлорангідридів
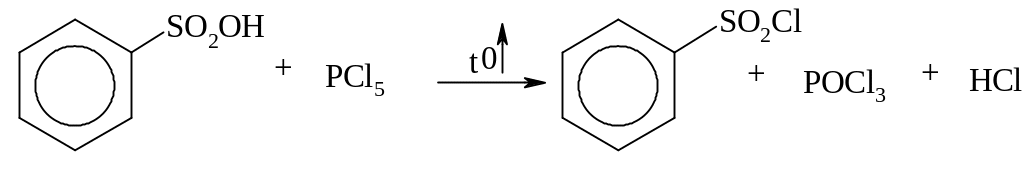
утворення ефірів та амідів
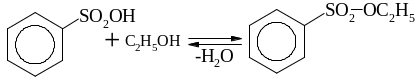
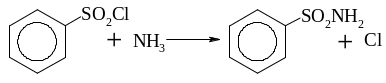
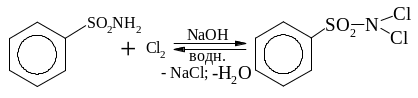
утворення тіофенолів
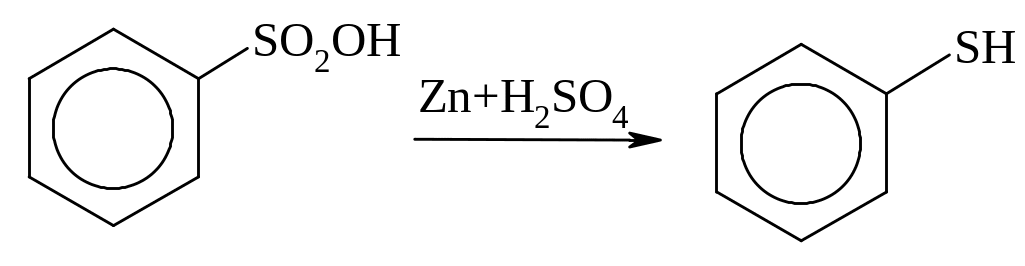
Реакції заміщення сульфогрупи на групи –он; –cn; –nh2.
Гідроліз (при дії перегрітої водяної пари в кислому середовищі сульфокислоти дають вихідні ароматичні вуглеводні)
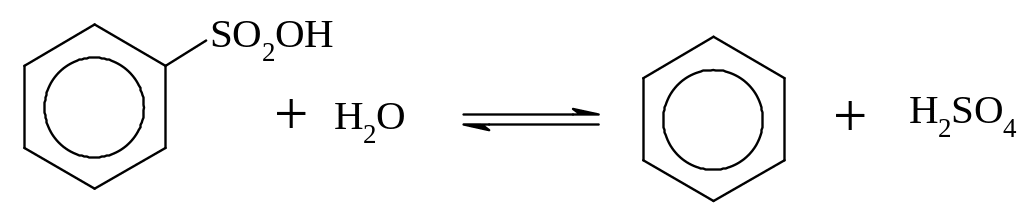
Реакції лужного плавлення

Сплавлення солей сульфокислот з ціанідами з утворенням нітрилів
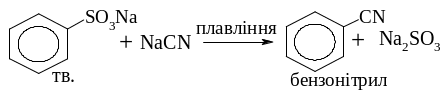
Реакції електрофільного заміщення водню: відбуваються важче, ніж у бензолі завдяки тому, що сульфогрупа виявляє негативний індукційний ефект і є орієнтантом другого роду (мета-оріентантом), пасивує бензольне ядро до реакції електрофільного заміщення.
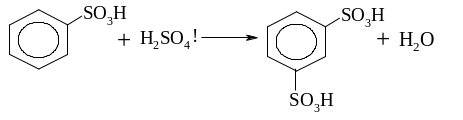
Сульфокислоти мають різноманітне застосування. Вони є основою для добування поверхнево-активних речовин, миючих засобів, барвників, дубильних речовин, йоно-обмінних смол тощо.
Одно- і багатоатомні спирти
Спирти - це похідні вуглеводнів, у молекулах яких один або декілька атомів водню заміщені гідроксильними групами. У залежності від кількості гідроксильних груп спирти бувають одноатомні та багатоатомні. Молекули спиртів асоційовані внаслідок виникнення між ними водневих зв’язків, чим і пояснюються порівняно високі температури кипіння спиртів:
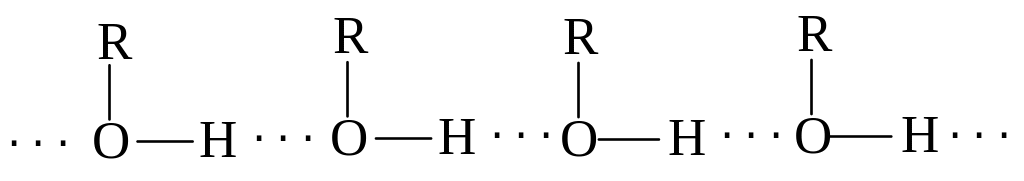
Методи одержання спиртів
І. Гідроліз галагенопохідних.
а)
![]()
б)
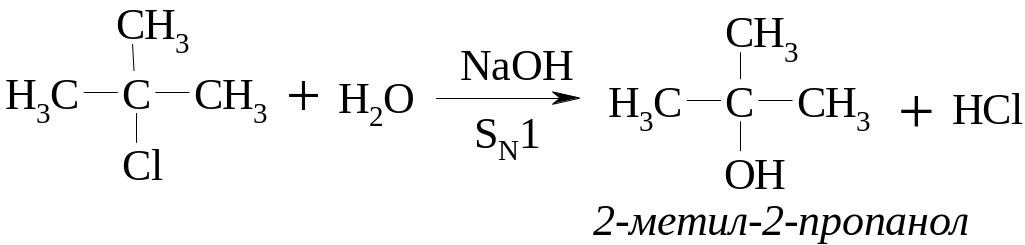
в) Треба мати на увазі, що галоген, який знаходиться біля α-вуглецевого атома бокового ланцюга дуже рухливий і легко заміщується на нуклеофільні реагенти за механізмом SN1:
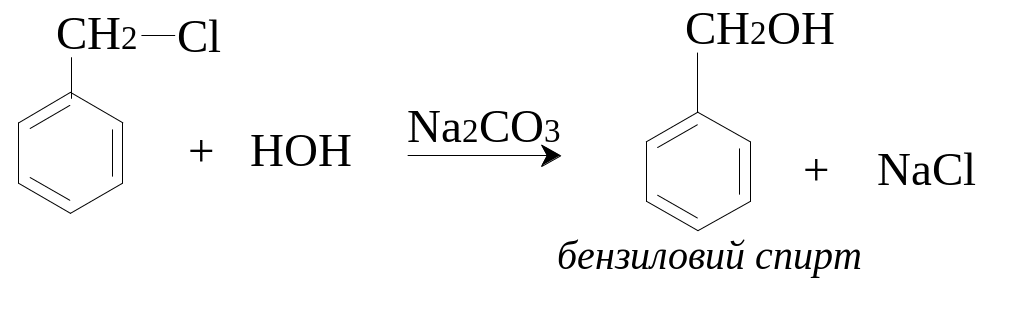
Спочатку повільно відбувається дисоціація з утворенням енергетично стійкого бензильного катіона, стійкість якого зумовлена спряженням р-орбіталей бензольного ядра з вакантною орбіталлю вуглецевого атома бокового ланцюга. На другій стадії бензильний катіон швидко реагує з нуклеофілом:

ІІ. Каталітична гідратація алкенів.
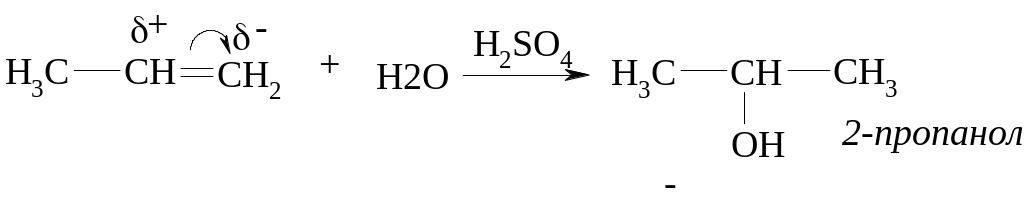
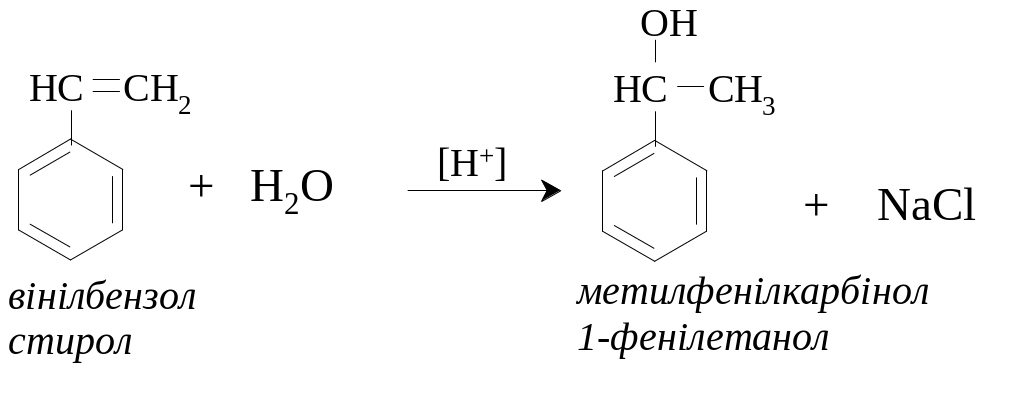
ІІІ. Металоорганічний синтез.
а) для одержання первинних спиртів)
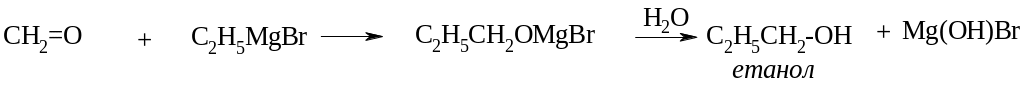
б) для одержання вторинних спиртів

в) для одержання третинних спиртів
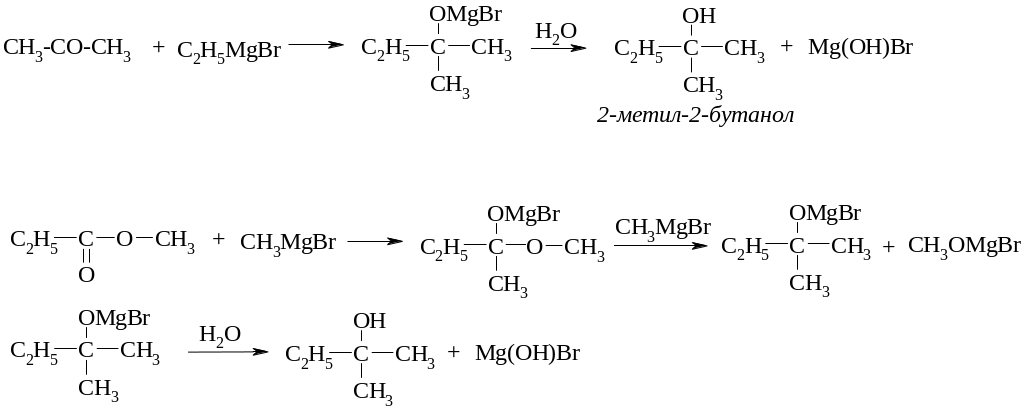
ІV. Гідрування альдегідів та складних ефірів.