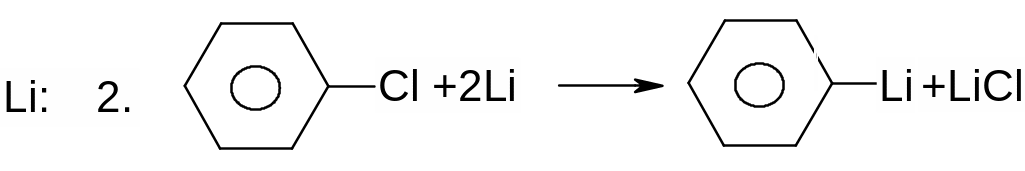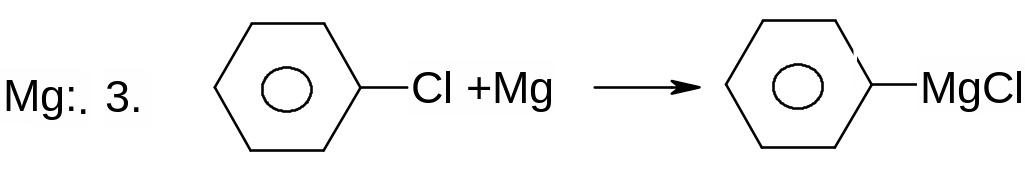- •Типи хімічних зв’язків та їх основні характеристики
- •Будова атома карбону
- •Метод валентних зв’язків
- •Метод мо лкао
- •Класифікація органічних реакцій
- •Класифікація органічних реакцій за типами хімічних перетворень зв’язків
- •Класифікація органічних реакцій за типами розриву зв’язку
- •Класифікація органічних реакцій за типами реагентів
- •Проміжні частинки в органічних реакціях. Взаємний вплив атомів молекулах
- •Алкани (парафіни)
- •Способи одержання алканів
- •Хімічні властивості алканів
- •Окиснення
- •Алкени (олефіни)
- •Способи добування алкенів
- •Дегідратація спиртів (відщеплення води).
- •Дегалогенування віцинальних дігалогеналканів (відщеплення галогенів)
- •Часткове гідрування (відновлення) алкінів (ацетиленів)
- •Хімічні властивості
- •Це явище обумовлене високою стабілізацією алільного проміжного радикалу за рахунок ефекту спряження. Внаслідок, при термічному хлоруванні пропілену:
- •Алкадієни
- •Методи добування
- •Дегідрування бутан-бутиленової бо пентан-пентенової фракції:
- •Дегідратація 1,3- та 1,4- гліколей:
- •Промисловий метод Лєбєдєва із спирту:
- •Електронна бувова спряжених дієнів
- •Хімічні властивості
- •Гідрування.
- •Приєднання галогенів
- •Алкіни (ацетиленові вуглеводні)
- •Методи добування алкінів
- •Аліциклічні сполуки
- •Ароматичні вуглеводні
- •Ароматичні вуглеводні ряду бензолу
- •Добування бензолу та його гомологів
- •Хімічні властивості
- •Прaвила орієнтації електрофільного замііщення в бензольному ядрі
- •Гетероциклічні сполуки
- •Пятичленні гетероциклічні сполуки
- •Способи одержання
- •Хімічні властивості
- •Реакції електрофільного заміщення
- •Шестичленні гетероциклічні сполуки
- •Ароматичні вуглеводні з конденсованими бензольними ядрами нафталін
- •Хімічні властивості
- •Антрацен
- •Загальні методи одержання
- •Хімічні властивості мос (загальні реакції) Магнійорганічні сполуки
- •Перегрупування Арбузова:
- •Галогенпохідні вуглеводнів Галогенпохідними називають сполуки, які містять зв’язки карбон-галоген. Поділяють на
- •Методи добування моногалогенпохідних
- •Хімічні властивості
- •Ароматичні сульфокислоти
- •Хімічні властивості сульфокислот визначаються наявністю сульфогрупи і їх можна розділити на три типи:
- •Реакції сульфогрупи
- •Реакції заміщення сульфогрупи на групи –он; –cn; –nh2.
- •Одно- і багатоатомні спирти
- •Методи одержання спиртів
- •V. Гідрування кетонів.
- •Феноли. Хінони. Методи одержання фенолів
- •Рекція Кольбе-Шмідта – одержання саліцилової кислоти (аспірин)
- •Альдегіди і кетони
- •Способи одержання альдегідів і кетонів
- •Азотовмісні органічні сполуки нітросполуки
- •Способи одержання нітросполук
- •Способи одержання жирно-ароматичних нітросполук
- •Рідкофазне нітруваня за Коноваловим
- •Нуклеофільне заміщення галогену на нітрогрупу
- •Одержання ароматичних нітросполук
- •Хімічні властивості
- •Реакції відновлення з утворенням амінів
- •Класифікація
- •Способи одержання амінів для первинних амінів
- •Для вторинних амінів
- •Для третинних амінів
- •Хімічні властивості
- •Основність амінів
- •Порівняння основності амінів
- •Ароматичні діазо- і азосполуки
- •Реакції діазосполук з виділенням азоту
- •Реакції без виділення азоту
- •Карбонові кислоти
- •Методи одержання одноосновних карбонових кислот
- •6. Реакції окиснення: насичених, ароматичних вуглеводнів, альдегідів і кетонів
- •Гідроліз галогенопохідних
- •Хімічні властивості карбонових кислот
- •Ненасичені кислоти Найпростіші ненасичені одноосновні кислоти:
- •Двохосновні карбонові кислоти
- •Способи одержання двохосновних карбонових кислот
- •Хімічні властивості
- •Кислотні властивості.
- •Реакції за карбоксильною групою
- •Реакції за карбоксильною групою
- •Особливості хімічних властивостей дикарбонових кислот
- •Хімічні властивості
- •Хімічні властивості.
- •Аминокислоты с неполярными или гидрофобными r – группами
- •Аминокислоты с незаряженными полярными r – группами.
Хімічні властивості
Галогенопохідні – це один з найбільш реакційно здатних класів органічних сполук. Для них найбільш характерні реакції нуклеофільного заміщення (SN) та відщеплення (Е).
І. Реакції нуклеофільного заміщення.
Нуклеофіли – це багаті електронами реагенти, які мають основні властивості. Всі нуклеофіли мають щонайменше одну неподілену пару електронів і характеризуються поняттям нуклеофільність, як основи – основність. Нуклеофільність – це здатність нуклеофільної пари нуклеофілу взаємодіяти з атомом карбону, тоді як основність – це здатність електронної пари основи взаємодіяти з протоном:
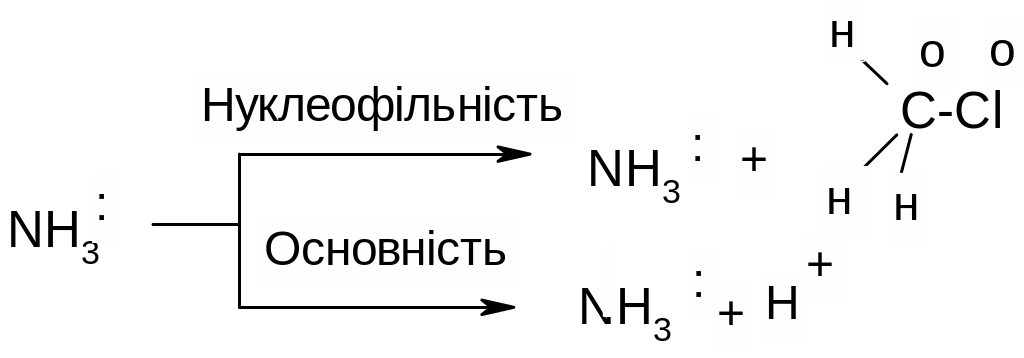
Як правило, нуклеофільність і основність змінюються паралельно, тобто із зростанням основності збільшується нуклеофільність і навпаки. Однак, ці поняття не тотожні і не пропорційні.
При нуклеофільному заміщенні нуклеофіл атакує молекулу, віддаючи для утворення нового зв’язку свою пару електронів. Електрони старого зв’язку, що розривається, С-Наl відходять разом з атомом галогену у вигляді аніона. Оскільки іон галогену – дуже слабка основа (і слабкий нуклеофіл) він легко заміщується будь-якими більш сильними нуклеофілами. Іон галогену є хорошою заміщаючою групою.
У загальному вигляді нуклеофільне заміщення можно забразити такою схемою:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
В аліфатичних галогенпохідних, а також в аліл- та бензилгалогенпохідних реакції відбуваються за механізмом SN1 та SN2.
М![]() еханізм
SN2
(заміщення нуклеофільне другого порядку),
в якому на лімітуючій стадії реакцій
(найменш швидкій стадії, яка визначає
швидкість реакції беруть участь два
реагенти, тобто )
еханізм
SN2
(заміщення нуклеофільне другого порядку),
в якому на лімітуючій стадії реакцій
(найменш швидкій стадії, яка визначає
швидкість реакції беруть участь два
реагенти, тобто )
![]()
Механізм:
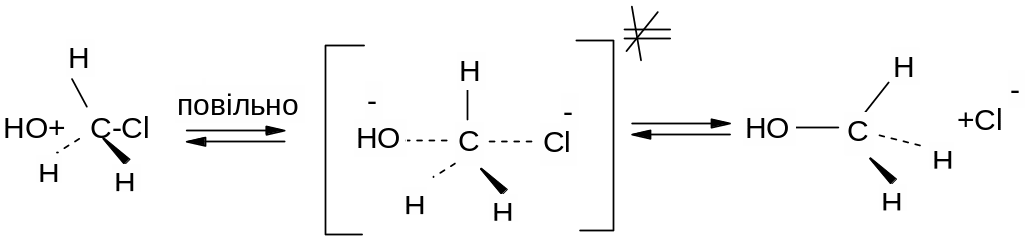
Для SN2 реакцій характерні такі ознаки:
Швидкість реакції залежить від концентрації обох реагентів;
Реакції супроводжуються, як правило, інверсією конфігурації атому карбону, тобто конфігурація атому карбону в процесі реакції змінюється на протилежну – відбувається Вальденівське обертання конфігурації;
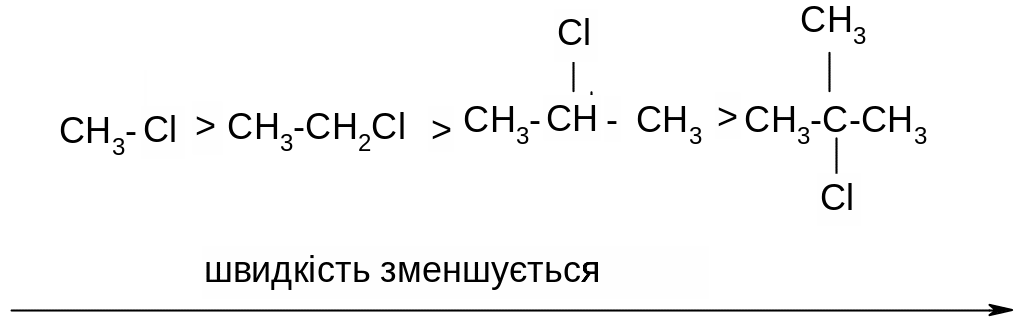
Оскільки в реакціях SN2 атака нуклеофілу відбувається зі сторони, протилежної зв’язку С-Hal, швидкість реакції в основному залежить від просторового (стеричного) фрагменту – із збільшенням просторових утруднень атаці нуклеофілу швидкість реакції зменшується:
![]()
При SN2 реакціях, як правило, відсутні перегрупування.
ІІ. Механізм SN1 (заміщення нуклеофільне мономолекулярне),
в якому на лімітуючій стадії приймає участь лише один реагент – галоїдний алкіл, тобто
V=k[R-Hal]:
![]()
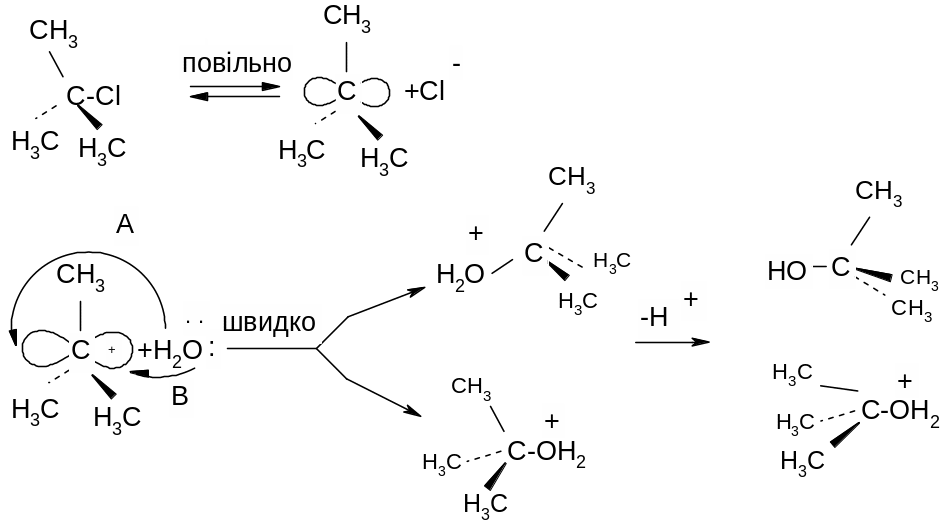
Перша стадія реакції – дисоціація – є лімітуючою стадією. Розрив зв’язку С-Hal відбувається за рахунок енергії сольватації галоген алкану розчинником. Друга стадія відбувається миттєво.
Особливості реакцій SN1:
Швидкість реакції залежить лише від концентрації галогену.
Реакції, як правило, супроводжуються повною рацемізацією оптично активних сполук, тобто із сполук з визначеною конфігурацією з рівною вірогідністю утворюються сполуки з протилежними конфігураціями. Це відбувається тому, що плоский проміжний карбокатіон з однаковою вірогідністю може атакуватися нуклеофілом з обох сторін.
Оскільки в реакціях SN1 на швидкість лімітуючої стадії утворюється карбокатіон, швидкість реакції перед усім залежить від відносної стійкості карбокатіону, тобто від електронних факторів: чим стійкіший утворений карбокатіон, тим більша швидкість реакції. Тому швидкість реакції за механізмом SN1 зменшується в такому ряду:
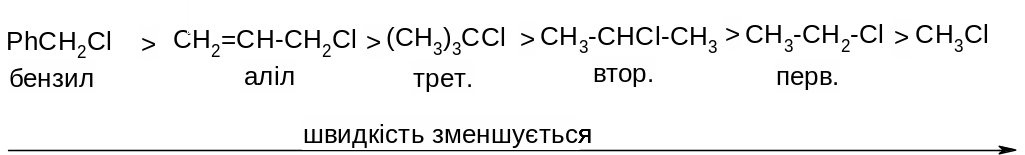
Оскільки реакції SN1 відбуваються через проміжне утворення
карбокатіону, вони як правило, супроводжуються перегрупуванням:
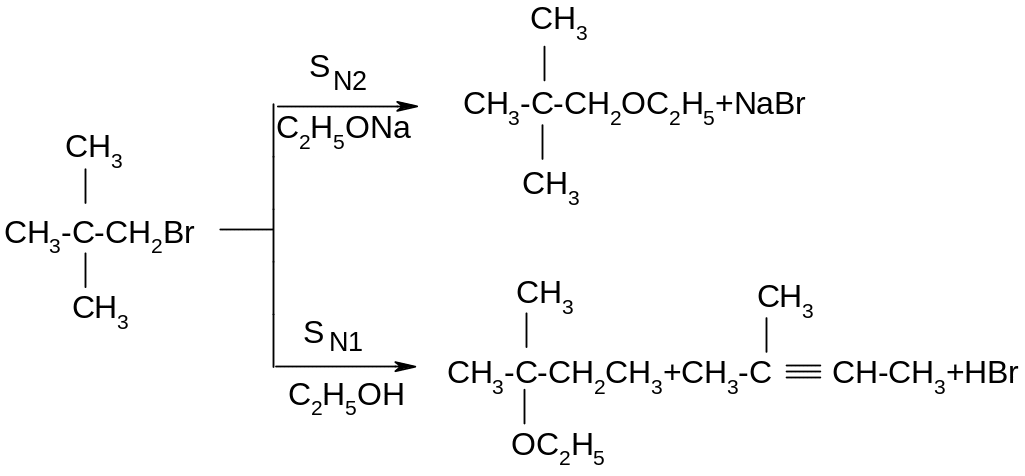
ІІІ. Порівняння реакцій SN1 та SN2.
Нуклеофільне заміщення SN1 супроводжується рацемізацією та перегрупуванням, а реакційна здатність зменшується від третинних до первинних галагенопохідних. Для SN2 реакцій характерне повне обертання конфігурації, відсутність перегрупування, а реакційна здатність зменшується від первинних до третинних галагенопохідних. Оскільки порядок зміщення реакційної здатності в реакціях SN1 та SN2 різна, кожна з них зустрічається в чистому вигляді дуже рідко, в дійсності спостерігається комбінація обох реакцій з більшою або меншою часткою кожної з них. Тому для галогеналканів типовим є присутність мінімуму в реакційній здатності:
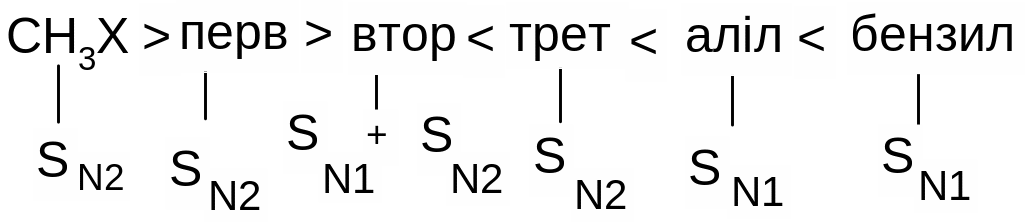
Відзначимо загальні фактори, які впливають на механізм, по якому відбуваються реакції нуклеофільного заміщення.
Будова галогеналканів: із збільшенням числа замісників у атома карбону, який несе атом галогену, полегшується реакція за механізмом SN1 та утруднюється реакція за механізмом SN2.
Природа залишаючої групи (нуклеофугу). В ряду FclBrI швидкість реакції за обома механізмами зростає, що обумовлено більш легкою іонізацією зв’язку С-Hal з-за зростання його довжини (полегшується реакція за механізмом SN1) та зменшується енергія розпушуючої орбіталі σ*С-Hal (полегшується реакція за механізмом SN2).
Концентрація нуклеофільного реагенту: із збільшенням концентрації нуклеофілу полегшується реакція за механізмом SN2 та утруднюється реакція за механізмом SN1.
Сила нуклеофільного реагенту: збільшення нуклеофільності реагену сприяє механізму SN2 та протидіє механізму SN1:
Природа розчинника. Протонні розчинники сприяють реакціям за механізмом SN1 , так як краще соль ватують залишаючи групу (нуклеофуг) і уповільнюють реакції за механізмом SN2, так як зменшують нуклеофільнітьь нуклеофілу за рахунок його сольватації. Апротонні розчинники сприяють реакції за механізмом SN2, так як менше соль ватують нуклеофіли. Але в цілому, полярні розчинники прискорюють реакції SN1 , так як перехідний стан цієї реакції більш полярний, ніж вихідний і тому за рахунок сольватації більш стабілізується перехідний стан менш молярний ніж вихідний, вихідний стан більше соль ватується полярними розчинниками і вони відповідно уповільнюють реакції SN2.
ІV. Причини підвищеної реакційної здатності аліл- та бензилгалогенідів в реакціях SN.
Хлористий аліл та хлористий бензил дуже легко вступають в реакції нуклеофільного заміщення за механізмом SN1 із-за високої стійкості проміжних карб катіонів внаслідок ефективного де локалізації позитивного заряду:
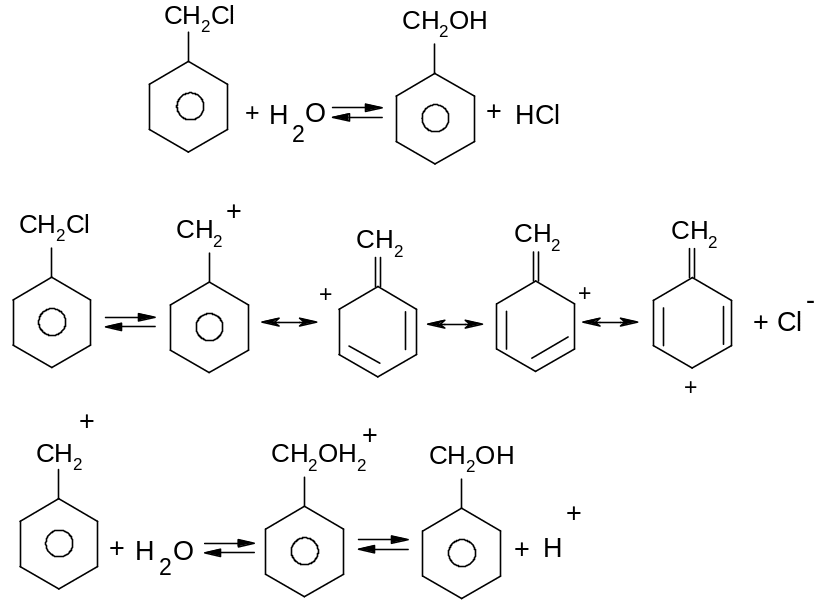
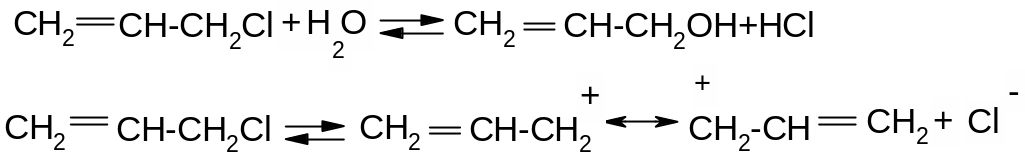
Для алілгалогенідів характерине алільне перегрупування. Так як спряжений алільний катіон здатний приєднувати нуклеофіл за обома атомами карбону, які несуть позитивний заряд:
![]()
V. Причини інертності атому галогену в вінілгалогенідах та неактивованих арилгалогенідах.
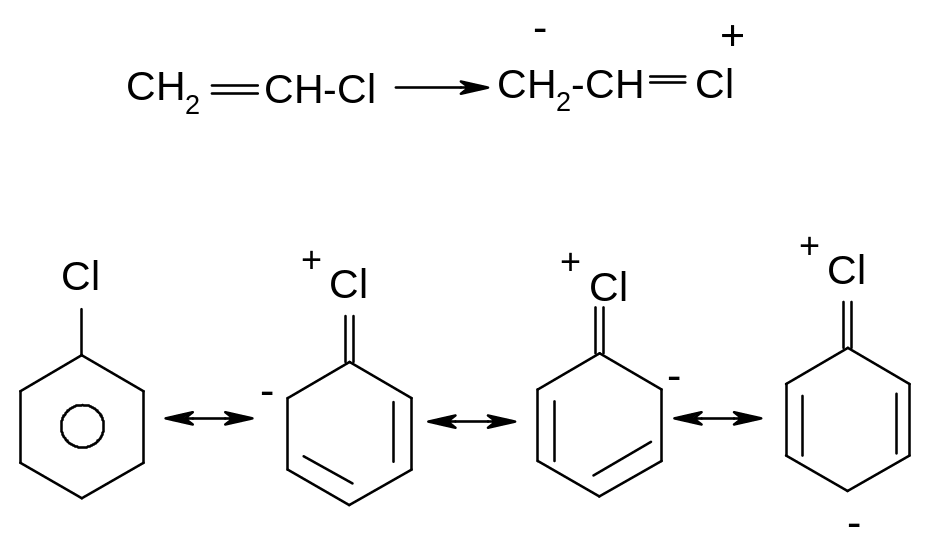
На відміну від розглянутих вище аліл- та бензилгалогенідах в присутності атому галогену безпосередньо при атомі карбону подвійного зв’язку в вініл- та неактивованих арилгалогенідах спряження неподіленої пари електронів атому галогену з сусіднім π- зв’язком вінілгалогенідів та π-системою неактивованих арилгалогенідів, яке приводить до відповідного скорочення зв’язку С-Hal, зв’язок набуває частково подвійний характер та стає більш міцним:
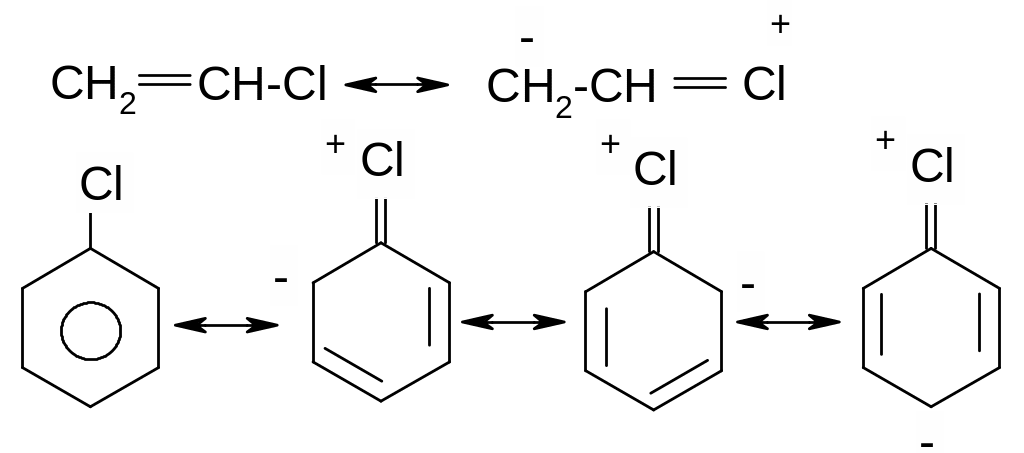
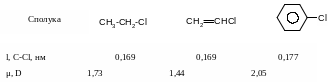 В
результаті вінілгалогеніди не вступають
в реакції нуклеофільного заміщення, а
лише в реакції відщеплення; неактивовані
арилгалогеніди вступають в реакції
псевдо заміщення за механізмом
відщеплення-приєднання
В
результаті вінілгалогеніди не вступають
в реакції нуклеофільного заміщення, а
лише в реакції відщеплення; неактивовані
арилгалогеніди вступають в реакції
псевдо заміщення за механізмом
відщеплення-приєднання
VI. Механізм відщеплення – приєднання в неактивованих арилгалогенідах.
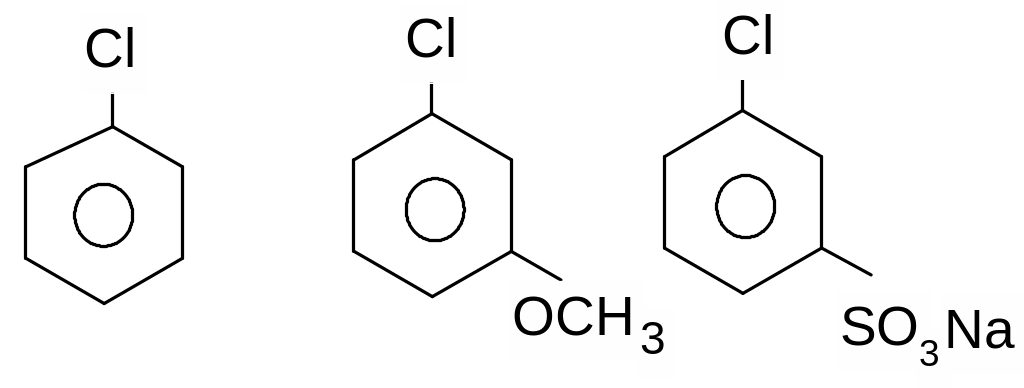 До
неактивованих арилгалогенідів відносять
арилгалогеніди, які не мають з амісників
в бензольному ядрі, які мають
електронодонорні замісники (замісники
І роду), а також частково арилгалогеніди,
які мають електроноакцепторні замісники,
які знаходяться в м- положеннях відносно
атому галогену.
До
неактивованих арилгалогенідів відносять
арилгалогеніди, які не мають з амісників
в бензольному ядрі, які мають
електронодонорні замісники (замісники
І роду), а також частково арилгалогеніди,
які мають електроноакцепторні замісники,
які знаходяться в м- положеннях відносно
атому галогену.
Реакції неактивованих арилгалогенідів відбуваються в дуже жорстких умовах:
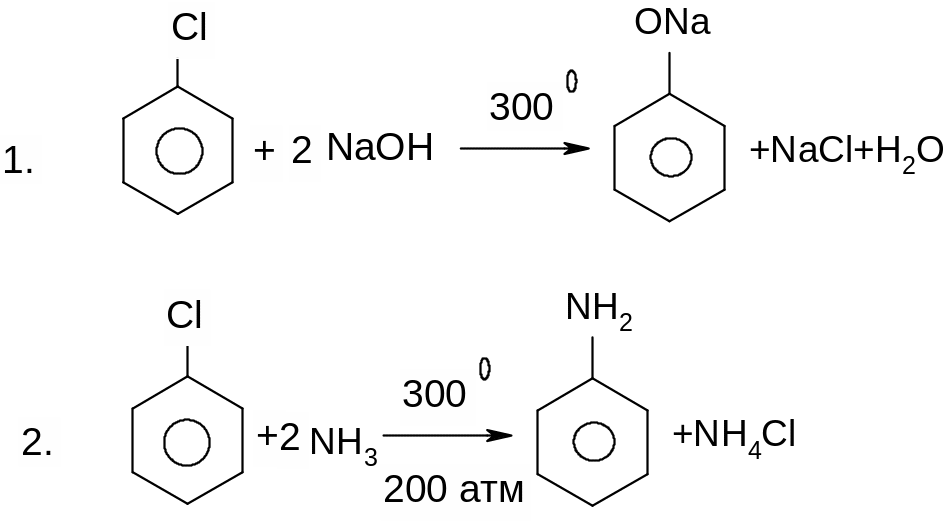
Першою стадією реакції є атака такої основи, як водний розчин лугу або амід натрію, найбільш “кислого” атому гідрогену в бензольному кільці, який знаходиться в о-положенні відносно атому галогену.
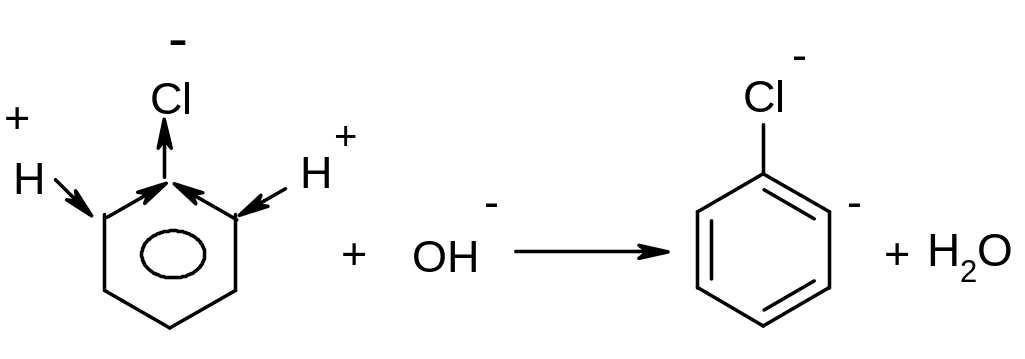
Утворений аніон внаслідок взаємодії вільної пари аніонного центру на атомі карбону з розпушуючою орбіта ллю сусіднього зв’язку С-Hal () викидає аніон хлору з утворенням надзвичайно реакційно здатного дегідробензолу.
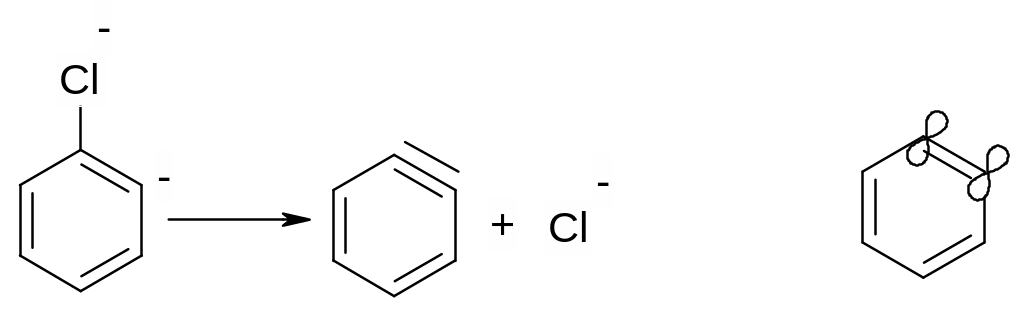
Дегідробензол має ароматичний характер, але, водночас, і потрійний зв’язок. При цьому, одна пара електронів потрійного зв’язку входить до π-електронного секстету бензольного кільця, а інша пара електронів утворює “π- зв’язок” , який розташований в площині бензольного кільця. Цей зв’язок надзвичайно реакційноздатний внаслідок слабкого перекривання двох sp2-гібридизованих електронних орбіта лей і легко вступає в реакції нуклеофільного приєднання (третю стадію реакції):
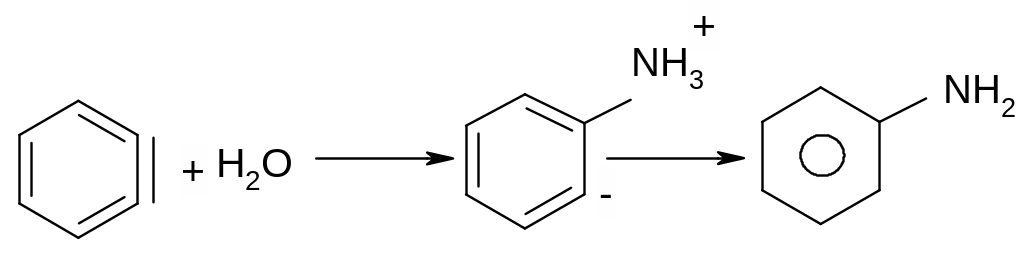
Місце входження нуклеофілу в похідних дегідробензолу, а також, і в заміщенних неактивованих арилгалогенідах визначається електронними факторами, які діють в похідних дегідробензолу, а не місцем знаходження атому галогену:
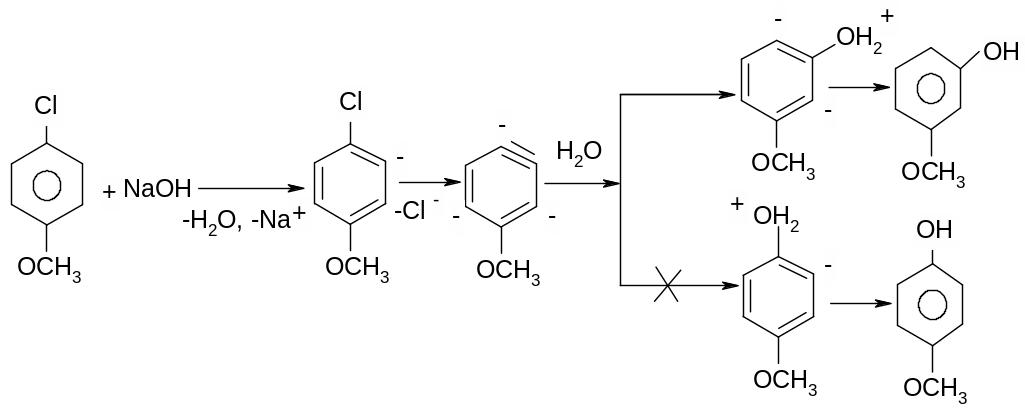
Слід пам’ятати, що вплив атому галогену не реакційну здатність неактивованих арилгалогенідів обернений його впливу на реакційну здатність алкілгалгенідів. Так, якщо реакційна здатність алкілгалогенідів зменшується в ряд, то в арилгалогенідах вона зменшується в протилежному напрямку: , що пов’язано з електроноакцепторними властивостями атомів галогену. Наприклад, атом F більш електроноакцепторний від атому Cl, тому в першому випадку ми маємо більш “кислий”, а відповідно, і більш рухливий атом гідрогену в о-положенні по відношенню до атому F.
VII. Активовані арилгалгеніди. Механізм SNAr.
Активовані арилгалогеніди – це арилгалогеніди, які мають в о- або п- положеннях по відношенню до атому галогену електроноакцепторниі замісники, які полегшують атаку нуклеофілу по атому карбону зв’язку С-Hal внаслідок зростання на цьому атомі частково позитивного заряду в результаті прояву ефекту супряження.
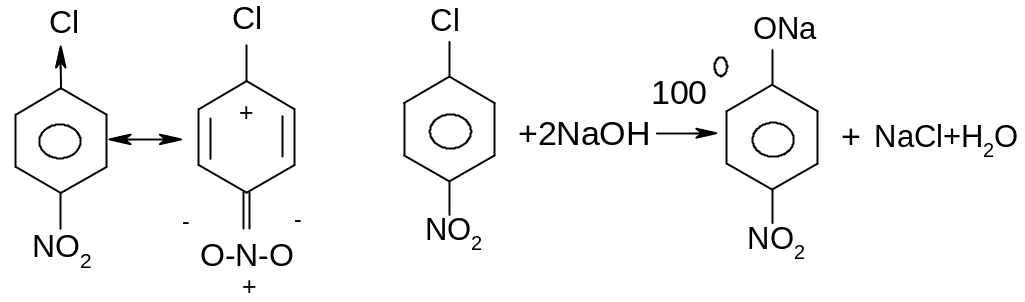
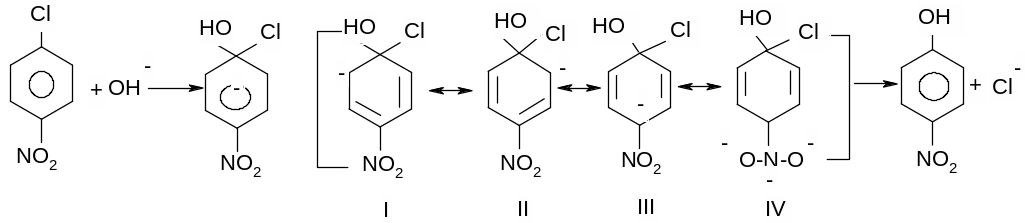
Проміжний негативно заряджений σ-комплекс стабілізується за рахунок ефективного спряження. Найбільший внесок в стабілізацію σ-комплексу вносить межова структура IV, в якій негативний заряд виноситься за межі бензольного кільця і знаходиться на найбільш електронегативному атомі оксигену. Саме утворення енергетично вигідного σ-комплексу під впливом сильного електроноакцепторного замісника є вирішальним фактором здійснення реакції за механізмом SNAr.
Для реакцій SNArшвидкість реакції зростає із зростанням електронегативності атому галогену, тобто зростає позитивний заряд на атомі карбону, який несе атом галогену.
Загалом, вплив атому галогену на швидкість реакцій галагенопохідних можна підсумувати в такій таблиці:
SN1 |
SN2 |
E-A |
SN-Ar |
Із зростанням електронегативності атомів галогену швидкість відповідних реакцій |
|||
уповільнюється внаслідок |
прискорюється внаслідок |
||
утворення більш міцного зв’язку С-Hal |
збільшення енергії розпушуючої орбіталі σ*C-Hal |
появи більш “кислого” атому водню в о-положенні |
появи більш позитивного заяду н тоі С, якй несе том Hal |
VIII. Реакції відщеплення галогеноводнів.
Існують два механізми відщеплення галгеноводнів від насичених галогеналканів:
Е1 – відщеплення мономолекулярне, швидкість реакції залежить лише від концентраціїгалогеналкану:
V=k[R-Hal]
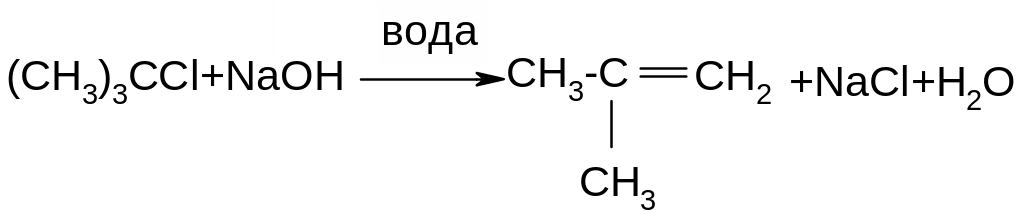
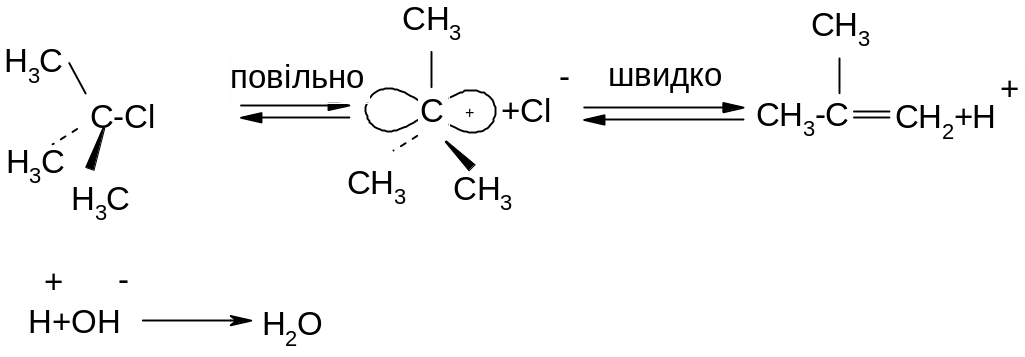
Лімітуючи стадія реакції – утворення карбокатіону, тому швидкість реакції зростає при переході від первинних до третинних алкілгалогенідів:
Відщеплення протону за механізмом Е1 є наглядним проявом ефекту над спряження; протон відщеплюється внаслідок перекривання вакантної орбіталі карбокатіоного центру з електронами сусіднього зв’язку С-Н.
Е2 – відщеплення бімолекулярне, швидкість реакції залежить від концентрації обох реагентів – галгеналкану та основи:
V=k[R-Hal][OH-]
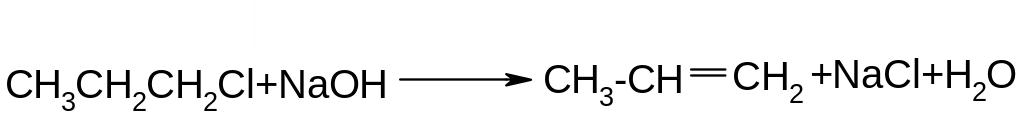
Механізм:
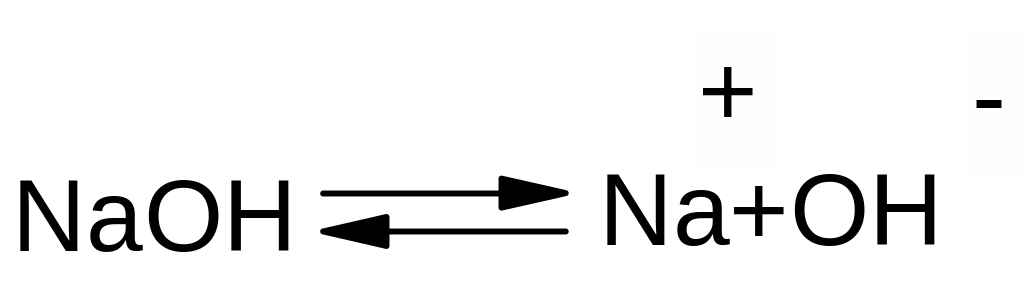
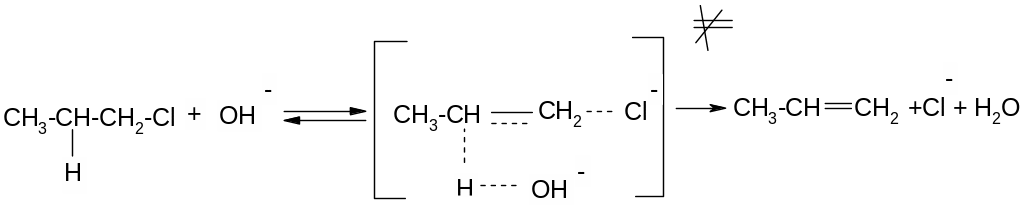
Реакція за механізмом Е2 також прискорюється із збільшенням числа замісників при сусідньому атомі карбону. Це повязоно з утворенням термодинамічно більш вигідного більш розгалуженого Олефіру та меншою міцністю зв’язку С-Н у більш заміщеному атомі карбону.
ІХ. Конкуренція реакцій SN та Е.
Реакції заміщення завжди супроводжуються відщепленням і навпаки. Однак при переході від первинних до третинних галагенопохідних прерд усім полегшуються реакції відщеплення і останні переважають для третинних галагенопохідних. Для третинних галагенопохідних дуже важливо взагалі провести реакцію заміщення. Вона можлива лише тоді, коли використовуються сильні нуклеофіли, які являють собою слабкі нуклеофіли:
![]()
Навпаки, для первинних галагенопохідних переважають реакції заміщення. Вірогідність реакцій відщеплення зростає із збільшенням основності реагентів, в свою чергу реакції заміщення – із збільшенням нуклеофільності реагенту.
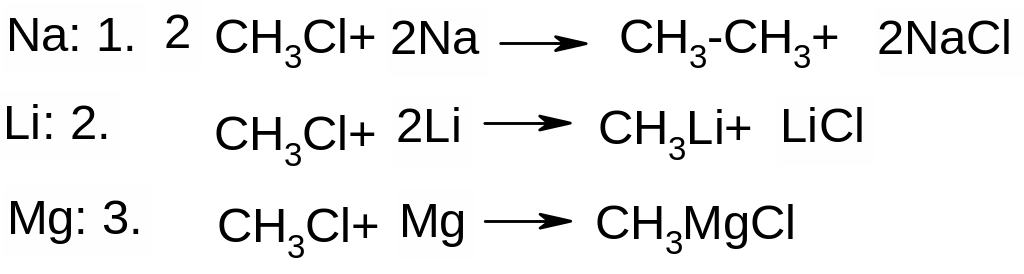
Х. Реакції галогеналканів та галогенаренів з металами.