
- •Типи хімічних зв’язків та їх основні характеристики
- •Будова атома карбону
- •Метод валентних зв’язків
- •Метод мо лкао
- •Класифікація органічних реакцій
- •Класифікація органічних реакцій за типами хімічних перетворень зв’язків
- •Класифікація органічних реакцій за типами розриву зв’язку
- •Класифікація органічних реакцій за типами реагентів
- •Проміжні частинки в органічних реакціях. Взаємний вплив атомів молекулах
- •Алкани (парафіни)
- •Способи одержання алканів
- •Хімічні властивості алканів
- •Окиснення
- •Алкени (олефіни)
- •Способи добування алкенів
- •Дегідратація спиртів (відщеплення води).
- •Дегалогенування віцинальних дігалогеналканів (відщеплення галогенів)
- •Часткове гідрування (відновлення) алкінів (ацетиленів)
- •Хімічні властивості
- •Це явище обумовлене високою стабілізацією алільного проміжного радикалу за рахунок ефекту спряження. Внаслідок, при термічному хлоруванні пропілену:
- •Алкадієни
- •Методи добування
- •Дегідрування бутан-бутиленової бо пентан-пентенової фракції:
- •Дегідратація 1,3- та 1,4- гліколей:
- •Промисловий метод Лєбєдєва із спирту:
- •Електронна бувова спряжених дієнів
- •Хімічні властивості
- •Гідрування.
- •Приєднання галогенів
- •Алкіни (ацетиленові вуглеводні)
- •Методи добування алкінів
- •Аліциклічні сполуки
- •Ароматичні вуглеводні
- •Ароматичні вуглеводні ряду бензолу
- •Добування бензолу та його гомологів
- •Хімічні властивості
- •Прaвила орієнтації електрофільного замііщення в бензольному ядрі
- •Гетероциклічні сполуки
- •Пятичленні гетероциклічні сполуки
- •Способи одержання
- •Хімічні властивості
- •Реакції електрофільного заміщення
- •Шестичленні гетероциклічні сполуки
- •Ароматичні вуглеводні з конденсованими бензольними ядрами нафталін
- •Хімічні властивості
- •Антрацен
- •Загальні методи одержання
- •Хімічні властивості мос (загальні реакції) Магнійорганічні сполуки
- •Перегрупування Арбузова:
- •Галогенпохідні вуглеводнів Галогенпохідними називають сполуки, які містять зв’язки карбон-галоген. Поділяють на
- •Методи добування моногалогенпохідних
- •Хімічні властивості
- •Ароматичні сульфокислоти
- •Хімічні властивості сульфокислот визначаються наявністю сульфогрупи і їх можна розділити на три типи:
- •Реакції сульфогрупи
- •Реакції заміщення сульфогрупи на групи –он; –cn; –nh2.
- •Одно- і багатоатомні спирти
- •Методи одержання спиртів
- •V. Гідрування кетонів.
- •Феноли. Хінони. Методи одержання фенолів
- •Рекція Кольбе-Шмідта – одержання саліцилової кислоти (аспірин)
- •Альдегіди і кетони
- •Способи одержання альдегідів і кетонів
- •Азотовмісні органічні сполуки нітросполуки
- •Способи одержання нітросполук
- •Способи одержання жирно-ароматичних нітросполук
- •Рідкофазне нітруваня за Коноваловим
- •Нуклеофільне заміщення галогену на нітрогрупу
- •Одержання ароматичних нітросполук
- •Хімічні властивості
- •Реакції відновлення з утворенням амінів
- •Класифікація
- •Способи одержання амінів для первинних амінів
- •Для вторинних амінів
- •Для третинних амінів
- •Хімічні властивості
- •Основність амінів
- •Порівняння основності амінів
- •Ароматичні діазо- і азосполуки
- •Реакції діазосполук з виділенням азоту
- •Реакції без виділення азоту
- •Карбонові кислоти
- •Методи одержання одноосновних карбонових кислот
- •6. Реакції окиснення: насичених, ароматичних вуглеводнів, альдегідів і кетонів
- •Гідроліз галогенопохідних
- •Хімічні властивості карбонових кислот
- •Ненасичені кислоти Найпростіші ненасичені одноосновні кислоти:
- •Двохосновні карбонові кислоти
- •Способи одержання двохосновних карбонових кислот
- •Хімічні властивості
- •Кислотні властивості.
- •Реакції за карбоксильною групою
- •Реакції за карбоксильною групою
- •Особливості хімічних властивостей дикарбонових кислот
- •Хімічні властивості
- •Хімічні властивості.
- •Аминокислоты с неполярными или гидрофобными r – группами
- •Аминокислоты с незаряженными полярными r – группами.
Ароматичні вуглеводні ряду бензолу
Бензол є першим членом гомологічного ряду ароматичних вуглеводнів, склад яких відповідає формулі CnH2n-6. Гомологічна різниця, як і раніше, становить (СН2)n.
Ізомерія гомологів і похідних бензолу – зумовлена ізомерією радикалів (замісників), їх кількістю та положенням у бензольному ядрі – на приклад, етилбензол, о-, м- і п-ксилоли.
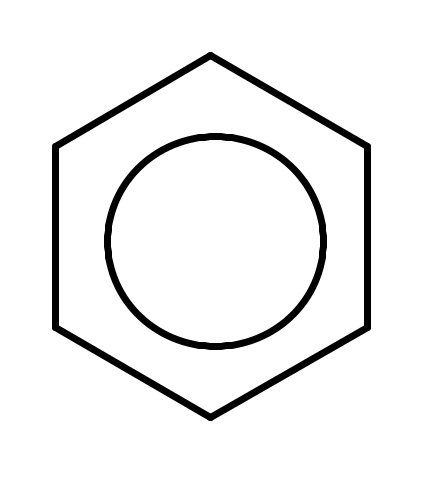
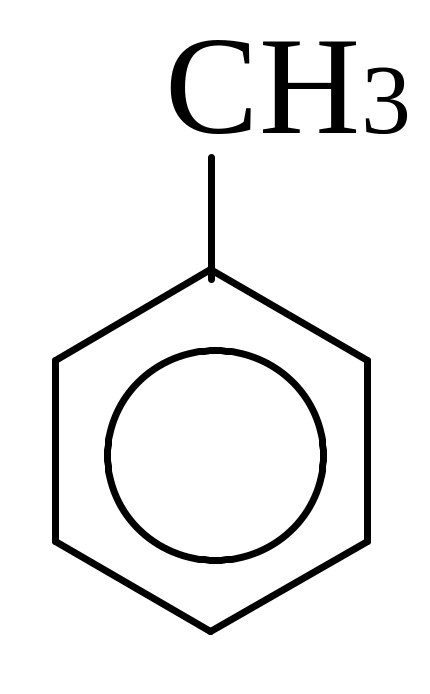
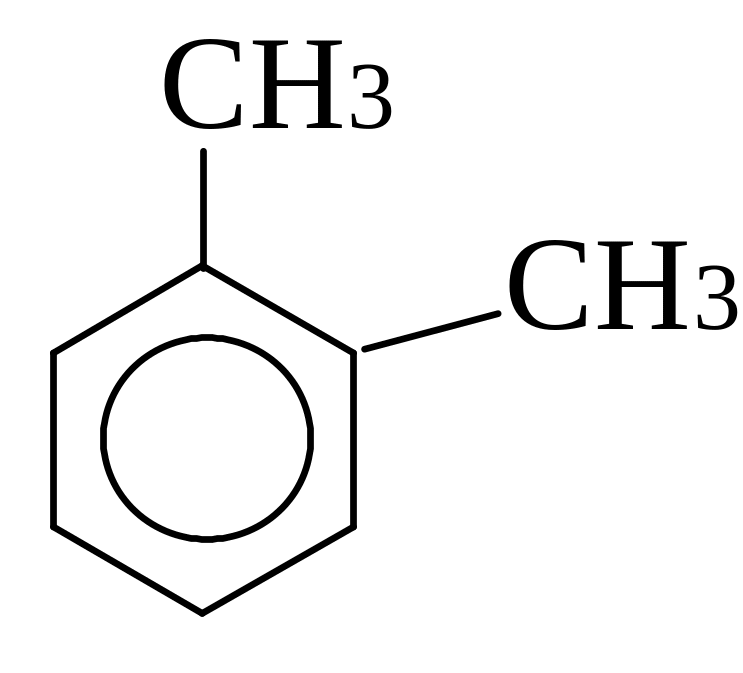
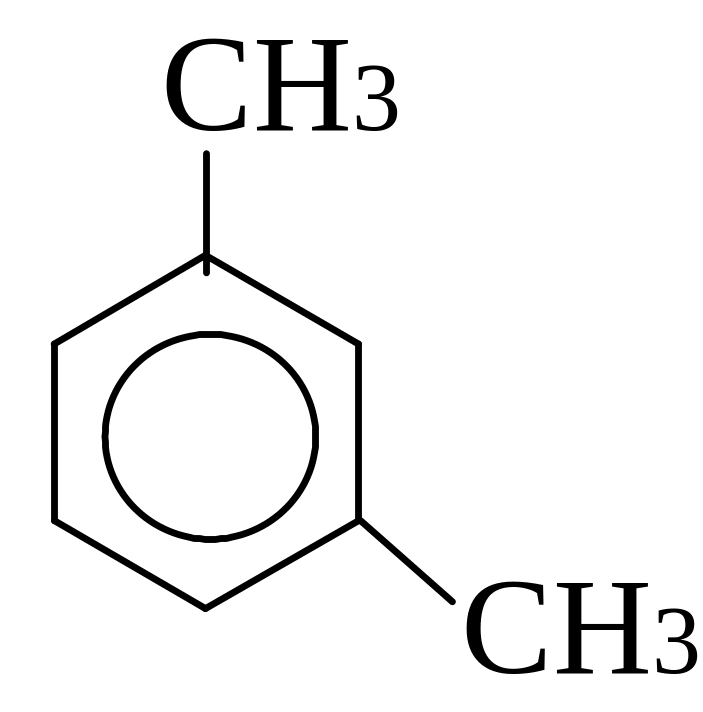
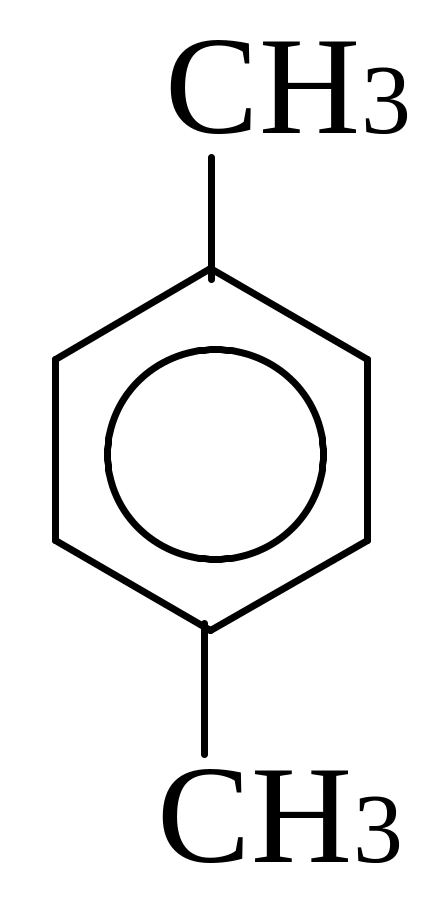
бензол толуол орто-ксилол мета-ксилол пара-ксилол
(метилбензол) (1,2-диметилбензол) (1,3-диметилбензол) (1,4-диметилбензол)
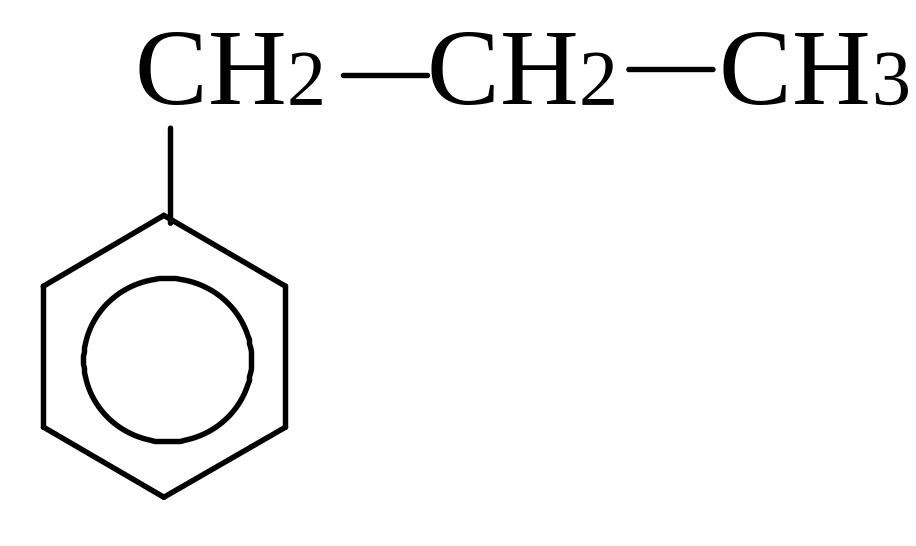
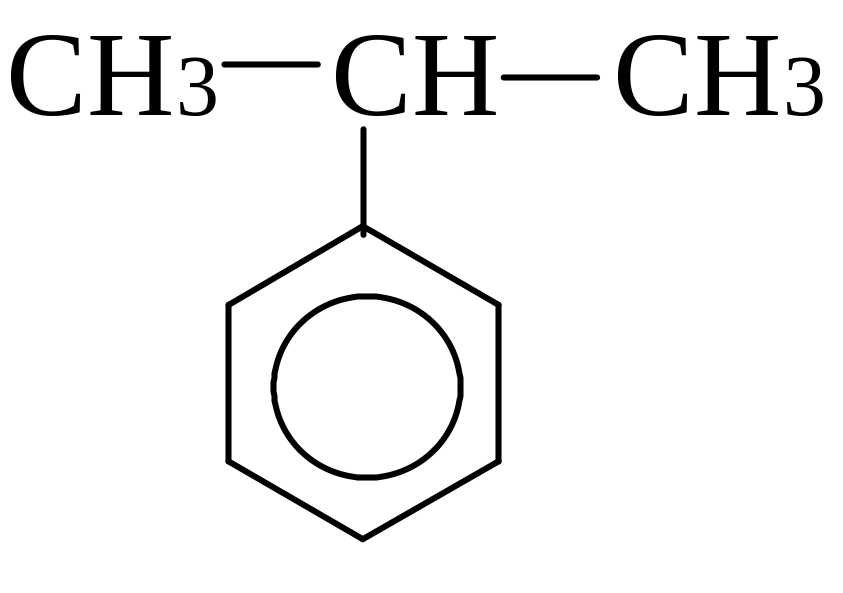
пропілбензол ізопропілбензол (кумол)
Добування бензолу та його гомологів
Основні джерела – коксування кам’яного вугілля та нафти. З метою підвищення масової частки ароматичних вуглеводнів у нафті її піддають ароматизації, в результаті чого з нафти вдається добути до 15-20% ароматичних вуглеводнів.
Ароматизація парафінів – Казанський, Плате, Молдавський (вміст ароматичних вуглеводнів зростає до 50%):
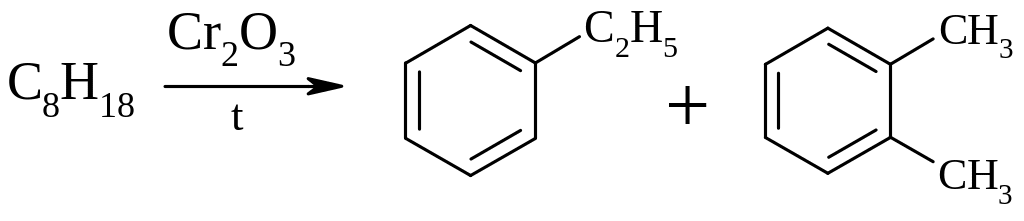
Синтетичні методи:
Реакція Вюрца-Фіттіга, механізм якої аналогічний механізму реакції Вюрца

Алкілування ароматичних вуглеводнів. Реакція Фріделя-Крафтса (SE)
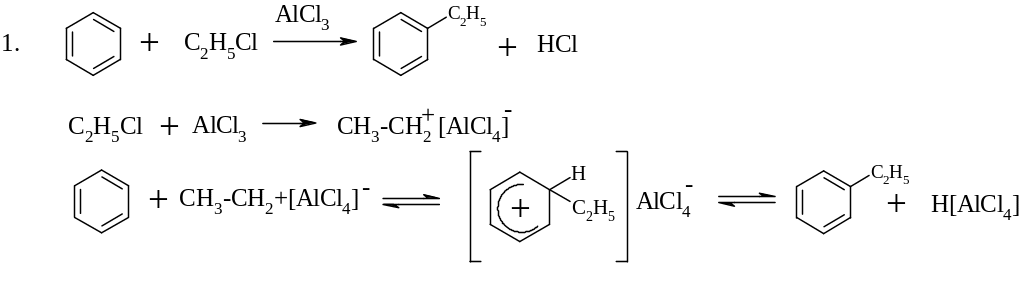
2. Реакція супроводжується ізомеризацією:
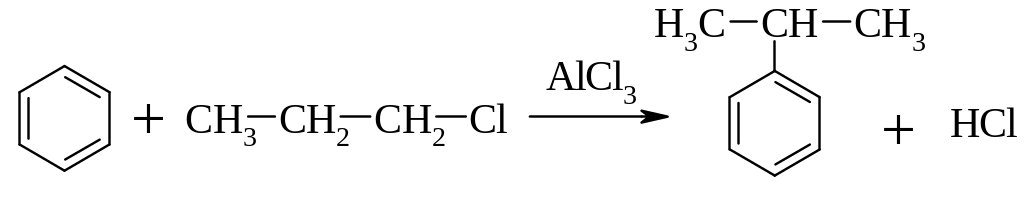
3. Реакція алкілування алкенами – видозмінена реація Фріделя-Крафтса:
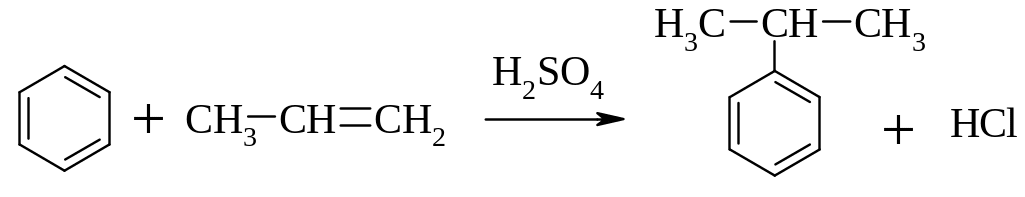
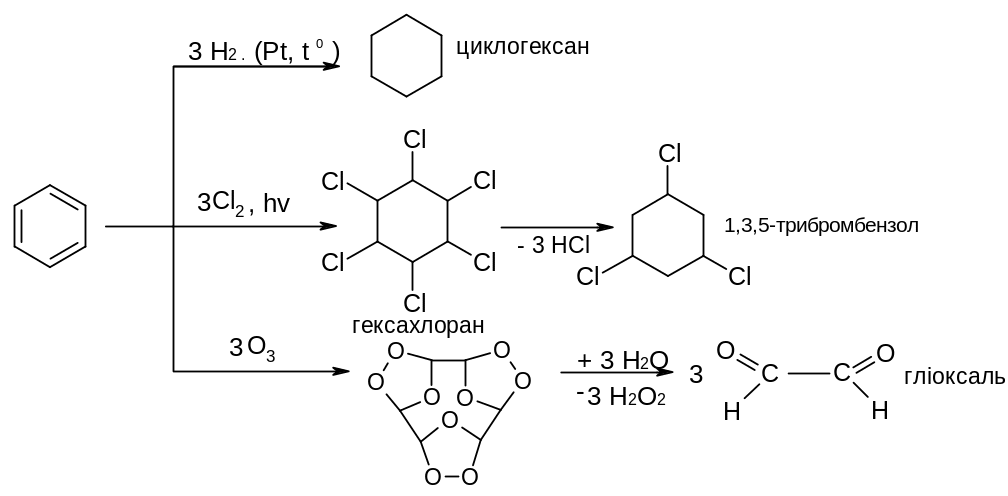
Хімічні властивості
Реакції приєднання:
Р
 еакції
окислення:
еакції
окислення:
а)
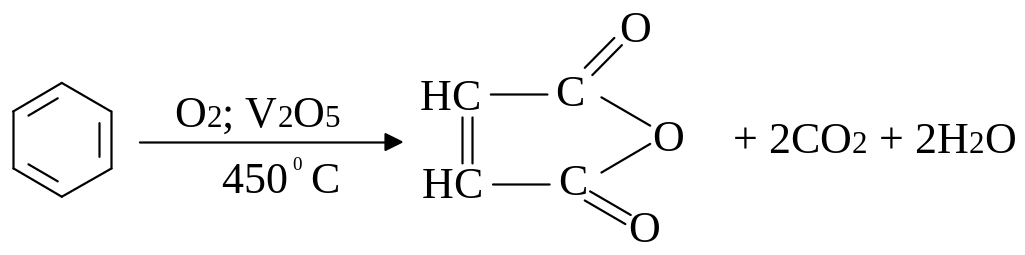
б)
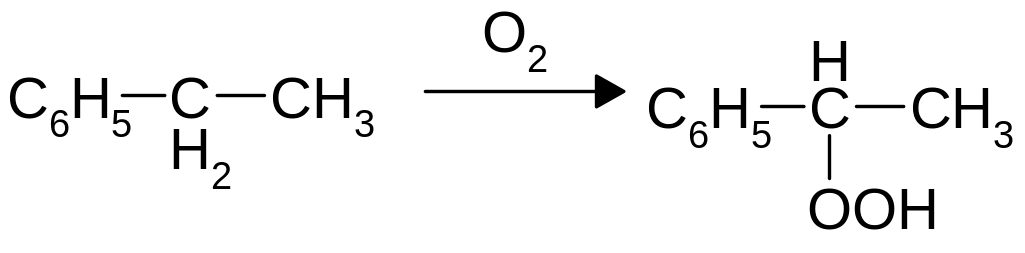
в)
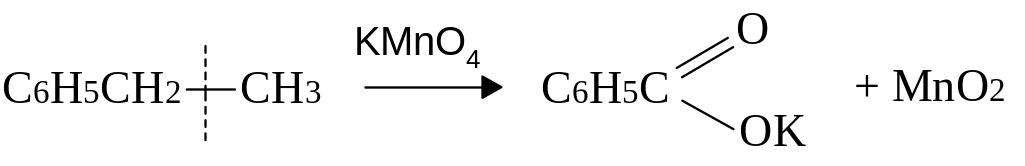
Реакції електрофільного заміщення:
а) Алкілування за Фріделем-Крафтсом:
![]()
б) Ацилювання за Фріделем-Крафтсом:
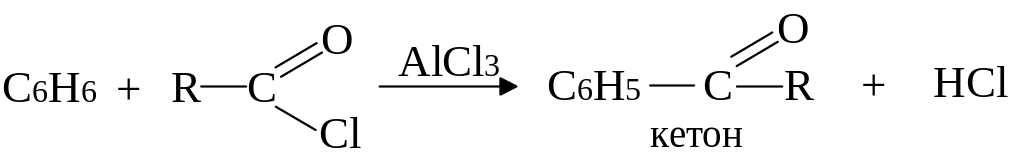
в) Галогенування
![]()
г) Сульфування
![]()
д) Нітрування

Механізм электрофільного заміщення у ароматичному ядрі (SЕ):
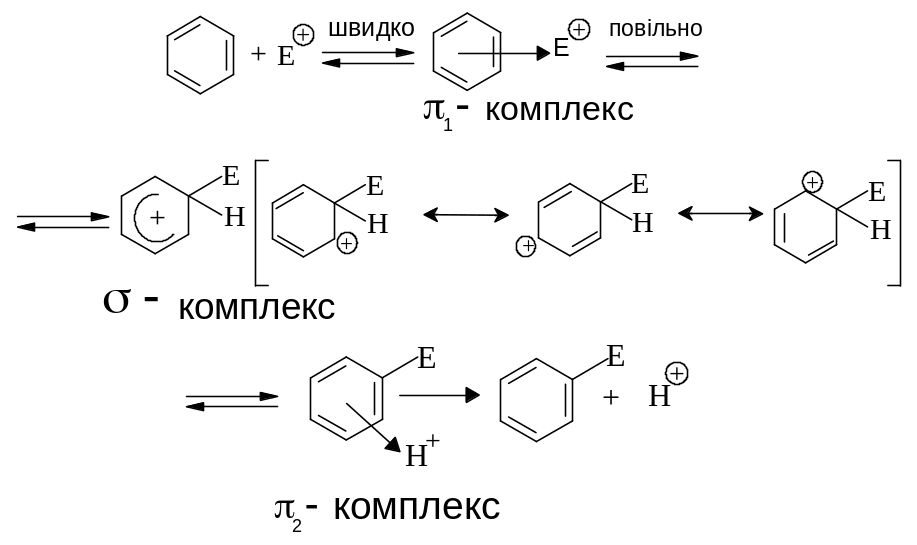
Gершою стадією реакції електрофільного заміщення є утворення π-комплексу – перехідного стану, який виникає із ароматичної сполуки та електрофільного реагенту за рахунок електростатичних сил притягнення між позитивно-зарядженим електрофільм та π-електронами ароматичного сполуки. Утворення π-комплексу проходить дуже швидко, енергія активації утворення π-комплексу (енергія, необхідна для утворення π--комплексу) складає приблизно 35 кДж/моль.
Другою
стадією реакції, визначаючої її швидкість,
є перехід π-комплексу у σ-комплекс. σ-
Комплекс – це проміжна сполука, яку в
окремих випадках можна зареєструвати
або навіть виділити і індивідуальному
стані, як, наприклад,
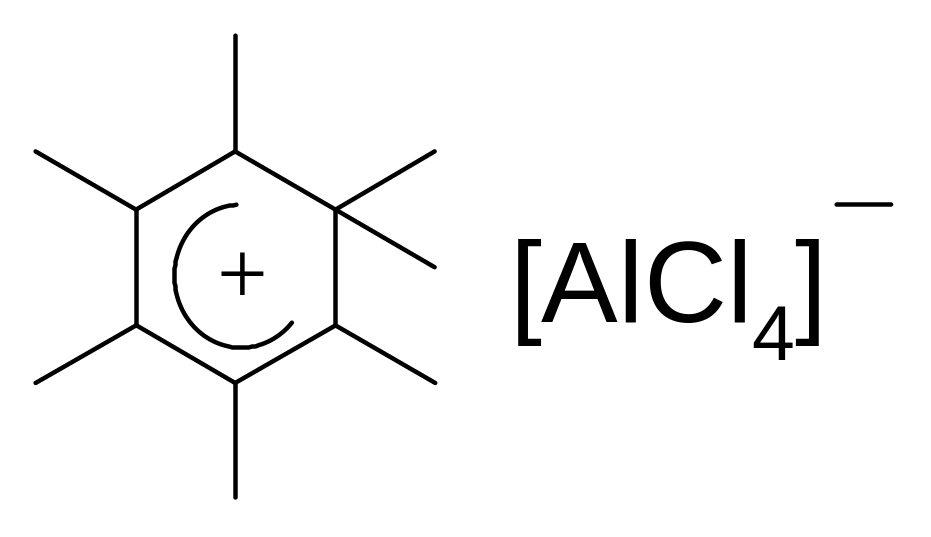 .
σ-Комплекс – це катіон, який вже не має
ароматичних властивостей. В процесі
утворення σ-комплексу атом карбону,
який приєднав електрофіл, переходить
із тригонального sp2-гібридизованого
стану в тетраедричний sp3-гібридизований
стан. При цьому між атомом карбону
ароматичного ядра та електрофілом
виникає σ- зв’язок за рахунок пари
електронів ароматичного секстету. У
бензольному ядрі внаслідок цього
залишається тільки чотири π-електрони
і воно набуває позитивного заряду.
Чотири π-електрони делокалізовани на
п’яти атомах sp2-гібридизованого
карбону. У σ- комплексі як частина Х, так
і атом гідрогену при карбоні, який несе
замісник Х, розміщені у вершинах тетраедру
і не знаходяться в одній площині з
бензольним ядром.
.
σ-Комплекс – це катіон, який вже не має
ароматичних властивостей. В процесі
утворення σ-комплексу атом карбону,
який приєднав електрофіл, переходить
із тригонального sp2-гібридизованого
стану в тетраедричний sp3-гібридизований
стан. При цьому між атомом карбону
ароматичного ядра та електрофілом
виникає σ- зв’язок за рахунок пари
електронів ароматичного секстету. У
бензольному ядрі внаслідок цього
залишається тільки чотири π-електрони
і воно набуває позитивного заряду.
Чотири π-електрони делокалізовани на
п’яти атомах sp2-гібридизованого
карбону. У σ- комплексі як частина Х, так
і атом гідрогену при карбоні, який несе
замісник Х, розміщені у вершинах тетраедру
і не знаходяться в одній площині з
бензольним ядром.
Утворення σ-комплексу потребує значно більше енергії, ніж утворення π-комплексу. Але, в цілому, утворення σ-комплексу не потребує надто великої затрати енергії, оскільки енергія спряження σ-комплексу (109 кДж/моль) близька до енергії бензолу (150 кДж/моль).
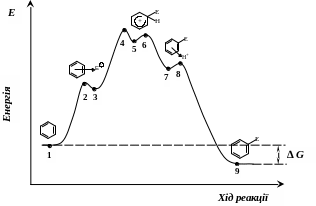 пари
Рис. Енергетична діаграма реакції SE
для бензолу
пари
Рис. Енергетична діаграма реакції SE
для бензолу
Е1 – енергія бензолу ; Е2 – енергія активації утворення π1 – комплексу; Е3– енергія π1 – комплексу; Е4 – енергія активації утворення - комплексу; Е5– енергія - комплексу; Е6 – енергія активації утворення π2 – комплексу; Е7– енергія π2 – комплексу; Е8– енергія активації утворення продукту реакції; Е9– енергія продукту реакції.
Третя стадії реакції – утворення нового π-комплексу за рахунок повернення електронів, яка спонукала sp3-гібридизований стан атому карбону з атомом гідрогену, в бензольний цикл і утворення таким чином знову ароматичного секстету.
Зміна вільної енергії системи реакції електрофільного заміщення зображується такою кривою:
