
- •Типи хімічних зв’язків та їх основні характеристики
- •Будова атома карбону
- •Метод валентних зв’язків
- •Метод мо лкао
- •Класифікація органічних реакцій
- •Класифікація органічних реакцій за типами хімічних перетворень зв’язків
- •Класифікація органічних реакцій за типами розриву зв’язку
- •Класифікація органічних реакцій за типами реагентів
- •Проміжні частинки в органічних реакціях. Взаємний вплив атомів молекулах
- •Алкани (парафіни)
- •Способи одержання алканів
- •Хімічні властивості алканів
- •Окиснення
- •Алкени (олефіни)
- •Способи добування алкенів
- •Дегідратація спиртів (відщеплення води).
- •Дегалогенування віцинальних дігалогеналканів (відщеплення галогенів)
- •Часткове гідрування (відновлення) алкінів (ацетиленів)
- •Хімічні властивості
- •Це явище обумовлене високою стабілізацією алільного проміжного радикалу за рахунок ефекту спряження. Внаслідок, при термічному хлоруванні пропілену:
- •Алкадієни
- •Методи добування
- •Дегідрування бутан-бутиленової бо пентан-пентенової фракції:
- •Дегідратація 1,3- та 1,4- гліколей:
- •Промисловий метод Лєбєдєва із спирту:
- •Електронна бувова спряжених дієнів
- •Хімічні властивості
- •Гідрування.
- •Приєднання галогенів
- •Алкіни (ацетиленові вуглеводні)
- •Методи добування алкінів
- •Аліциклічні сполуки
- •Ароматичні вуглеводні
- •Ароматичні вуглеводні ряду бензолу
- •Добування бензолу та його гомологів
- •Хімічні властивості
- •Прaвила орієнтації електрофільного замііщення в бензольному ядрі
- •Гетероциклічні сполуки
- •Пятичленні гетероциклічні сполуки
- •Способи одержання
- •Хімічні властивості
- •Реакції електрофільного заміщення
- •Шестичленні гетероциклічні сполуки
- •Ароматичні вуглеводні з конденсованими бензольними ядрами нафталін
- •Хімічні властивості
- •Антрацен
- •Загальні методи одержання
- •Хімічні властивості мос (загальні реакції) Магнійорганічні сполуки
- •Перегрупування Арбузова:
- •Галогенпохідні вуглеводнів Галогенпохідними називають сполуки, які містять зв’язки карбон-галоген. Поділяють на
- •Методи добування моногалогенпохідних
- •Хімічні властивості
- •Ароматичні сульфокислоти
- •Хімічні властивості сульфокислот визначаються наявністю сульфогрупи і їх можна розділити на три типи:
- •Реакції сульфогрупи
- •Реакції заміщення сульфогрупи на групи –он; –cn; –nh2.
- •Одно- і багатоатомні спирти
- •Методи одержання спиртів
- •V. Гідрування кетонів.
- •Феноли. Хінони. Методи одержання фенолів
- •Рекція Кольбе-Шмідта – одержання саліцилової кислоти (аспірин)
- •Альдегіди і кетони
- •Способи одержання альдегідів і кетонів
- •Азотовмісні органічні сполуки нітросполуки
- •Способи одержання нітросполук
- •Способи одержання жирно-ароматичних нітросполук
- •Рідкофазне нітруваня за Коноваловим
- •Нуклеофільне заміщення галогену на нітрогрупу
- •Одержання ароматичних нітросполук
- •Хімічні властивості
- •Реакції відновлення з утворенням амінів
- •Класифікація
- •Способи одержання амінів для первинних амінів
- •Для вторинних амінів
- •Для третинних амінів
- •Хімічні властивості
- •Основність амінів
- •Порівняння основності амінів
- •Ароматичні діазо- і азосполуки
- •Реакції діазосполук з виділенням азоту
- •Реакції без виділення азоту
- •Карбонові кислоти
- •Методи одержання одноосновних карбонових кислот
- •6. Реакції окиснення: насичених, ароматичних вуглеводнів, альдегідів і кетонів
- •Гідроліз галогенопохідних
- •Хімічні властивості карбонових кислот
- •Ненасичені кислоти Найпростіші ненасичені одноосновні кислоти:
- •Двохосновні карбонові кислоти
- •Способи одержання двохосновних карбонових кислот
- •Хімічні властивості
- •Кислотні властивості.
- •Реакції за карбоксильною групою
- •Реакції за карбоксильною групою
- •Особливості хімічних властивостей дикарбонових кислот
- •Хімічні властивості
- •Хімічні властивості.
- •Аминокислоты с неполярными или гидрофобными r – группами
- •Аминокислоты с незаряженными полярными r – группами.
Аліциклічні сполуки
Аліциклічні сполуки – це аліфатичні і циклічні вуглеводні, кільце (цикли) яких побудовані тільки з вуглецевих атомів. Назви аліциклічних сполук утворюють шляхом додавання префіксу цикло- до назви відповідного насиченого вуглеводню. Наряду з циклопарафінами існують циклоолефіни тощо.
Для зручності аліциклічні сполуки часто зображують у вигляді простих геометричних фігур: циклопропан – трикутником, циклобутан – квадратом тощо. При цьому розуміється, що у кожного з кутів фігури знаходиться по два атоми гідрогену, якщо не визначена наявність інших груп.
Для аліциклічних сполук характерна структурна ізомерія таких видів:
За числом атомів карбону в циклі:
За числом атомів карбону в замісниках:
За розміщенням замісників у циклі:
Геометрична ізомерія:
Оптична ізомерія при відсутності площини симетрії:
НАПРУЖЕННЯ У ЦИКЛАХ. Моноциклопарафіни залежно від розміру циклу поділяють на циклоалкани з малим (3-4), нормальним (5-7), середнім (8-11) і великим (макро) (12 і більше) циклом. При цьому в залежності від величини циклу циклоалкани мають різні стійкість. Малі цикли нестійкі і в хімічних реакціях та при нагріванні легко розриваються, тоді як інші цикли мають високу міцність.
Для пояснення цього явища Байєр у 1885 році запропонував теорію напруження, згідно з якою мірою стійкості циклу є відхилення валентних кутів у циклах від нормального тетраедричного значення 109028΄. Чим більше відхилення, тим меншу міцність має цикл. Наприклад:
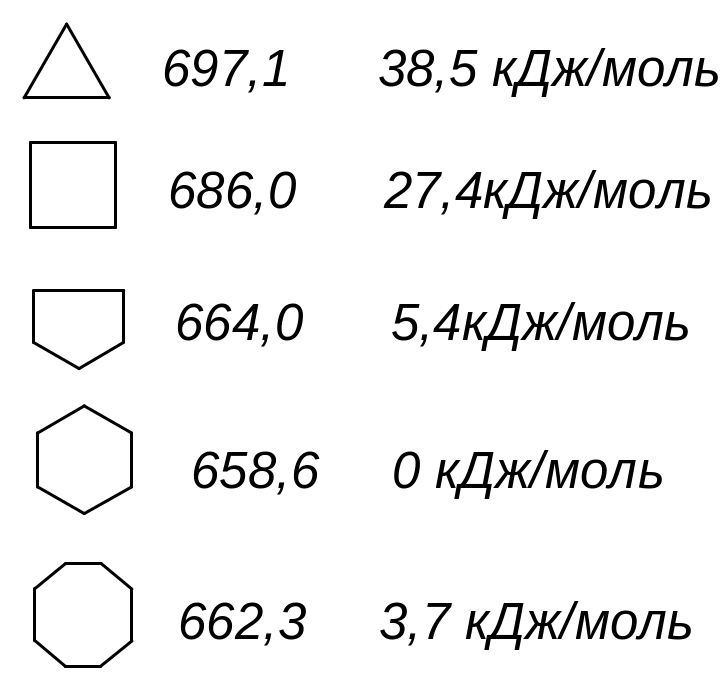
Мірою напруження циклів за Байєром є половина різниці між тетраедричним кутом і валентним кутом атому карбону в циклі при розміщенні всіх атомів карбону в одній і тій же площині. Теорія Байєра змогла пояснити, чому відомі вже на той час три та чотиричленні цикли нестійкі і чому цикл у молекулі циклопентану стійкіший. Проте з цієї гіпотези виходило, що вже циклогексан і інші багаточленні цикли повинні мати напруження і це напруження повинно зростати з розміром циклу. В дійсності ж цього не відбувається. Так, про напруження в циклі можна судити за теплотою згоряння циклічних сполук: чим більша теплота виділяється при згорянні на одну метиленову групу СН2, тим більше напруження в циклі. Експериментально встановлено, що теплота згоряння, яка приходиться на одну групу СН2, найменша для циклогексану. Якщо напруження в цьому циклі прийняти за “0”, то напруження трьохчленному циклі становить 38,5 кДж/моль тощо, а в циклах з числом атомів більше шести – в межах 0-6 кДж/моль. Тобто, з аналізу теплот згоряння виходить, що лише малі цикли мають напруження. Що ж невірно в теорії Байєра ?
Згідно
з сучасними уявленнями, атоми карбону
в циклі окрім циклопропанового,
розміщується в просторі не в одній
площині. Зокрема, для циклогексану були
запропоновані конформації
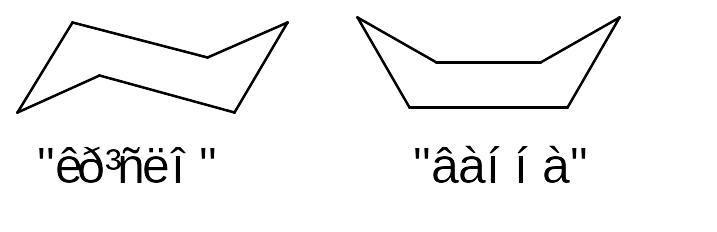 ,
що дозволяє наблизити величини валентних
кутів атомів карбону до значення 109028΄.
,
що дозволяє наблизити величини валентних
кутів атомів карбону до значення 109028΄.
Сучасна теорія енергетичного стану молекул, а отже і їх стійкості, враховує не лише стан валентних кутів, але й можливість обертання навколо зв’язків і взаємне відштовхування атомів в молекулах. Це дало можливість сформулювати загальну теорію напруження в циклах.
У циклах існують різні види напруження.
Кутове (байєрівське) напруження виникає в результаті відхилення валентних кутів від кута 109028΄.
Конформаційне (пітцеровське) напруження виникає в результаті вимушеного повороту зв’язків і відхилення від енергетично найвигідніших загальмованих конформацій. При цьому виникають крутильні (торсійні) сили, які приводять до інверсії циклу – взаємного перетворення конформаційних форм.
Стеричне (Ван-дер-Ваальсівське) напруження виникає внаслідок взаємного відштовхування зближених у просторі атомів гідрогену та груп замісників, яке має місце у випадках, коли атоми або групи атомів зближаються на відстань, меншу за суму їх ван-дер-Ваальсових радіусів.
Диполь-диполне напруження обумовлене відштовхуванням однойменних диполів. Атоми або групи атомів завжди намагаються зайняти таке положення, в якому спостерігається мінімальне диполь-дипольне відштовхування та максимальне диполь-диполне притяжіння.
Напруження в циклі може виникати також як результат зміни міжатомних відстаней за рахунок збільшення або зменшення довжини зв’язків.
В малих циклах існують всі види напруження.
В нормальних циклах відсутнє кутове напруження, а в конформації “крісло” циклогексану відсутні будь-які напруження. Конформація “крісло” на 28,5 кДж/моль вигідніша, ніж конформація “ванна”, в якій є конформаціне та стеричне напруження. В конформаціях циклогексану та інших циклоалканів виділяють два типи зв’язків С-Н - та екваторіальні. В циклогексані відбувається швидкий перехід з однієї конформації “крісло” в іншу, тобто йде процес інверсії циклу. Замісник в циклогексані завжди намагається зайняти екваторіальне положення як енергетично більш вигідне, внаслідок стеричного напруження.
Макроцикли не мають кутового, конфірмаційного та стеричного напружень.
МЕТОДИ ДОБУВАННЯ
І. Загальні методи.
Дегалогенування α, ω-дігілогенпохідних алканів металічним цинком або натрієм.
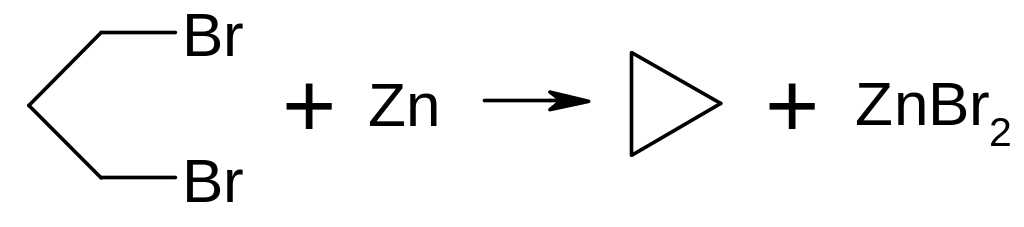
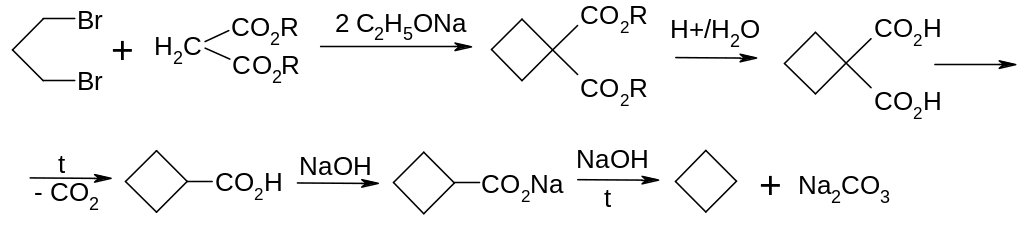
Взаємодія дігалогенпохідних алканів з натріймалоновим ефіром.
Відщеплення галогеноводнів від галоген карбонільних сполук.
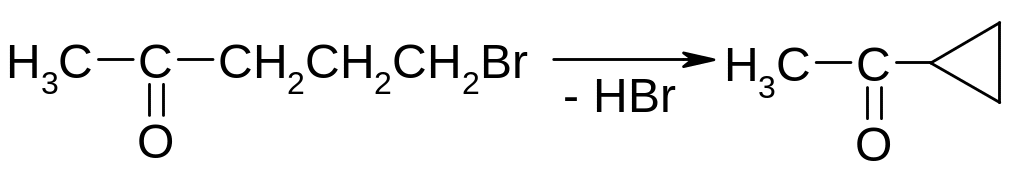
Піроліз солей дикарбонових кислот та самих кислот, придатних до добування циклічних сполук з п’яти та більше атомами карбону в циклі.
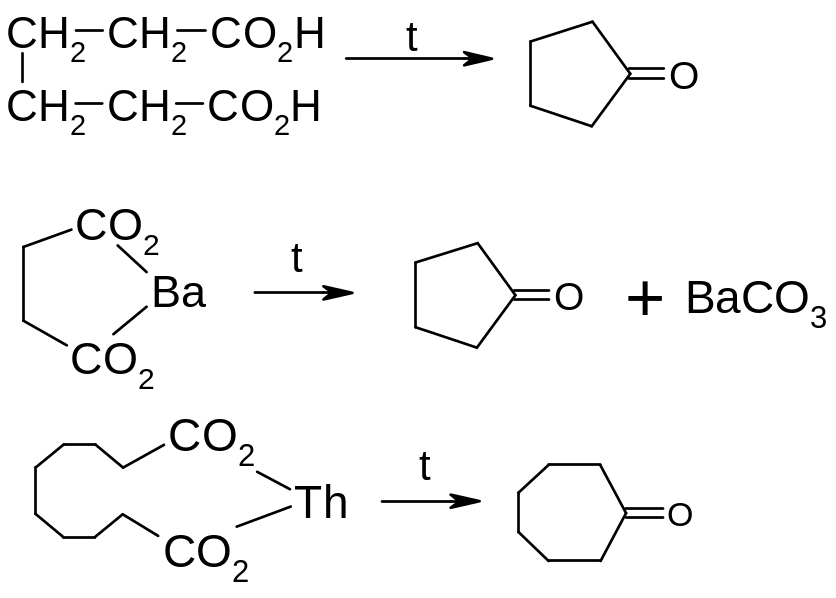
ІІ. Спеціальні методи.
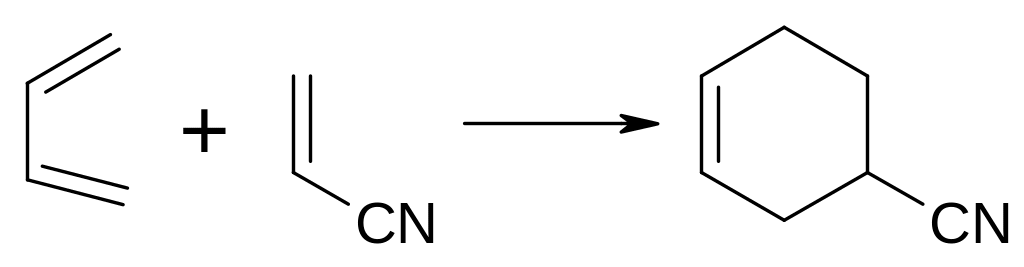
Дієновий синтез:
Гідрування ароматичних вуглеводнів:
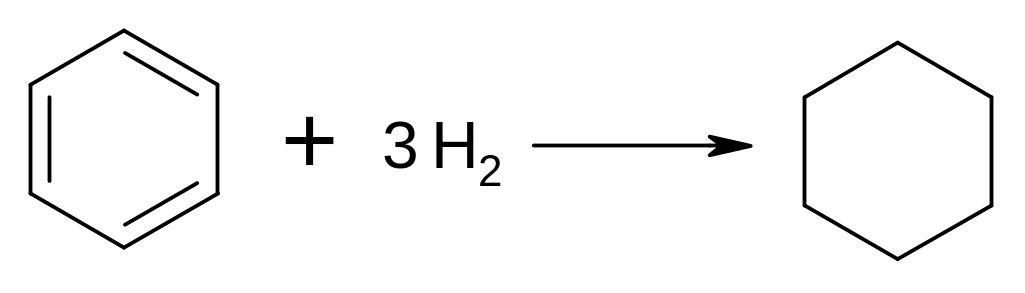
Електронна будова циклопропану. В дійсності валентні кути між атомами карбону в циклопропані становлять не 600, як у правильного трикутнику, але й не 109028΄, як у алканах, а дорівнюють 1040. Такий валентний кут досягається проміжним типом перекривання гібридизованих орбіталей атомів карбону між осьовим (σ) та боковим (π) перекриванням. В дійсності реалізується “банановий” зв’язок, проміжний між σ- та π- зв’язками, оскільки в такому відбувається деяка де локалізація електронів за типом кільцевої π-електронної хмари, яка оточує цикл і розміщена в одній з ним площині. Оскільки “банановий” зв’язок проміжний, він здатний вступати до реакцій приєднання, як ненасичені сполуки (етилен), але значно гірше. В той же час валентний кут Н-С-Н в циклопропані становить 1180 і майже дорівнює валентному куту в етилені. Звісно, і гібридизація атомів карбону проміжна між sp3 та sp2.
ХІМІЧНІ ВЛАСТИВОСТІ
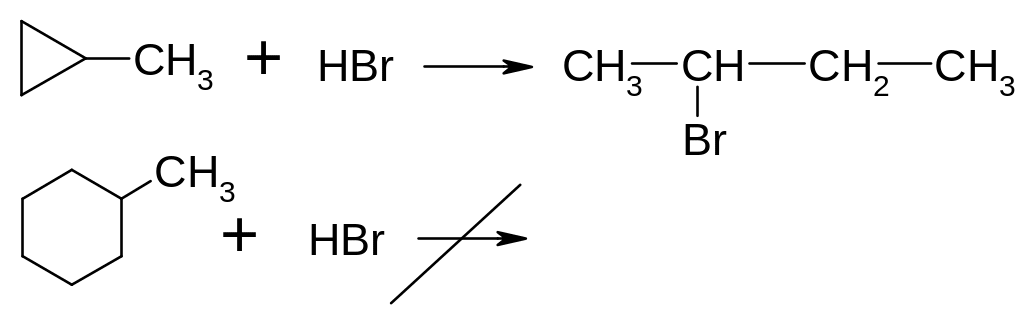
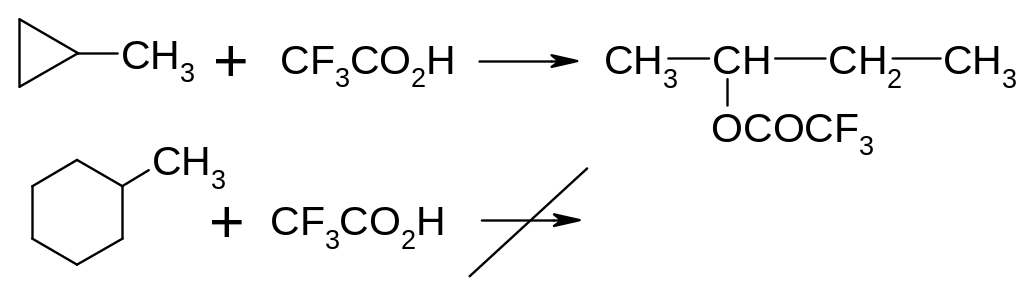
Хімічні властивості циклоалканів визначаються в основному розміром циклу. Для 3-х і 4-х членних циклів характерні реакції приєднання, які супроводжуються розривом циклу, тоді як для всіх інших циклоалканів – характерні реакції заміщення, як і для алканів.
Гідрування:
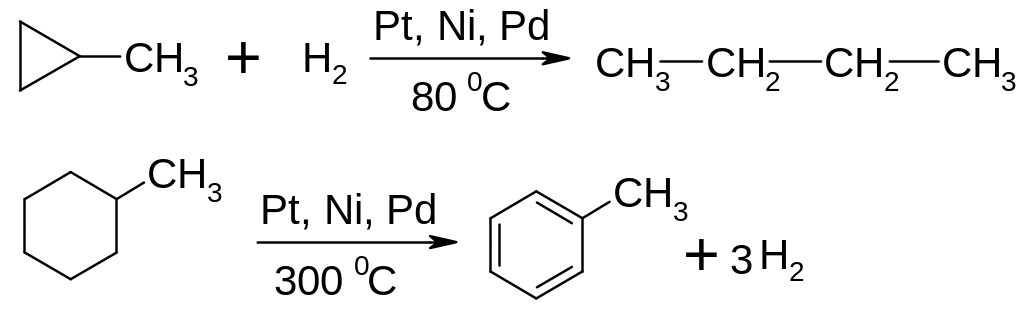
Галогенування:
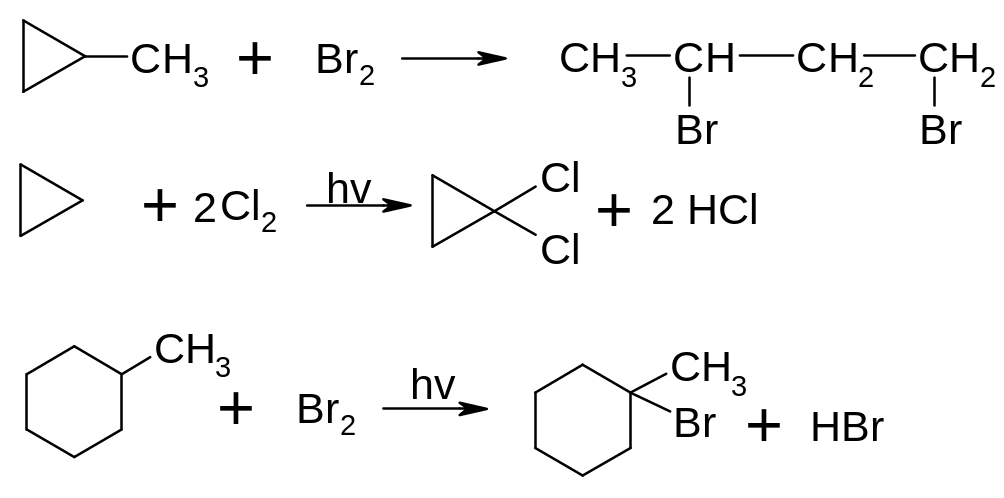
Гідрогалогенування:
Взаємодія з сильними кисеньвмісними кислотами:
Окиснення. Циклоалкани не реагують з озоном і з розведеними розчином KMnO4. Під дією сильніших окислювачів (нітратної кислоти, кисень при наявності каталізаторів, концентрований розчин KMnO4) відбувається поступове окиснення з розривом циклу і утворенням дикарбонових кислот:
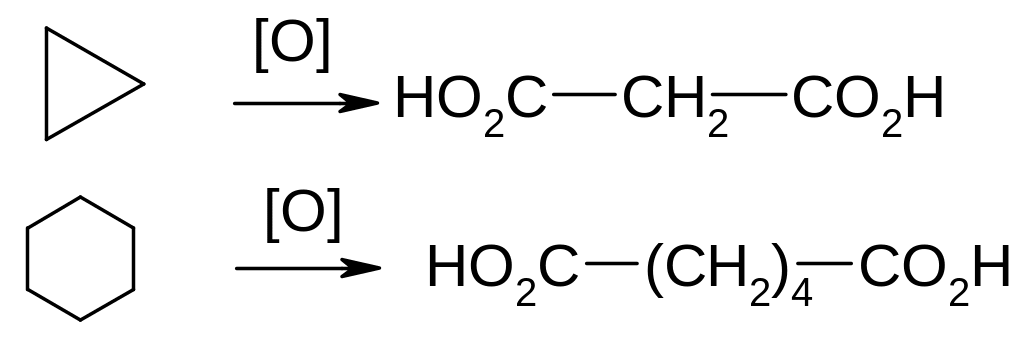
Реакція розширення циклу:
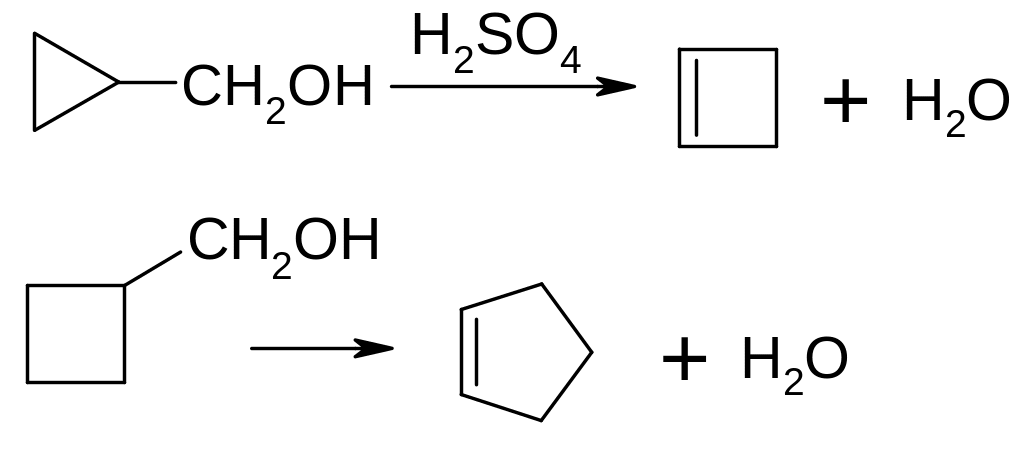
Реакція звуження циклу:

