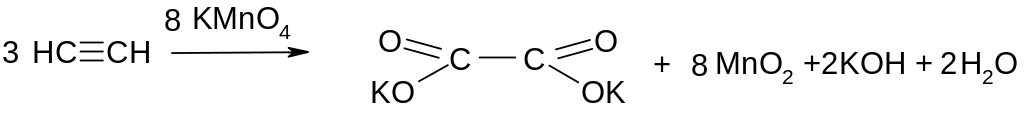- •Типи хімічних зв’язків та їх основні характеристики
- •Будова атома карбону
- •Метод валентних зв’язків
- •Метод мо лкао
- •Класифікація органічних реакцій
- •Класифікація органічних реакцій за типами хімічних перетворень зв’язків
- •Класифікація органічних реакцій за типами розриву зв’язку
- •Класифікація органічних реакцій за типами реагентів
- •Проміжні частинки в органічних реакціях. Взаємний вплив атомів молекулах
- •Алкани (парафіни)
- •Способи одержання алканів
- •Хімічні властивості алканів
- •Окиснення
- •Алкени (олефіни)
- •Способи добування алкенів
- •Дегідратація спиртів (відщеплення води).
- •Дегалогенування віцинальних дігалогеналканів (відщеплення галогенів)
- •Часткове гідрування (відновлення) алкінів (ацетиленів)
- •Хімічні властивості
- •Це явище обумовлене високою стабілізацією алільного проміжного радикалу за рахунок ефекту спряження. Внаслідок, при термічному хлоруванні пропілену:
- •Алкадієни
- •Методи добування
- •Дегідрування бутан-бутиленової бо пентан-пентенової фракції:
- •Дегідратація 1,3- та 1,4- гліколей:
- •Промисловий метод Лєбєдєва із спирту:
- •Електронна бувова спряжених дієнів
- •Хімічні властивості
- •Гідрування.
- •Приєднання галогенів
- •Алкіни (ацетиленові вуглеводні)
- •Методи добування алкінів
- •Аліциклічні сполуки
- •Ароматичні вуглеводні
- •Ароматичні вуглеводні ряду бензолу
- •Добування бензолу та його гомологів
- •Хімічні властивості
- •Прaвила орієнтації електрофільного замііщення в бензольному ядрі
- •Гетероциклічні сполуки
- •Пятичленні гетероциклічні сполуки
- •Способи одержання
- •Хімічні властивості
- •Реакції електрофільного заміщення
- •Шестичленні гетероциклічні сполуки
- •Ароматичні вуглеводні з конденсованими бензольними ядрами нафталін
- •Хімічні властивості
- •Антрацен
- •Загальні методи одержання
- •Хімічні властивості мос (загальні реакції) Магнійорганічні сполуки
- •Перегрупування Арбузова:
- •Галогенпохідні вуглеводнів Галогенпохідними називають сполуки, які містять зв’язки карбон-галоген. Поділяють на
- •Методи добування моногалогенпохідних
- •Хімічні властивості
- •Ароматичні сульфокислоти
- •Хімічні властивості сульфокислот визначаються наявністю сульфогрупи і їх можна розділити на три типи:
- •Реакції сульфогрупи
- •Реакції заміщення сульфогрупи на групи –он; –cn; –nh2.
- •Одно- і багатоатомні спирти
- •Методи одержання спиртів
- •V. Гідрування кетонів.
- •Феноли. Хінони. Методи одержання фенолів
- •Рекція Кольбе-Шмідта – одержання саліцилової кислоти (аспірин)
- •Альдегіди і кетони
- •Способи одержання альдегідів і кетонів
- •Азотовмісні органічні сполуки нітросполуки
- •Способи одержання нітросполук
- •Способи одержання жирно-ароматичних нітросполук
- •Рідкофазне нітруваня за Коноваловим
- •Нуклеофільне заміщення галогену на нітрогрупу
- •Одержання ароматичних нітросполук
- •Хімічні властивості
- •Реакції відновлення з утворенням амінів
- •Класифікація
- •Способи одержання амінів для первинних амінів
- •Для вторинних амінів
- •Для третинних амінів
- •Хімічні властивості
- •Основність амінів
- •Порівняння основності амінів
- •Ароматичні діазо- і азосполуки
- •Реакції діазосполук з виділенням азоту
- •Реакції без виділення азоту
- •Карбонові кислоти
- •Методи одержання одноосновних карбонових кислот
- •6. Реакції окиснення: насичених, ароматичних вуглеводнів, альдегідів і кетонів
- •Гідроліз галогенопохідних
- •Хімічні властивості карбонових кислот
- •Ненасичені кислоти Найпростіші ненасичені одноосновні кислоти:
- •Двохосновні карбонові кислоти
- •Способи одержання двохосновних карбонових кислот
- •Хімічні властивості
- •Кислотні властивості.
- •Реакції за карбоксильною групою
- •Реакції за карбоксильною групою
- •Особливості хімічних властивостей дикарбонових кислот
- •Хімічні властивості
- •Хімічні властивості.
- •Аминокислоты с неполярными или гидрофобными r – группами
- •Аминокислоты с незаряженными полярными r – группами.
Хімічні властивості
Для спряжених дієнів, як і для алкенів, характерні реакції приєднання.
Гідрування.
а) Атомарний водень приєднується переважно в положення 1,4:
![]()
б) Водень при наявності каталізатора приєднується в положення 1,2- і 1,4:
![]()
Приєднання галогенів
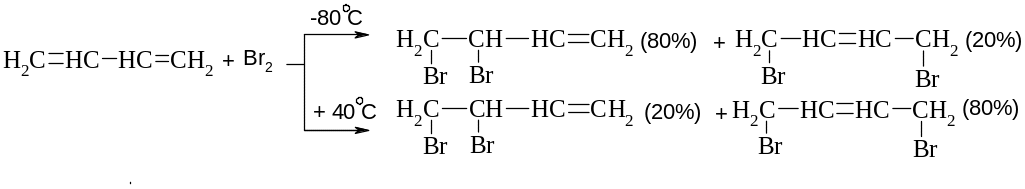 Механізм:
Механізм: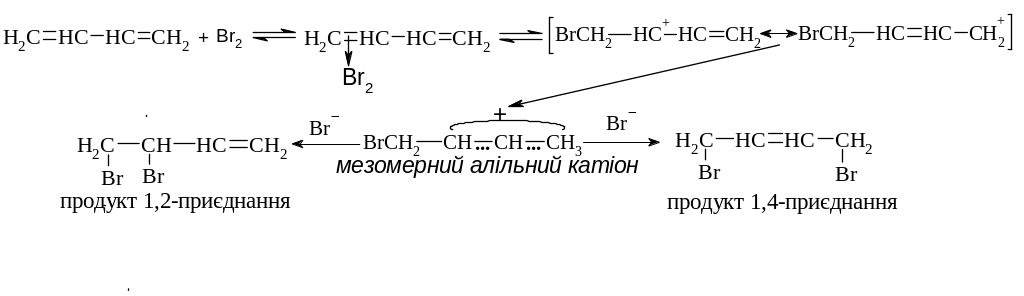
Приєднання галогеноводнів. Відбувається аналогічно приєднанню галогенів.
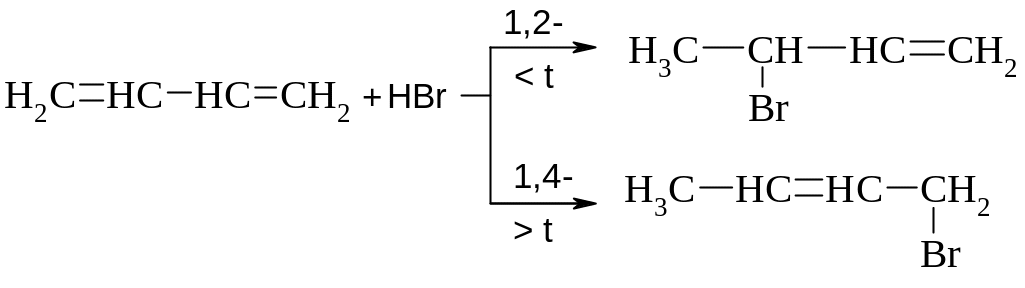
Гіпогалогенування – незалежно від умов реакції приводить переважно до продукту 1,2- приєднання, так як цей продукт і швидше утворюється, і більш термодинамічно стійкіший.
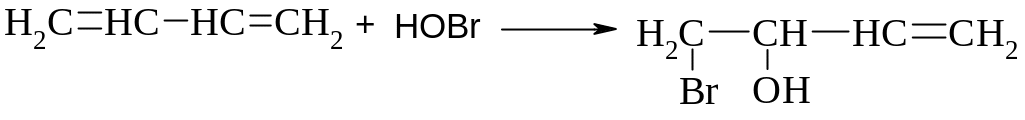
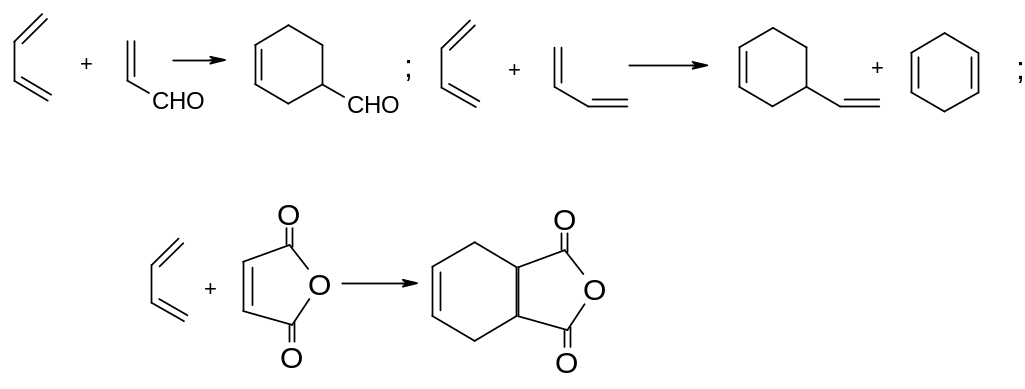
Дієновий синтез. Реакція Дільса-Альдера. Дієновий синтез називають реакцію 1,4-приєднання, з утворенням ненасичених шестичленних циклічних сполук:
Полімеризація.
Природний каучук: цис-1,4-поліізопрен. Гутаперча: транс-1,4-поліізопрен
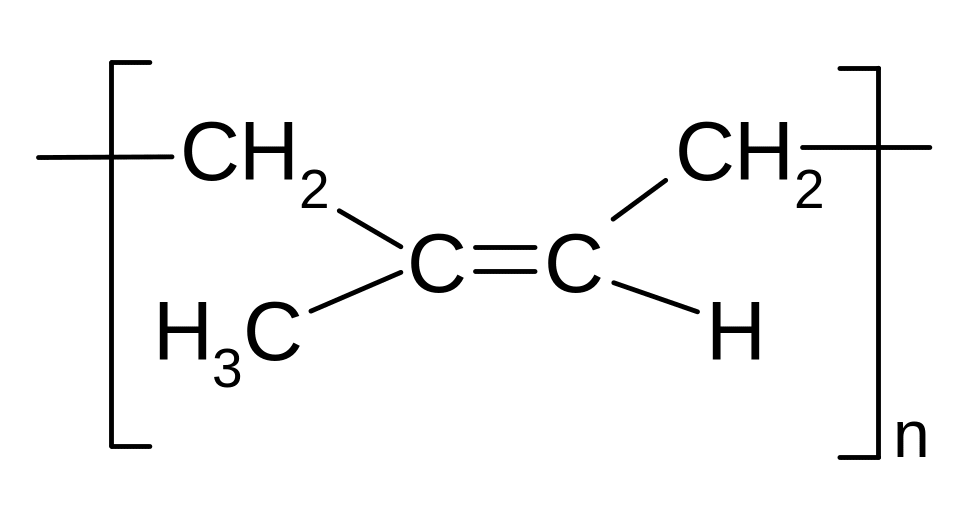
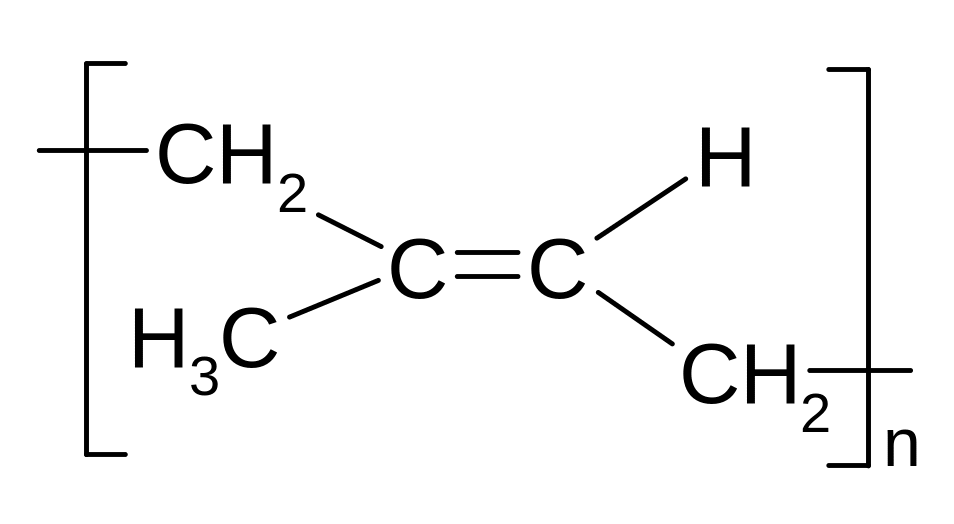
а) Синтетичний каучук СКБ (каталізатори Ціглера-Натта - AlEt3 + TiCl4 ):
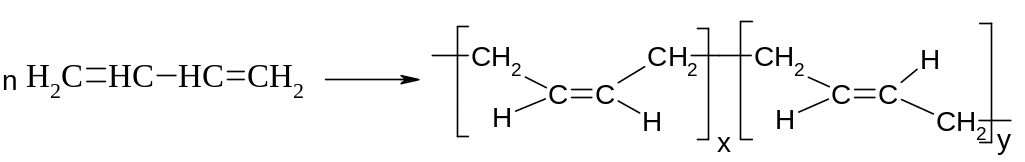
б) СКС:
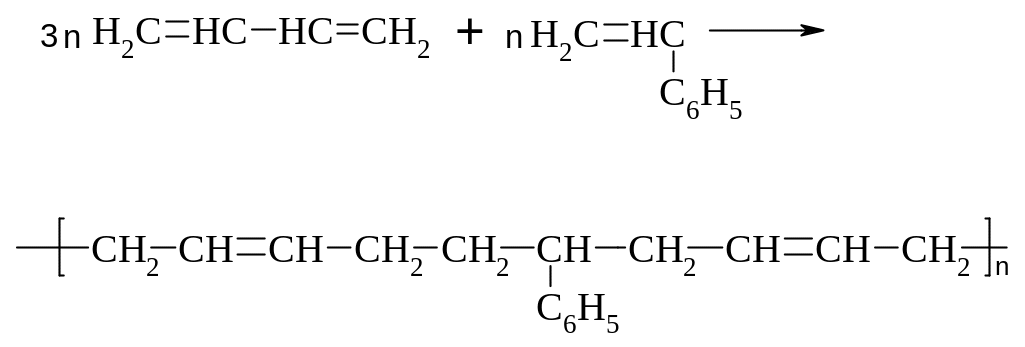
в) СКН:
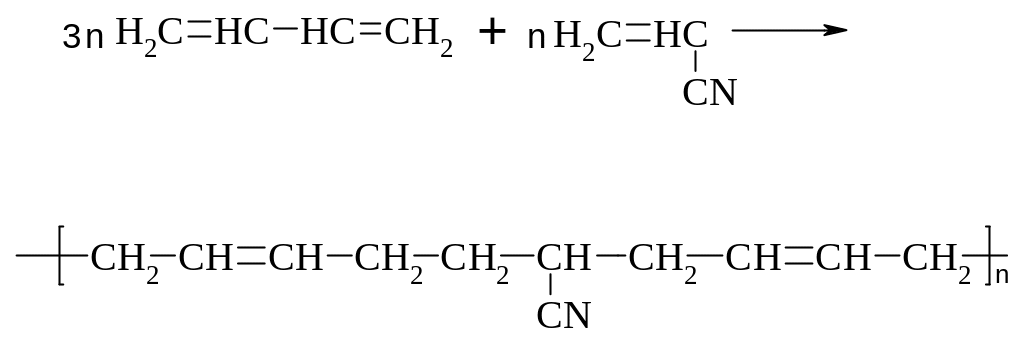
г) СКХ:
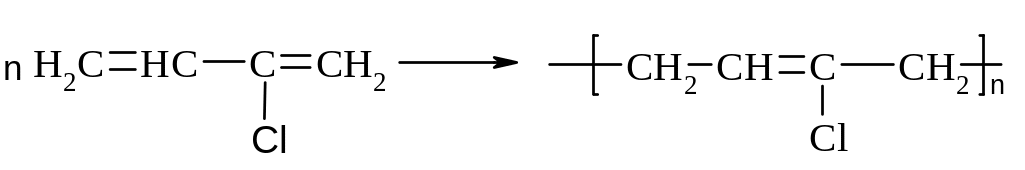
Алкіни (ацетиленові вуглеводні)
Алкінами
називають ненасичені вуглеводні,
молекули яких містять між карбоновими
атомами потрійний зв’язок
![]() .
Загальна формула CnH2n-2.
.
Загальна формула CnH2n-2.
Методи добування алкінів
І. Промислові.
Окислювальний піроліз алканів:
![]()
Піроліз алканів:
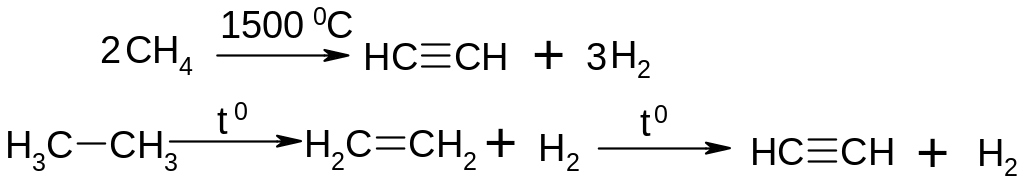
Карбідний метод:
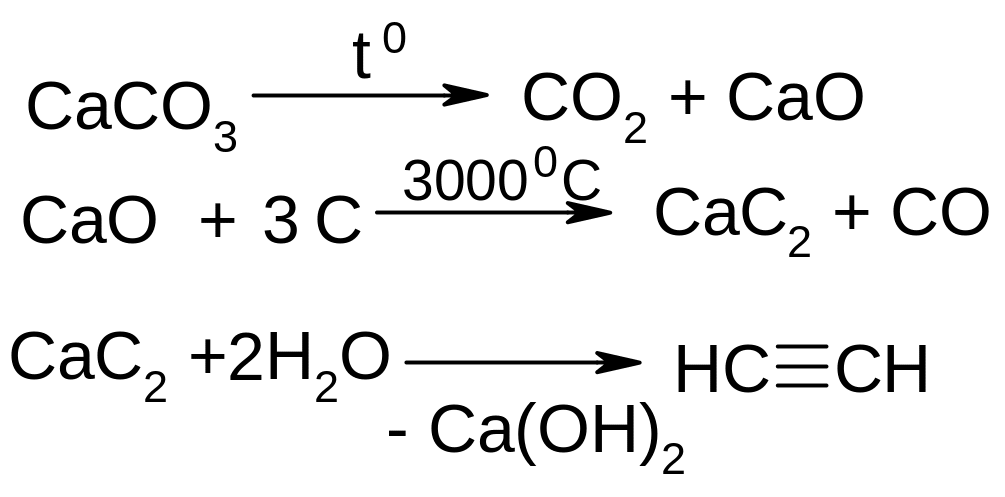
ІІ. Лабораторні:
Дегідрогалогенування віцинальних та гемінальних дигалогеналканів:
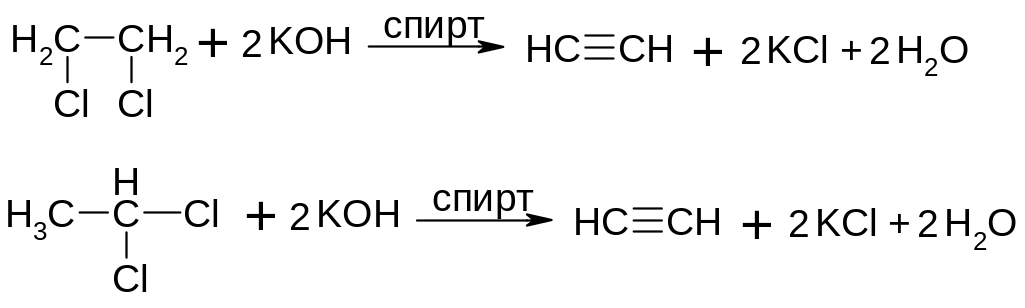
Алкілування ацетиленідів
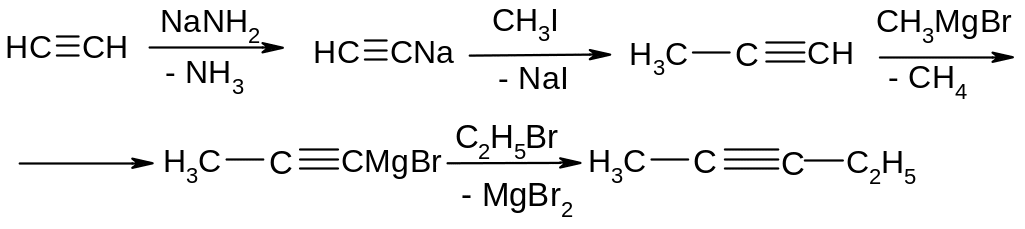
БУДОВА
Потрійний зв’язок в ацетилені являє собою комбінацію σ- зв’язку, який утворюється внаслідок перекривання двох sp-гібридних орбіталей атомів карбону та двох π- зв’язків, які утворюються внаслідок попарного перекривання чотирьох р-орбіталей.
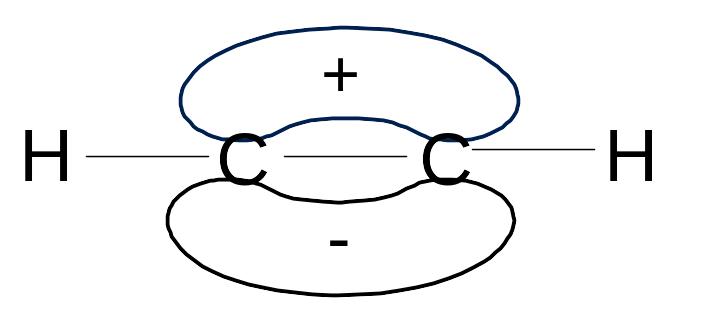
Довжина зв’язку в ацетилені становить 0,121 нм, тобто коротша довжини подвійного зв’язку в етилені (0,134 нм); в етані (0,154 нм). Скорочення зв’язку обумовлено:
а) участю в утворенні σ- зв’язку двох sp-гібридних орбіталей з меншими власним радіусом;
б) допоміжним скороченням зв’язку за рахунок утворення двох π- зв’язків.
Енергія зв’язку в ацетилені набагато більша, ніж в етилені чи етані. Загальна енергія зв’язку 812 кДж/моль. Але якщо енергія зв’язку С-С в етані становить 344 кДж/моль то в середньому енергія π- зв’язку становить лише 234 кДж/моль, тобто на 110 кДж/моль менша енергії σ- зв’язку. Відповідно, для ацетилену будуть характерні реакції з розривом зв’язку . Але при цьому. . .
Енергія іонізації зв’язку (енергія, необхідна для вибивання електрону з π- зв’язку ) дорівнює 11,4 еВ, що значно більше ЕІ СН2=СН2 – 10,5 еВ та практично дорівнює ЕІ СН3–СН3 – 11,6 еВ. Отже, електрони π- зв’язків в ацетилені міцно утримуються атомами карбону і вони значно менш придатні для атаки електрофілом, ніж π-електрони алкенів. Це відповідає sp-гібридизації атому карбону. При цьому енергія іонізації ацетиленових вуглеводнів різко зменшується при введенні алкільних груп. Так для пропілену ЕІ становить лише 10,4 еВ. Отже, пропілен в реакціях електрофільного приєднання буде реагувати значно легше, ніж ацетилен. Питання чому? Тому, що потрійний зв’язок легко поляризується і заміщені ацетилени більш поляризовані, ніж алкени. Наприклад, дипольний момент пропілену становить 0,35D, тоді як пропіну – 0,75D.
Довжина зв’язку С-Н в ацетилені також менша, ніж в алкенах і алканах і відповідно становить 0,106, 0,108, 0,109 нм. Відповідно, енергія зв’язку С-Н в ацетилені більша. Тобто, sp-гібридизація атому карбону в ацетилені зашкоджує гомолітичному розриву зв’язку С-Н з утворенням вільних радикалів. Але внаслідок більшої поляризації зв’язку С-Н в ацетилені із-за більшої електронегативності sp-гібридизованого атому карбону (2,75, 2,62 та 2,50 для sp, sp2, sp3 - гібридизованих атомів карбону) полегшується гетеролітичний розрив зв’язку С-Н з утворенням йонів. КдисС2Н2 = 10-22, тоді як КдисС2Н6 = 10-40.
ХІМІЧНІ ВЛАСТИВОСТІ
Алкіни вступають в реакції приєднання, які можуть відбуватися за радикальним, електрофільним та нуклеофільним механізмами, а також в реакції заміщення атомів водню, розміщених біля атому карбону з потрійним зв’язком.
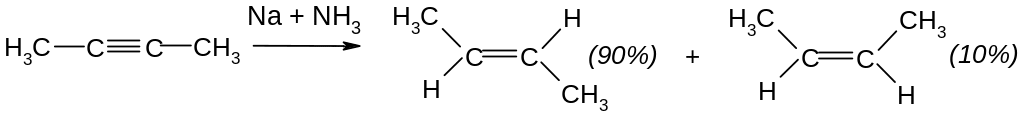
І. Приєднання радикальних реагентів. Гідрування. Потрійний зв’язок гідрується легше, ніж подвійний зв’язок в алкенах.
а) Водень в момент народження:
б) Каталітичне гідрування:
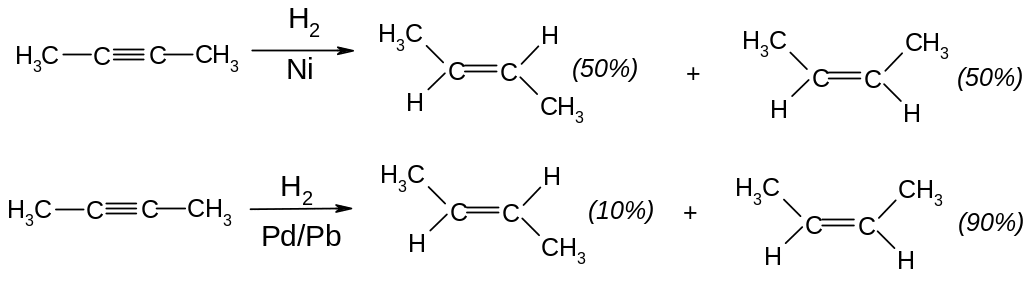
Реакції, які переважно приводять до одного з кількох можливих стереоізомерів називають стереоселективними; реакції, які приводять до одного з кількох можливих – стереоспецифічними.
ІІ. Приєднання електрофільних реагентів.
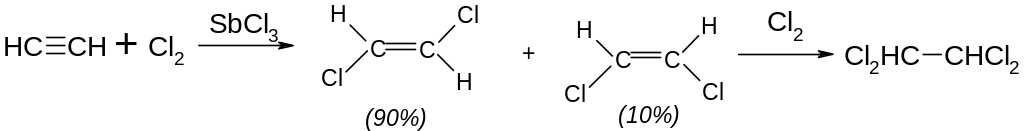
Галогенування – може відбуватися, як за радикальним, так і електрофільним механізмом. Електрофільне галогенування відбувається транс-стереоселективно:
Гідргалогенування – відбувається також транс-стереоселективно, за правилом Марковнікова.
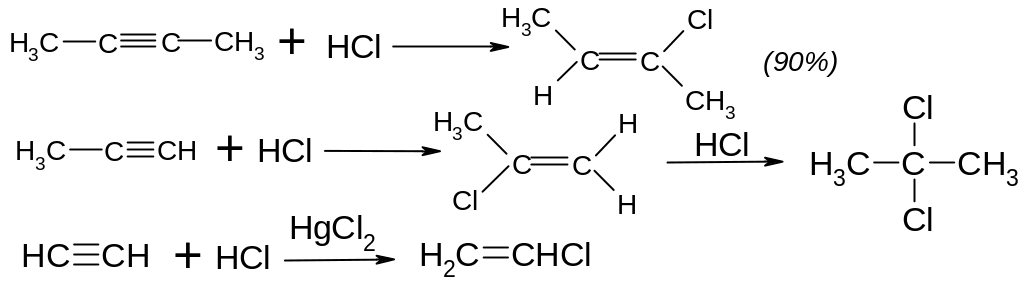
ІІІ. Приєднання нуклеофільних реагентів.
В присутності каталізаторів, які збільшують електрофільність потрійного зв’язку. Приєднання Н2О.
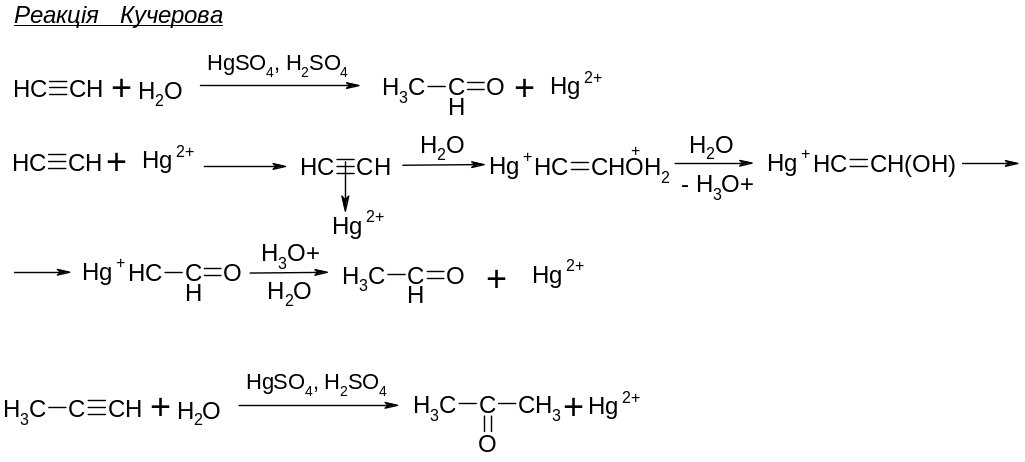
Правило Ельтекова: ненасичені спирти з групою ОН біля атому карбону з подвійним зв’язком нестійкі і самовільно ізомеризуються в стійкі карбонільні сполуки. Між енольною та карбонільною сполуками існує рівновага:
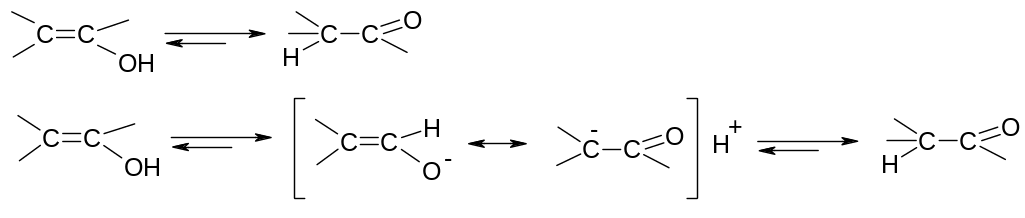
Причина ізомеризації – висока полярність зв’язку ОН. При приєднанні протону знову до атому оксигену, він може знову відщеплюватися, при приєднанні до атому карбону – значно гірше, тобто поляризація зв’язку С-Н значно менша. В результаті відбувається перегрупування, при якому сильніша кислота перетворюється на слабшу. Структурні ізомери, між якими в нормальному стані існує рівновага називаються таутомерами.
В присутності каталізаторів, які збільшують нуклеофільність реагентів.
Приєднання спиртів з утворенням вінілових ефірів:
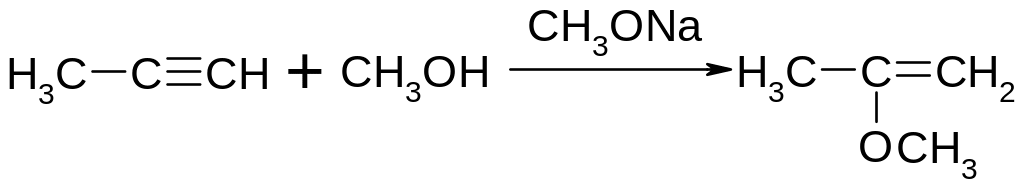
Приєднання синільної кислоти з утворенням нітрилів:
![]()
Приєднання оцтової кислоти:
![]()
ІV. Карбонолування алкінів
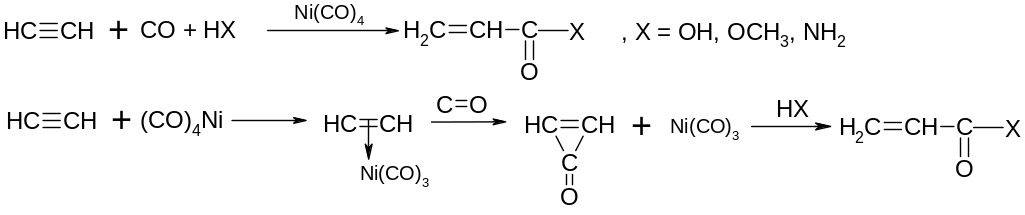 V.
Реакції заміщення:
V.
Реакції заміщення:
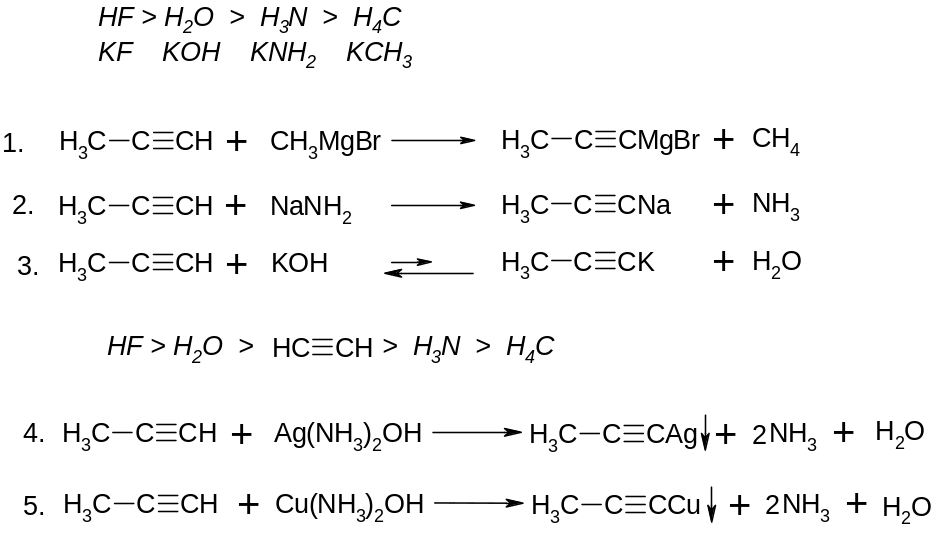
VІ. Реакції приєднання до альдегідів та кетонів:
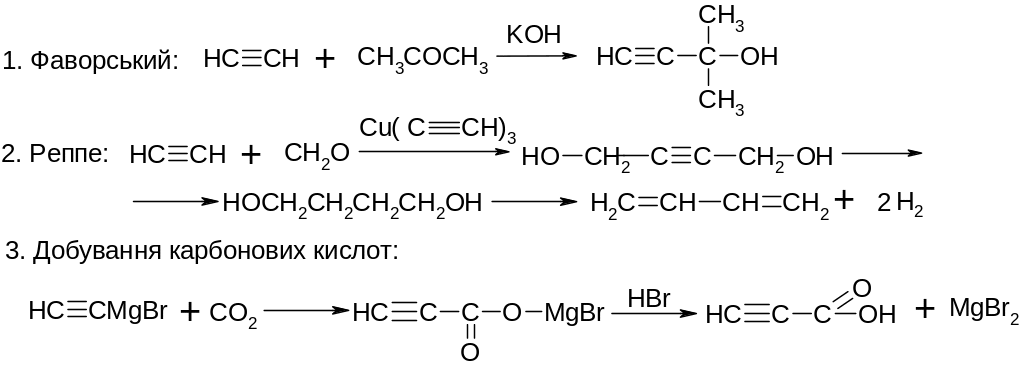
VІІ. Реакції заміщення атому гідрогену біля потрійного зв’язку на галоген:
![]()
VІІІ. Реакції полімеризації:
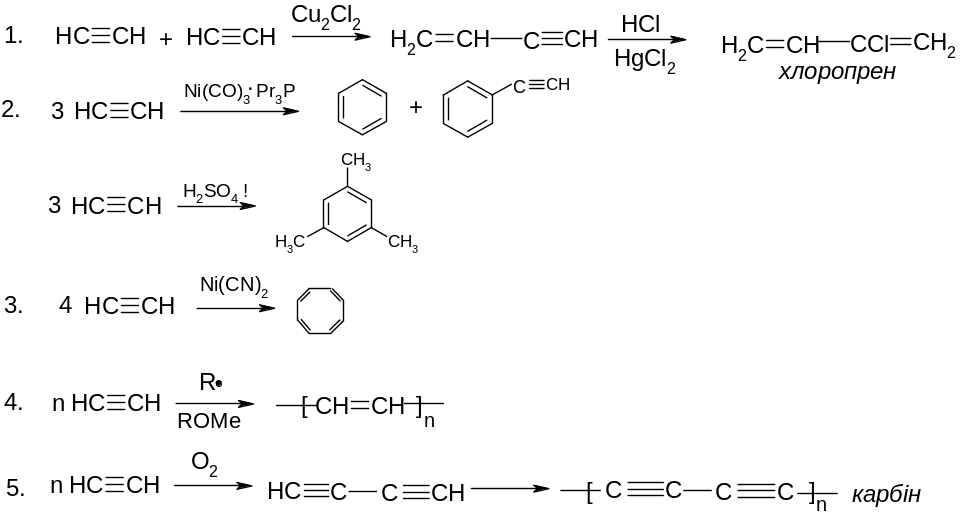
ІХ. Реакції окиснення: