
- •6.040204 – «Прикладна фізика»
- •6.040204 – «Прикладна фізика»
- •Вопросы и задачи
- •2.1 Краткое содержание
- •2.2. Вопросы и задачи
- •3.1. Краткое содержание
- •3. 2. Вопросы и задачи
- •4.1. Краткое содержание.
- •5. 1. Краткое содержание
- •6.1Краткое содержание
- •Методичні вказівки до практичних занять
- •«Молекулярна фізика»
- •6.040204 – «Прикладна фізика»
3.1. Краткое содержание
Теплоемкость тела или термодинамической
системы численно равна количеству
теплоты, которое необходимо для нагревания
его на один градус. Если в результате
передачи телу количества теплоты
![]() температура выросла на
температура выросла на
![]() ,
то
,
то
![]()
Теплоемкость тела зависит от его массы.
Характеристикой для каждого тела будут
удельная
![]() и молярная
и молярная
![]() теплоемкости
теплоемкости
![]() ,
, 
Это теплоемкости, отнесенные к единице массы и одному молю вещества
![]() ,
, ![]()
В зависимости от условий нагревания
теплоемкости одного и того же тела могут
быть разными. Так, теплоемкость тела
при постоянном давлении будет отличаться
от его теплоемкости при постоянном
объеме, т. е.
![]()
![]() ,
, ![]()
Молярная теплоемкость идеального газа
при постоянном объеме
![]() ,
а при постоянном давлении
,
а при постоянном давлении
![]()
![]() - число степеней свободы молекулы.
- число степеней свободы молекулы.
3. 2. Вопросы и задачи
1. Разность удельных теплоемкостей
![]() некоторого двухатомного газа равна 260
Дж/кг·К. Найти молярную массу газа и его
удельные теплоемкости
некоторого двухатомного газа равна 260
Дж/кг·К. Найти молярную массу газа и его
удельные теплоемкости
![]() и
и
![]() .
.
2. Каковы удельные теплоемкости
и
смеси газов, содержащей кислород массой
![]() г и азот массой
г и азот массой
![]() г?
г?
3. Определить удельную
теплоемкость смеси газов, содержащей
![]() л водорода и
л водорода и
![]() л гелия. Газы находятся при одинаковых
условиях.
л гелия. Газы находятся при одинаковых
условиях.
4. Определить удельную теплоемкость
смеси кислорода и азота, если количество
вещества
![]() первого компонента равно 2 моль, а
количество вещества
первого компонента равно 2 моль, а
количество вещества
![]() второго равно 4 моль.
второго равно 4 моль.
5. Дан закон изменения молярной теплоемкости
идеального газа в некотором процессе
![]() ,
где
,
где
![]() .
Найти уравнение этого процесса в
координатах
.
Найти уравнение этого процесса в
координатах
![]() .
.
6. Дан закон изменения молярной теплоемкости
идеального газа в некотором процессе
![]() ,
где
.
Найти уравнение этого процесса.
,
где
.
Найти уравнение этого процесса.
7. Степень диссоциации
![]() газообразного водорода равна 0,6. Найти
удельную теплоемкость такого частично
диссоциировавшего водорода.
газообразного водорода равна 0,6. Найти
удельную теплоемкость такого частично
диссоциировавшего водорода.
8. Тело с не зависящей от температуры
теплоемкостью
![]() Дж/К
охлаждается от
Дж/К
охлаждается от
![]() до
до
![]() .
Определить количество теплоты
.
Определить количество теплоты![]() ,
полученное телом.
,
полученное телом.
9. В рассматриваемом интервале температур
теплоемкость некоторого тела определяется
функцией
![]() Дж/К. Определить количество теплоты
,
получаемое телом при нагревании от
Дж/К. Определить количество теплоты
,
получаемое телом при нагревании от
![]() К до
К до![]() К.
К.
10. Определить удельную теплоемкость
смеси 50% по весу водорода и гелия,
заключенной в объеме
![]() л при температуре
и давлении
л при температуре
и давлении
![]() мм.рт.ст..
Молярные теплоемкости водорода
мм.рт.ст..
Молярные теплоемкости водорода
![]()
![]() кал/(моль·°C)
и гелия
кал/(моль·°C)
и гелия
![]() кал/(моль·°C).
кал/(моль·°C).
11. Для определения удельной теплоемкости
цинка
![]() кусок его массы
кусок его массы
![]() г нагрет до температуры
г нагрет до температуры
![]() и опущен в латунный калориметр. Удельная
теплоемкость латуни
и опущен в латунный калориметр. Удельная
теплоемкость латуни
![]() кал/(г·°C),
масса калориметра и мешалки
кал/(г·°C),
масса калориметра и мешалки
![]() г, масса воды
г, масса воды
![]() г, начальная температура калориметра
и воды
г, начальная температура калориметра
и воды
![]() .
Температура воды в калориметре повысилась
до
.
Температура воды в калориметре повысилась
до
![]() .
Определить удельную теплоемкость цинка.
.
Определить удельную теплоемкость цинка.
Занятие 4
Тема: Изопроцессы идеального газа
4.1. Краткое содержание.
1. Изотермический процесс.
Процесс, происходящий при постоянной температуре ( ).
Уравнение процесса
![]() ,
или
,
или
![]()
Подводимое к системе тепло идет на
совершение работы, т. е.
![]()
Работа при изотермическом процессе

2. Изобарический процесс.
Уравнение процесса
![]() ,
или
,
или

Теплоемкость при изобарическом процессе
![]()
![]()
![]()
![]()
При
![]() ,
,
![]() - энтальпия системы
- энтальпия системы
![]()
![]()
Молярная теплоемкость при изобарическом процессе
![]()
3. Изохорический процесс.
![]()
Уравнение процесса
 ,
или
,
или
![]()
![]()
Молярная теплоемкость
4. Адиабатический процесс.
Это процесс, происходящий в термодинамической системе при условии ее полной термоизоляции
![]()
![]()
![]()
![]()
Уравнение процесса (уравнение Пуассона)
![]() ,
где
,
где

Работа, выполняемая в адиабатическом процессе системой против внешних сил, совершается за счет уменьшения ее внутренней энергии.


 ,
т.к.
,
т.к.
![]()
5. Политропический процесс.
Реальные процессы являются промежуточными между изотермическим и адиабатическим процессами. Они называются политропическими и протекают при постоянной теплоемкости.
![]()
Уравнение политропического процесса
![]() ,
где
,
где

4.2. Вопросы и задачи
1. Изменение состояния идеального газа происходит по уравнению . Удельная теплоемкость – задана.
1) Найти выражение для удельной теплоемкости
через показатель
![]() и коэффициент Пуассона
и коэффициент Пуассона
![]() .
.
2) Рассмотреть частные случаи.
2. Один моль идеального газа переходит
из состояния 1 с параметрами
![]() в состояние 2 с параметрами
в состояние 2 с параметрами
![]() .
Процесс перехода в координатах
выражается прямой линией. График процесса
представлен на рис. 4.1. прямой линией.
Молярная теплоемкость
в процессе перехода не зависит от
температуры. Найти:
.
Процесс перехода в координатах
выражается прямой линией. График процесса
представлен на рис. 4.1. прямой линией.
Молярная теплоемкость
в процессе перехода не зависит от
температуры. Найти:
а) аналитическое выражение процесса перехода;
б) общую формулу для определения молярной теплоемкости для любого процесса;
в) молярную теплоемкость для данного процесса;
г) условия перехода данного процесса в политропический процесс;
д) молярную теплоемкость для полученного политропического процесса.
3. Изобразить для идеального газа
примерные графики изохорического,
изобарического, изотермического и
адиабатического процессов на диаграммах:
а)
![]() ;
б)
;
б)
![]() ;
в)
;
в)
![]() .
Графики изобразить через общую для них
точку.
.
Графики изобразить через общую для них
точку.
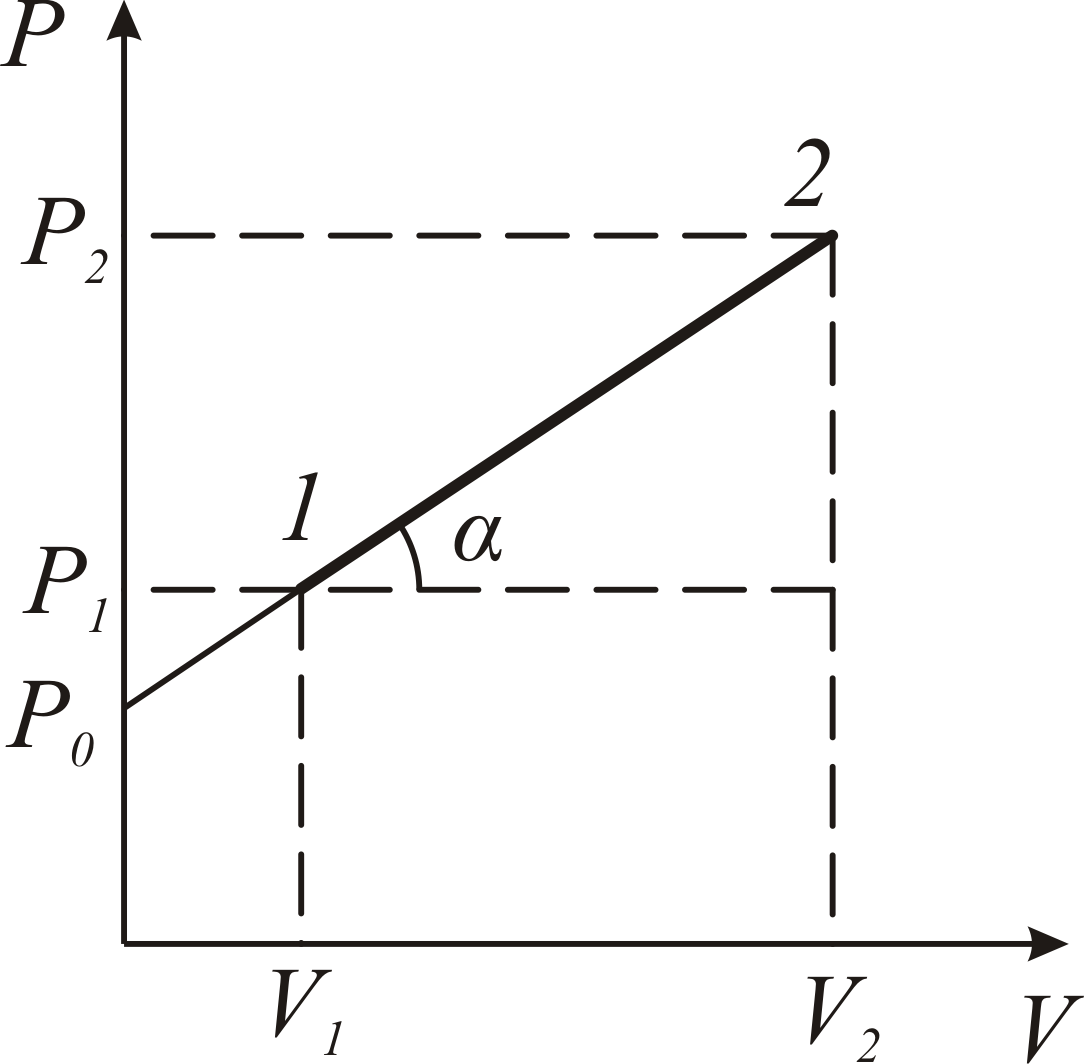
Рис. 4.1
4. Изобразить для идеального газа примерные графики:
а) изохорического, изобарического и
адиабатического процессов на диаграмме
![]() ;
;
б) изохорического, изобарического,
изотермического и адиабатического
процессов на диаграммах
![]() и
и
![]() ;
;
![]() откладывать по оси ординат. Исходной
для всех графиков принять общую точку.
откладывать по оси ординат. Исходной
для всех графиков принять общую точку.
5. Некоторое количество идеального газа
с трехатомными жесткими молекулами
перешло адиабатически из состояния с
температурой
![]() К
в состояние, характеризуемое параметрами:
К
в состояние, характеризуемое параметрами:
![]() К,
К,
![]() Па,
Па,
![]() л. Какую работу совершает при этом
газ?
л. Какую работу совершает при этом
газ?
6. Некоторое количество одноатомного
идеального газа сжимают адиабатически
до тех пор, пока давление не превзойдет
начальное давление
![]() в 10 раз. Затем газ расширяется изотермически
до первоначального объема. Во сколько
раз конечное давление
в 10 раз. Затем газ расширяется изотермически
до первоначального объема. Во сколько
раз конечное давление
![]() газа превышает начальное давление
?
газа превышает начальное давление
?
7. Температура в комнате объема
![]() поднялась от значения
поднялась от значения
![]() до температуры
до температуры
![]() .
Как изменилась при этом внутренняя
энергия воздуха, содержащегося в комнате?
Атмосферное давление предполагается
не изменившимся.
.
Как изменилась при этом внутренняя
энергия воздуха, содержащегося в комнате?
Атмосферное давление предполагается
не изменившимся.
8. Атмосферное давление изменилось от
![]() гПа до
гПа до
![]() гПа. Какое приращение
гПа. Какое приращение
![]() получает при этом внутренняя энергия
воздуха, содержащегося в комнате объема
получает при этом внутренняя энергия
воздуха, содержащегося в комнате объема
![]() м3? Температура
в комнате предполагается неизменной.
м3? Температура
в комнате предполагается неизменной.
9. При изобарическом нагревании от 0 до
![]() моль идеального газа поглощает количество
теплоты
моль идеального газа поглощает количество
теплоты
![]() к
Дж. Определить:
к
Дж. Определить:
а) значение ;
б) приращение внутренней энергии газа ;
в) работу, совершаемую газом.
10. Выразить молярную теплоемкость
![]() идеального газа при политропическом
процессе через показатель политропы
и отношение теплоемкостей
.
идеального газа при политропическом
процессе через показатель политропы
и отношение теплоемкостей
.
11. В ходе некоторого политропического
процесса идеальный газ (![]() )
был сжат от объема
)
был сжат от объема
![]() л до объема
л до объема
![]() л. При этом давление возросло от
л. При этом давление возросло от
![]() гПа до
гПа до
![]() гПа. Определить:
гПа. Определить:
а) показатель политропы ;
б) молярную теплоемкость газа для рассматриваемого процесса.
12. Моль одноатомного идеального газа
нагревается обратимо от
К до
К. В процессе нагревания давление
газа изменяется с температурой по закону
![]() ,
где
,
где
![]() К-1. Определить
количество теплоты, полученное газом
при нагревании.
К-1. Определить
количество теплоты, полученное газом
при нагревании.
13. Состояние идеального газа изменяется
по политропе
![]() .
Найти работу, совершаемую молем газа
при повышении его температуры от
до
.
.
Найти работу, совершаемую молем газа
при повышении его температуры от
до
.
Занятие 5
Тема: Энтропия идеального газа
