
- •Дезинтеграция микроогранизмов
- •2 Содержание лабораторного занятия
- •2.2.2 Разрушение биомассы в жидкой фазе
- •2.3 Определение содержания растворимого белка в дезинтеграте
- •2.2.2 Разрушение биомассы в жидкой фазе
- •2.3 Определение содержания растворимого белка в дезинтеграте
- •2.4 Обработка результатов
- •Эффективность методов дезинтеграции.
- •Содержание
- •Общие положения 3
2.2.2 Разрушение биомассы в жидкой фазе
Для разрушения биомассы в жидкой фазе используют лабораторный гомогенизатор MPW-302. В металлическом стакане прибора объемом 200 см3 взвешивают 3 г биомассы с точностью 0.01 г, добавляют с помощью пипетки 6 см3 1/15 М фосфатного буферного раствора. Стакан закрепляют в кольце прибора и погружают его в водяную баню со льдом. Разрушение проводят при скорости вращения насадки -5000 об/мин в течение 5 минут. Гомогенат освобождают от неразрушенных клеток и крупных клеточных частиц центрифугированием по выше изложенному режиму. Общий объем супернатанта доводят в мерной колбе фосфатным буфером до 50 см3 .
2.3 Определение содержания растворимого белка в дезинтеграте
Для сравнения эффективности использованных методов дезинтеграции клеток микроорганизмов определяют количество растворимого белка в гидролизате и супернатанте по методу Лоури. Этот метод основан на измерении интенсивности окраски раствора, в котором осущетвляется по меньшей мере две цветные реакции на белок:
- биуретовая реакция на пептидные, т.е. -C0-NH- связи, с образованием окрашенного чаще всего в фиолетовый цвет комплексного соединения меди с анализируемыми пептидными группами (интенсивность окраски зависит от концентрации белка в растворе)
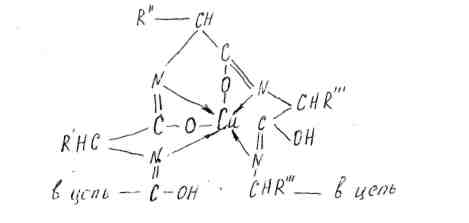
- реакция Фалина с тирозиновым и цистеиновым радикалами белковой молекулы.
Последняя состоит в восстановлении смеси фосфорно-вольфрамовой и фосфорно-молибденовой кислот (реактив Фолина) с образованием комплексного соединения синего цвета. Полагают, что в восстановлении принимают участие комплексные соединения меди, возникшие при взаимодействии белка со щелочным раствором медного купороса (биурет). Вторая из упомянутых реакций не очень специфична, но весьма чувствительна. Поэтому метод Лоури позволяет вести определение белков в сильно разбавленных растворах, содержащих всего несколько микрограммов белка, и, как правило, применяется для их определения в элюатах с колонок при фракционировании на ионообменных смолах и сефадексах.
В пробирку вносят 0,4 см3 исследуемого раствора (гидролизат, супернатант или их разведения), добавляют 4 см3 реактива С, содержимое перемешивают и оставляют на 10 мин. Затем добавляют 0,4 см3 реактива Фолина и, перемешав, помещают пробирку в затемненное место на 30 мин. для развития окраски. При этом желтая окраска раствора постепенно переходит в синюю.
Параллельно проводят аналогичную реакцию на реактивы, используя вместо исследуемого раствора дистиллированную воду. Для этого в контрольную пробирку вносят 0,4 см3 дистиллированной воды, 4 см3 реактива С и 0,4 см3 реактива Фолина.
Оптическую плотность раствора измеряют на фотоэлектрокслориметре при длине волны 750 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют контрольный раствор.
Содержание белка в испытуемой пробе устанавливают по калибровочному графику, построенному заранее по раствору какого-либо чистого белка точно известной концентрации. Лучше всего использо-
вать раствор того белка или смеси белков, определение которых ведут по методу Лоури, т.к. как и все другие основанные на цветных реакциях методы, он дает абсолютные данные, если калибровочный график построен по тому же белку, определение которого ведут при посредстве цветной реакции.
Для построения калибровочного графика белок растворяют в 0,1Н растворе гидроксида натрия и путем разведения исходного концентрированного раствора (400 мг на 0,4 см3) готовят серию растворов, содержащих от 20 до 400 мкг белка на 1 см3 раствора. В качестве стандартных белков используют кристаллический яичный или сывороточный альбумин, казеин и т.п. С каждым из указанных растворов проводят не менее трех раз реакцию Лоури, применяя те же количества реагентов, что и для исследуемых растворов. По полученным данным строят калибровочный график, откладывая на оси абсцисс концентрации белков в растворе, а на оси ординат - их оптическую плотность.
