
- •Справочник физико-химических величин
- •Содержание
- •Общие сведения
- •1. Единицы измерения физических величин
- •2. Основные физические постоянные
- •3. Атомная единица массы и переход от массы к энергии
- •4. Соотношения между единицами измерения и значения часто встречающихся величин
- •Свойства растворителей и растворов
- •5. Свойства органических растворителей
- •8. Плотность воды в интервале – 10 100 0с
- •9. Плотность растворов солей в воде
- •10. Плотность растворов неорганических кислот и оснований в воде при 20 0с
- •11. Плотность растворов органических соединений в воде при 20 0с
- •15. Дипольные моменты молекул газообразных веществ
- •16. Дипольные моменты молекул жидких веществ
- •18. Равновесия фаз в одно-, двух- и трехкомпонентных системах
- •Теплоты сгорания и растворения. Теплоемкость
- •19. Теплота сгорания некоторых веществ в стандартных условиях
- •21. Интегральная теплота растворения солей, образующих кристаллогидраты, при 25 0с
- •22. Средняя теплоемкость простых веществ и соединений
- •Химические равновесия и термодинамические свойства веществ
- •23. Термодинамические свойства простых веществ, соединений и ионов в водных растворах и в жидком аммиаке
- •25. Величина Mn для вычисления стандартного изменения энергии Гиббса по методу Темкина и Шварцмана
- •26. Эмпирические данные и зависимости для вычисления термодинамических величин Теплоемкость
- •Теплота сгорания органических соединений в газообразном состоянии
- •89,12 Дж/(моль . К)
- •27. Логарифмы констант равновесия реакций образования некоторых веществ
- •Явления переноса
- •28. Вязкость воды в интервале 5–100 °с
- •31. Удельная электрическая проводимость предельно чистой воды, перегнанной в вакууме
- •32. Удельная электрическая проводимость растворов кс1 в интервале 0–30 °с
- •34. Числа переноса катионов в водных растворах электролитов при 25 °с
- •35. Предельная молярная электрическая проводимость ионов в воде в интервале 0—100 °с
- •36. Электрическая проводимость растворов слабых кислот и оснований при 25 °с
- •Равновесия в растворах электролитов
- •37. Ионное произведение воды в интервале 0–100 °с
- •38. Средние ионные коэффициенты активности электролитов в водных растворах в интервале 0–60 °с
- •40. Соотношения между концентрацией, активностью и средним ионным коэффициентом активности электролитов разного типа
- •41. Константы диссоциации слабых кислот и оснований в водных растворах при 25 °с
- •42. Произведения растворимости важнейших малорастворимых электролитов
- •Термодинамика и кинетика электрохимических процессов
- •43. Стандартные электродные потенциалы
- •44. Стандартные электродные потенциалы в водных растворах при 25 оС
- •45. Температурные коэффициенты электродвижущей силы
- •46. Диффузионные потенциалы в водных растворах при 25 0c
- •Диффузионные потенциалы на поверхности раздела разных электролитов при одинаковой концентрации
- •Диффузионные потенциалы на поверхности раздела одного и того же электролита различной концентрации
- •47. Перенапряжение водорода и кислорода на различных электродах
- •48. Потенциалы разложения 1 н растворов некоторых соединений
- •Электрические и квантово-механические характеристики вещества
- •49. Атомные рефракции (по Эйзенлору)
- •Инкременты связей и циклов
- •51. Поляризуемость молекул
- •Кинетика химических реакций
- •52. Константы скорости инверсии сахарозы в 0,05 м серной кислоте в зависимости от состава раствора и температуры
- •53. Константы скорости щелочного омыления сложных эфиров
- •54. Энергия разрыва связей (энергия диссоциации) в молекулах и
- •Учебное издание
- •410026, Г. Саратов, ул. Московская, 160. Тел.: (845-2) 507-888
15. Дипольные моменты молекул газообразных веществ
Вещество |
. 1030, Кл . м |
Вещество |
. 1030, Кл . м |
CO |
0,33 |
SO2 |
5,34 |
HBr |
2,67 |
NH3 |
4,94 |
HCl |
3,47 |
PH3 |
1,83 |
HF |
6,40 |
CH3Cl |
6,57 |
HI |
1,27 |
CH2Cl2 |
5,30 |
NO |
0,23 |
CHCl3 |
3,17 |
H2O |
6,10 |
C2H5OH |
5,67 |
H2S |
3,40 |
(C2H5)2O |
3,30 |
NO2 |
0,97 |
C6H5CH3 |
1,33 |
16. Дипольные моменты молекул жидких веществ
Вещество |
. 1030, Кл . м |
Вещество |
. 1030, Кл . м |
Аллиловый спирт C3H7O |
5,34 |
Метилформиат C2H4O2 |
6,00 |
Анилин C6H7N |
5,00 |
Пиридин C5H5N |
7,34 |
Ацетальдегид C2H4О |
8,97 |
2-Пропанол C3H8O |
5,54 |
Ацетон C3H6O |
9,1– 9,7 |
Пропионовая кислота C3H6O2 |
5,84 |
Ацетофенон C8H8O |
10,07 |
Тиофен C4H4S |
1,83 |
Бензиловый спирт C7H8O |
5,70 |
Уксусный ангидрид C4H6O3 |
9,41 |
Бензойная кислота C7H6О2 |
5,8 |
Фенилгидразин C6H8N2 |
5,50 |
Бромбензол C6H5Br |
5,67 |
Фенилэтилен (стирол) C8H8 |
1,87 |
Бутанол C4H10O |
5,54 |
Фенол C6H6O |
4,84 |
Глицерин C3H8O3 |
0,93 |
Фтортрихлорметан |
1,70 |
м-Дихлорбензол C6H4Cl2 |
4,94 |
(фреон-11) CFCl3 |
|
о-Дихлорбензол C6H4Cl2 |
7,51 |
Хлорбензол C6H5Cl |
5,64 |
м-Ксилол C8H10 |
1,20 |
Этиламин C2H7N |
4,34 |
о-Ксилол C8H10 |
1,73 |
Этилацетат C4H8O2 |
5,94 |
n-Ксилол C8H10 |
0,20 |
Этилформиат C3H6O2 |
6,44 |
Метилацетат C3H6O2 |
5,74 |
|
|
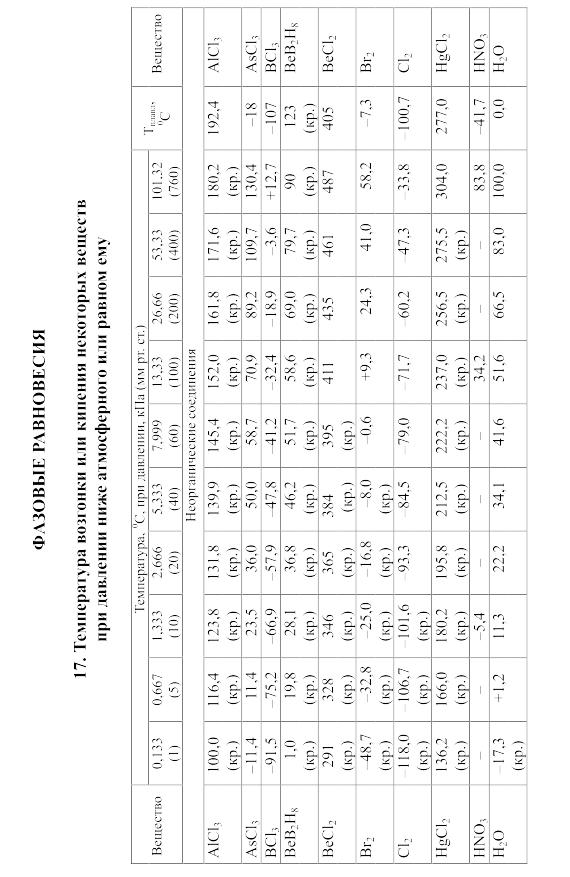
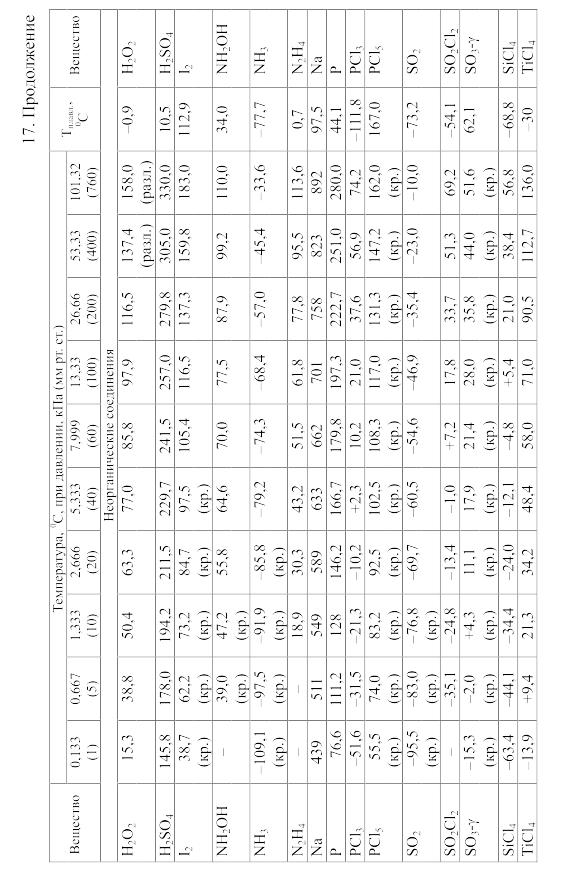
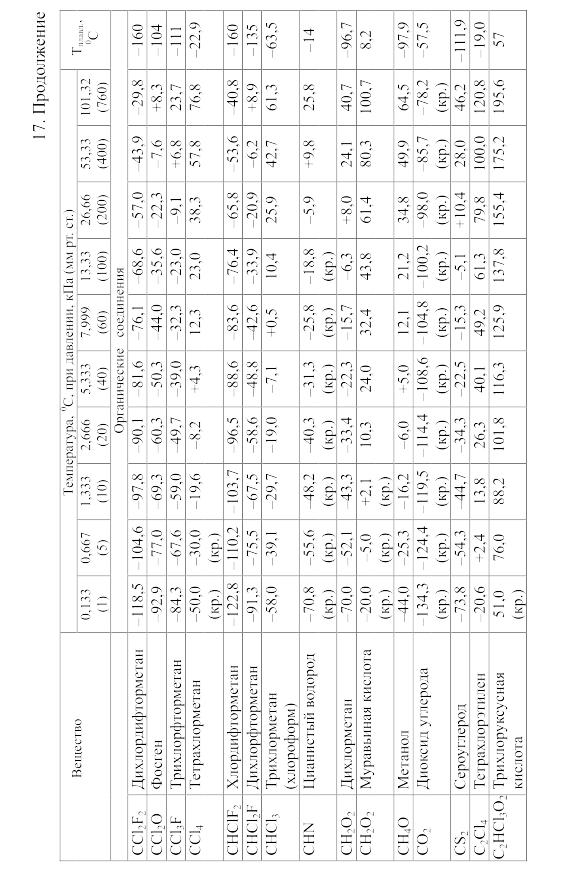

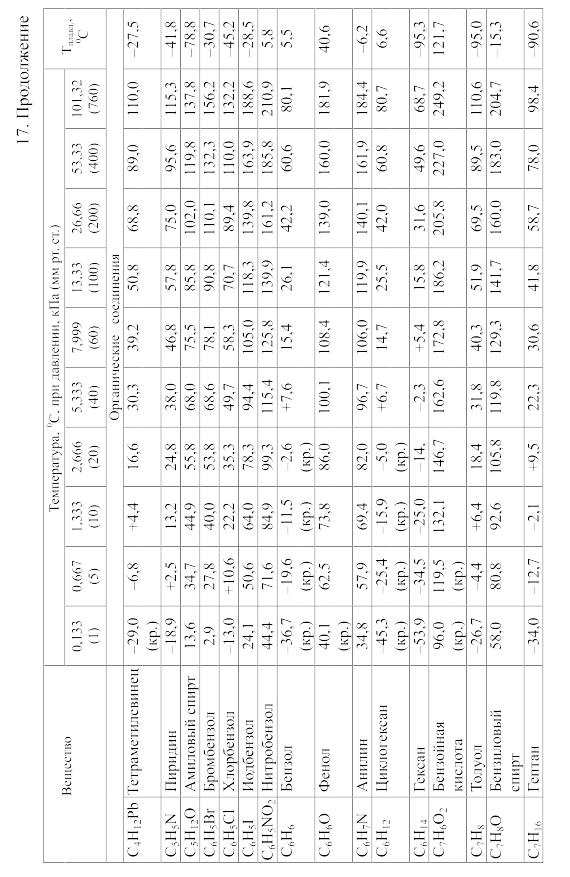
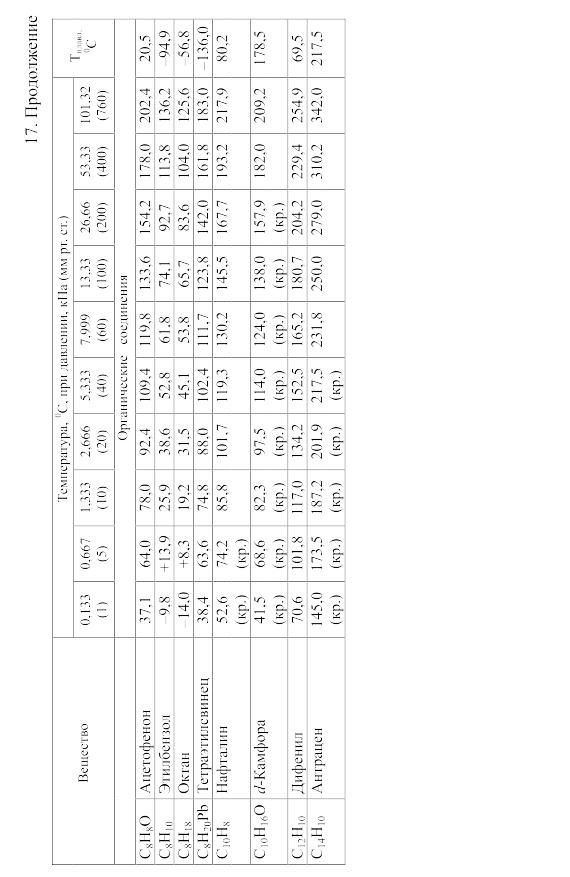
18. Равновесия фаз в одно-, двух- и трехкомпонентных системах
На рисунках 18.1-18.31 приведены диаграммы гетерогенных систем: твердое—твердое, твердое—жидкость, жидкость—жидкость, твердое—газ, жидкость—газ, газ—газ.
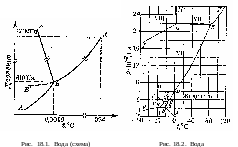





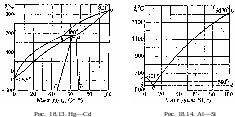





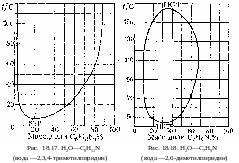




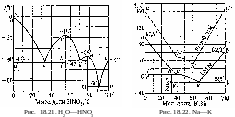


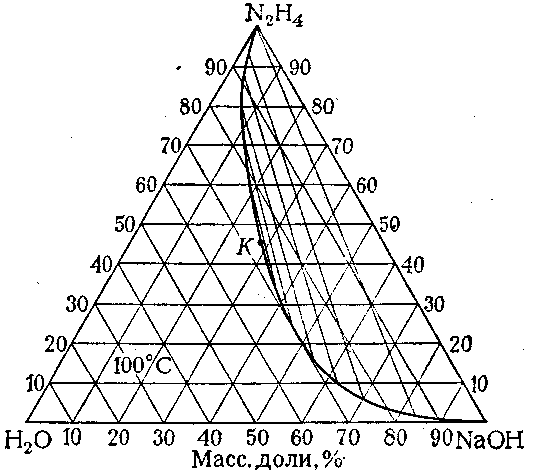
Рис.
18.25 Ag—Sb
Рис.
18.26. H2O—
NaOH––N2H4







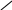


Рис.
18.30. CaF2—Na3AlF6––Al2O3

Рис. 28.31. C6H5COOH–C6H4(OH)COOH–м-C6H4(NH2)2
