
- •Справочник физико-химических величин
- •Содержание
- •Общие сведения
- •1. Единицы измерения физических величин
- •2. Основные физические постоянные
- •3. Атомная единица массы и переход от массы к энергии
- •4. Соотношения между единицами измерения и значения часто встречающихся величин
- •Свойства растворителей и растворов
- •5. Свойства органических растворителей
- •8. Плотность воды в интервале – 10 100 0с
- •9. Плотность растворов солей в воде
- •10. Плотность растворов неорганических кислот и оснований в воде при 20 0с
- •11. Плотность растворов органических соединений в воде при 20 0с
- •15. Дипольные моменты молекул газообразных веществ
- •16. Дипольные моменты молекул жидких веществ
- •18. Равновесия фаз в одно-, двух- и трехкомпонентных системах
- •Теплоты сгорания и растворения. Теплоемкость
- •19. Теплота сгорания некоторых веществ в стандартных условиях
- •21. Интегральная теплота растворения солей, образующих кристаллогидраты, при 25 0с
- •22. Средняя теплоемкость простых веществ и соединений
- •Химические равновесия и термодинамические свойства веществ
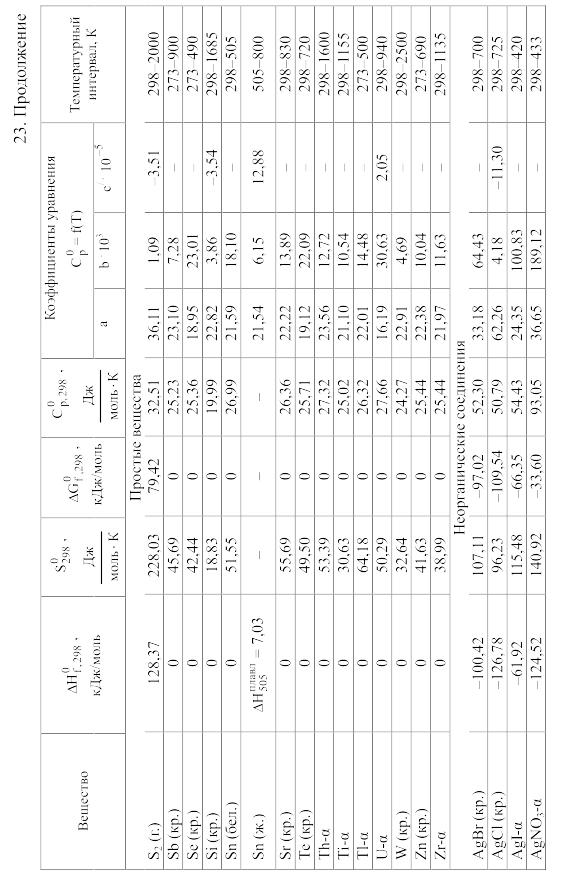
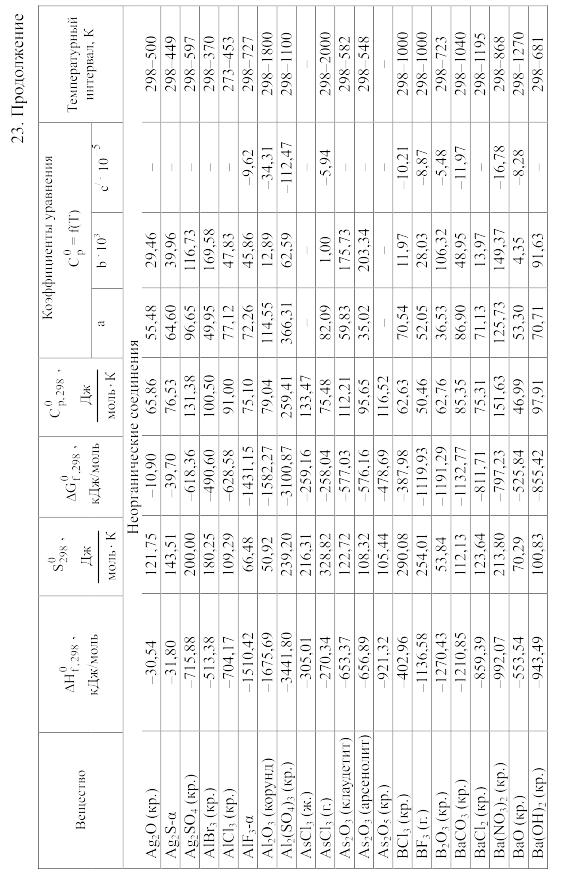
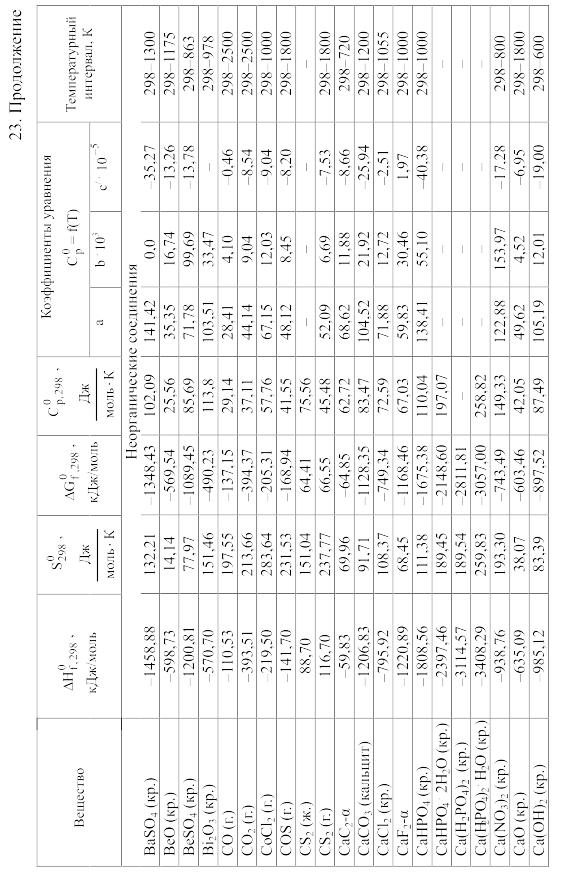
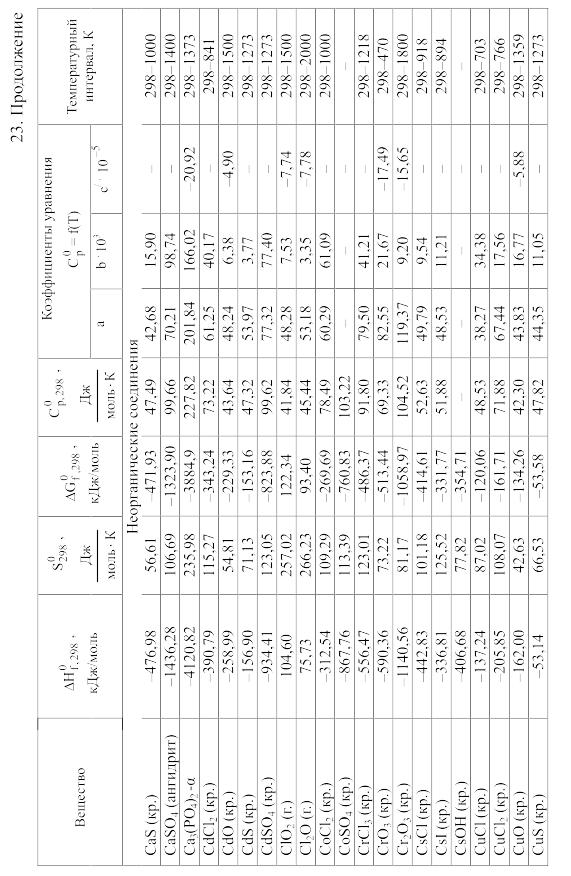
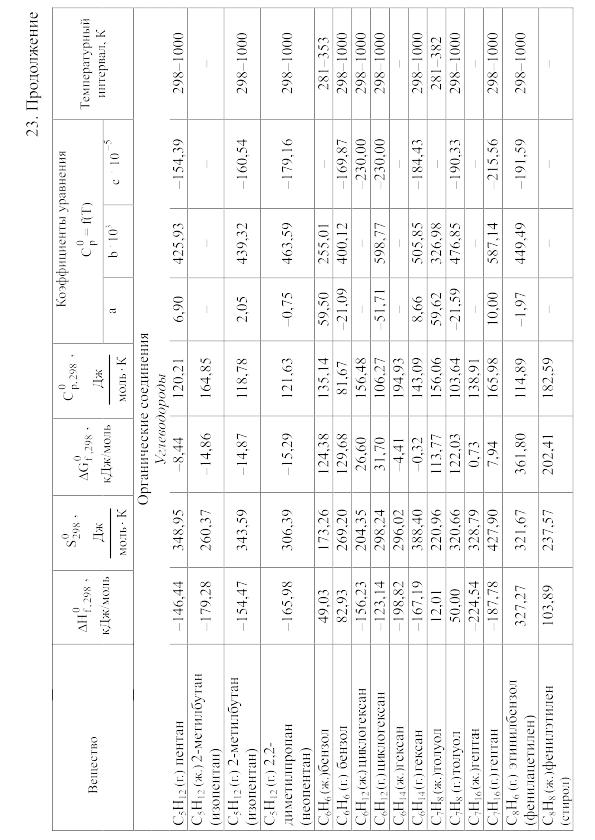
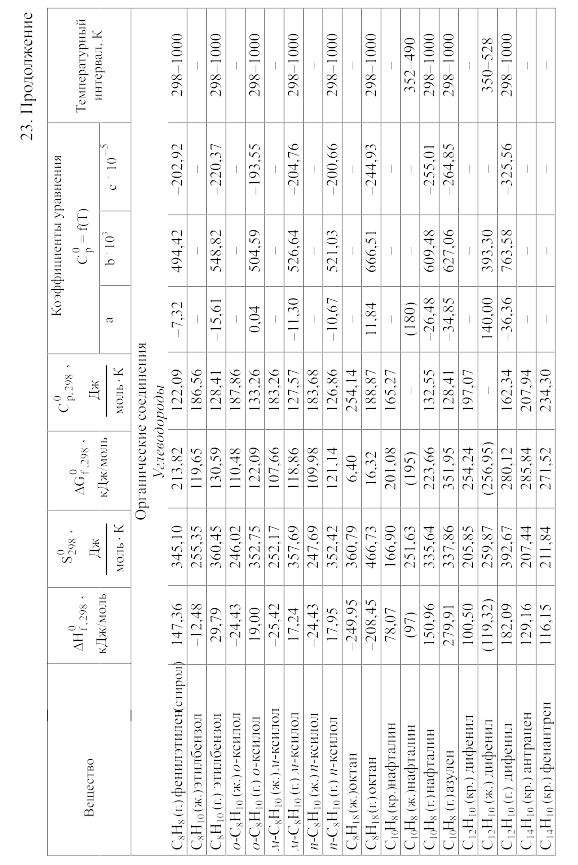
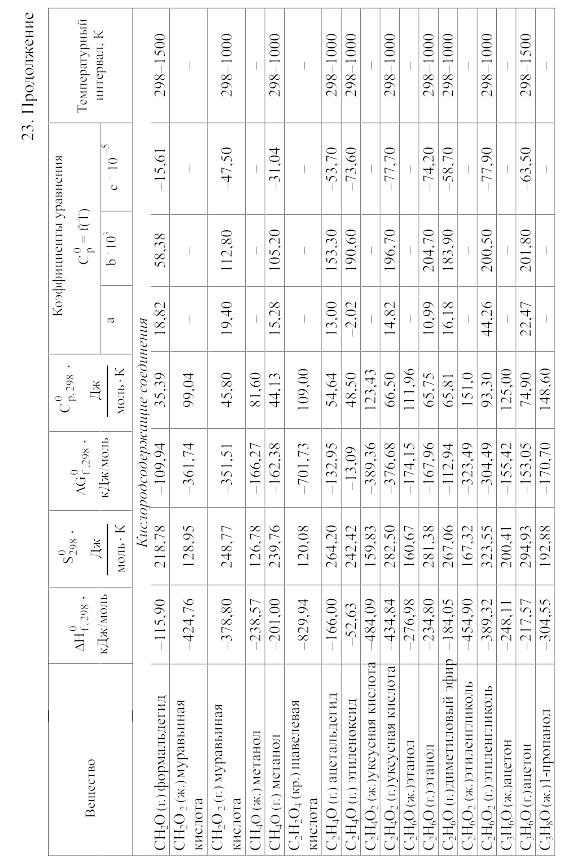
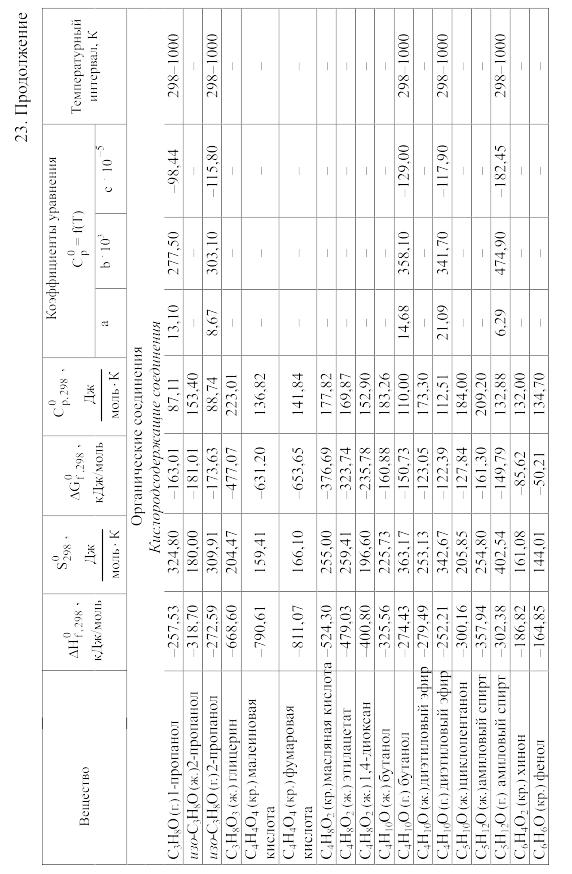
- •23. Термодинамические свойства простых веществ, соединений и ионов в водных растворах и в жидком аммиаке
- •25. Величина Mn для вычисления стандартного изменения энергии Гиббса по методу Темкина и Шварцмана
- •26. Эмпирические данные и зависимости для вычисления термодинамических величин Теплоемкость
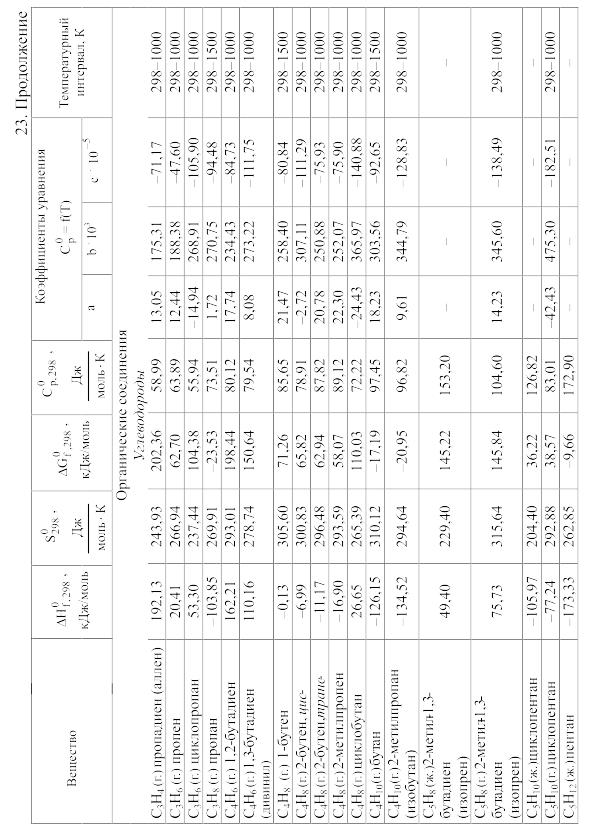
- •Теплота сгорания органических соединений в газообразном состоянии
- •89,12 Дж/(моль . К)
- •27. Логарифмы констант равновесия реакций образования некоторых веществ
- •Явления переноса
- •28. Вязкость воды в интервале 5–100 °с
- •31. Удельная электрическая проводимость предельно чистой воды, перегнанной в вакууме
- •32. Удельная электрическая проводимость растворов кс1 в интервале 0–30 °с
- •34. Числа переноса катионов в водных растворах электролитов при 25 °с
- •35. Предельная молярная электрическая проводимость ионов в воде в интервале 0—100 °с
- •36. Электрическая проводимость растворов слабых кислот и оснований при 25 °с
- •Равновесия в растворах электролитов
- •37. Ионное произведение воды в интервале 0–100 °с
- •38. Средние ионные коэффициенты активности электролитов в водных растворах в интервале 0–60 °с
- •40. Соотношения между концентрацией, активностью и средним ионным коэффициентом активности электролитов разного типа
- •41. Константы диссоциации слабых кислот и оснований в водных растворах при 25 °с
- •42. Произведения растворимости важнейших малорастворимых электролитов
- •Термодинамика и кинетика электрохимических процессов
- •43. Стандартные электродные потенциалы
- •44. Стандартные электродные потенциалы в водных растворах при 25 оС
- •45. Температурные коэффициенты электродвижущей силы
- •46. Диффузионные потенциалы в водных растворах при 25 0c
- •Диффузионные потенциалы на поверхности раздела разных электролитов при одинаковой концентрации
- •Диффузионные потенциалы на поверхности раздела одного и того же электролита различной концентрации
- •47. Перенапряжение водорода и кислорода на различных электродах
- •48. Потенциалы разложения 1 н растворов некоторых соединений
- •Электрические и квантово-механические характеристики вещества
- •49. Атомные рефракции (по Эйзенлору)
- •Инкременты связей и циклов
- •51. Поляризуемость молекул
- •Кинетика химических реакций
- •52. Константы скорости инверсии сахарозы в 0,05 м серной кислоте в зависимости от состава раствора и температуры
- •53. Константы скорости щелочного омыления сложных эфиров
- •54. Энергия разрыва связей (энергия диссоциации) в молекулах и
- •Учебное издание
- •410026, Г. Саратов, ул. Московская, 160. Тел.: (845-2) 507-888
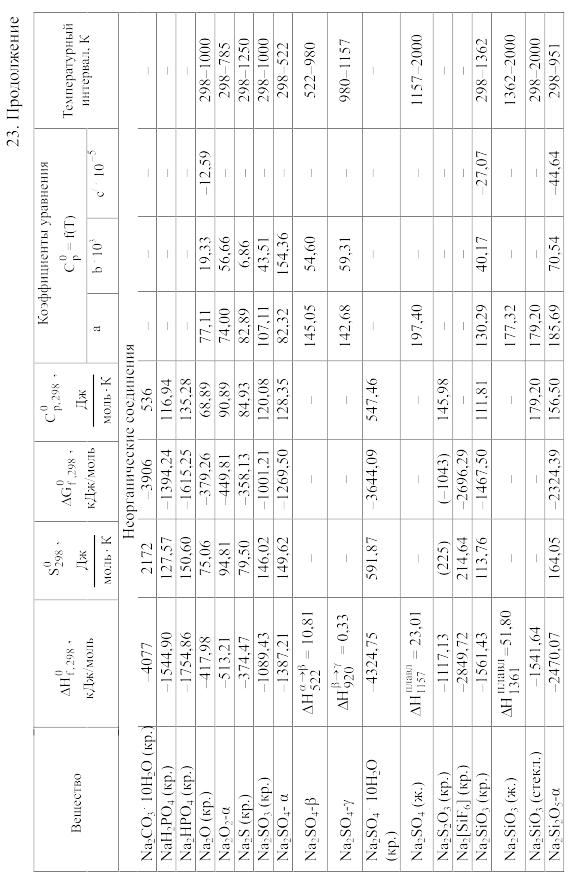
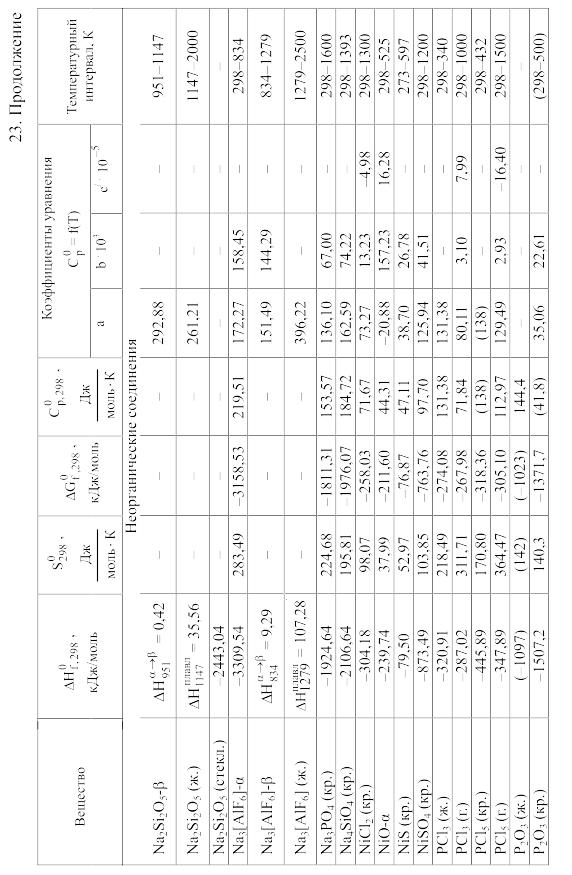
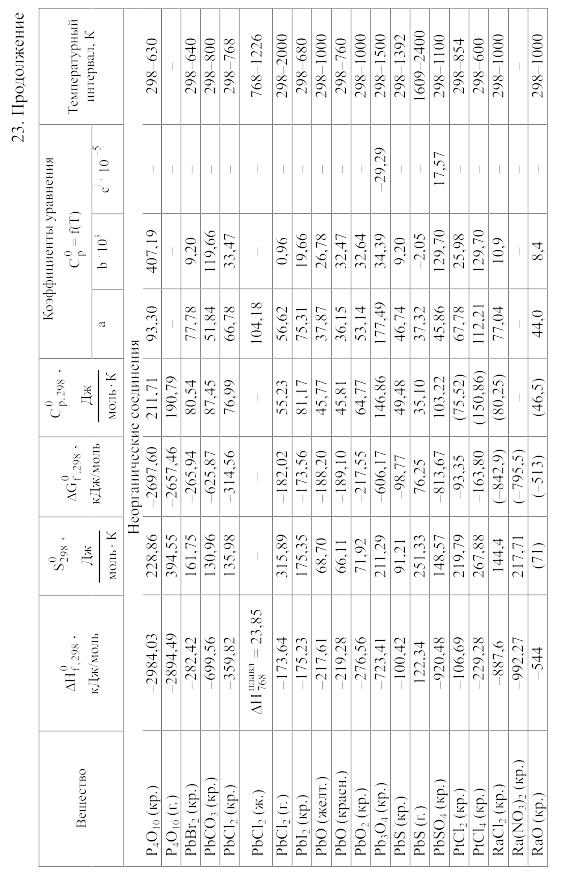
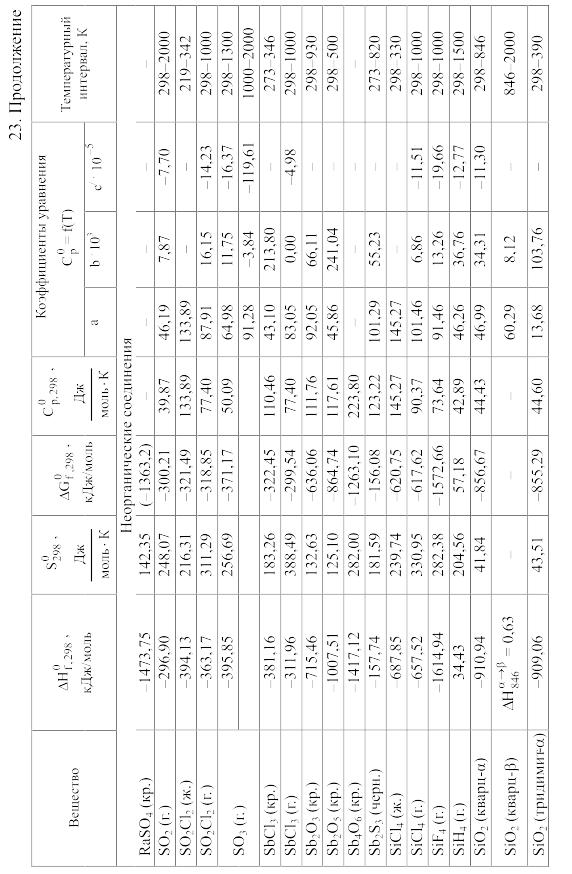
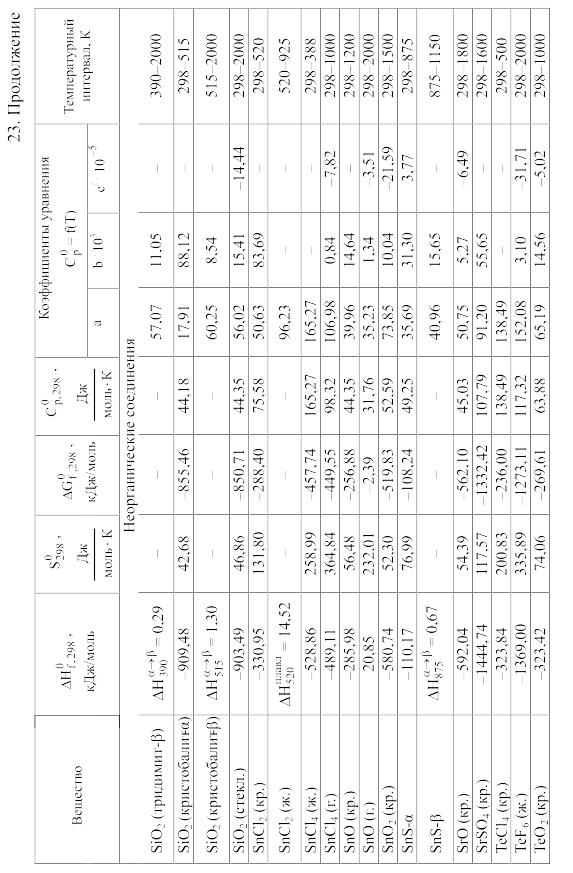
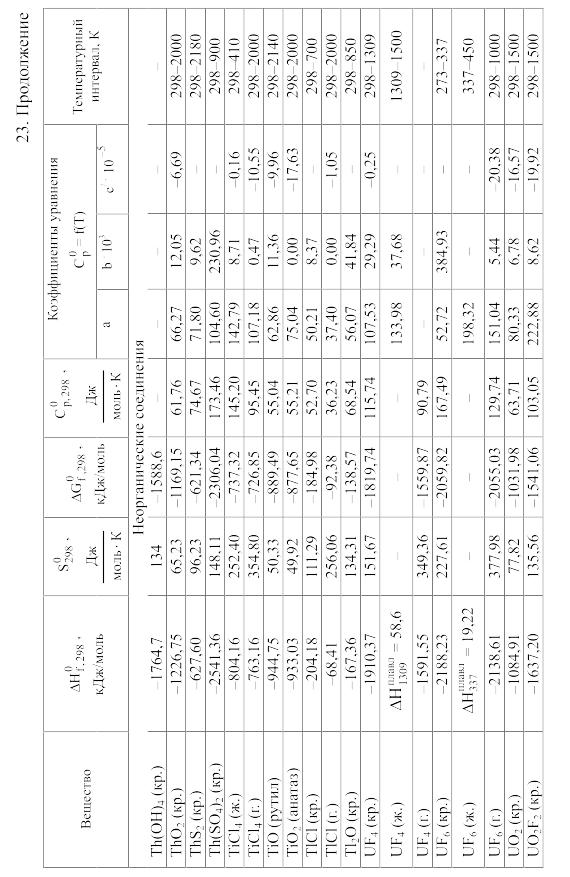
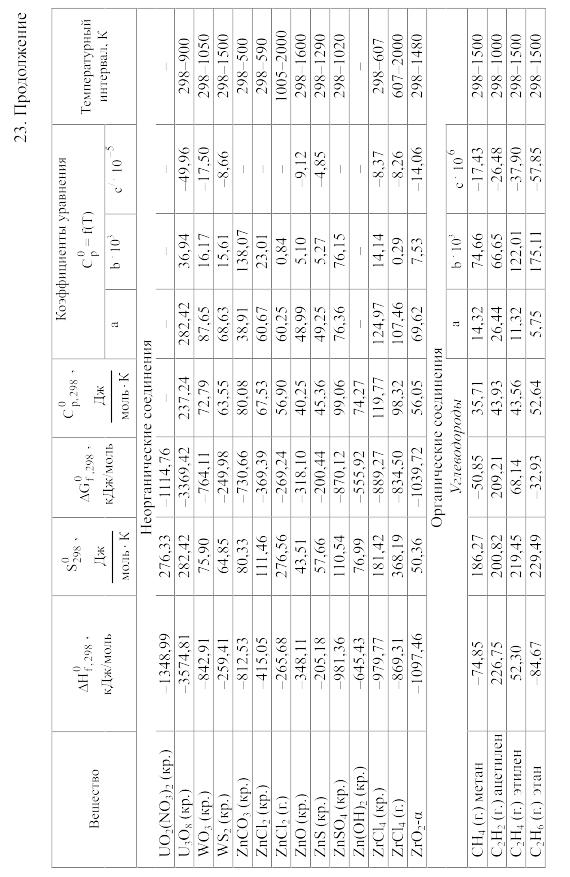
Химические равновесия и термодинамические свойства веществ
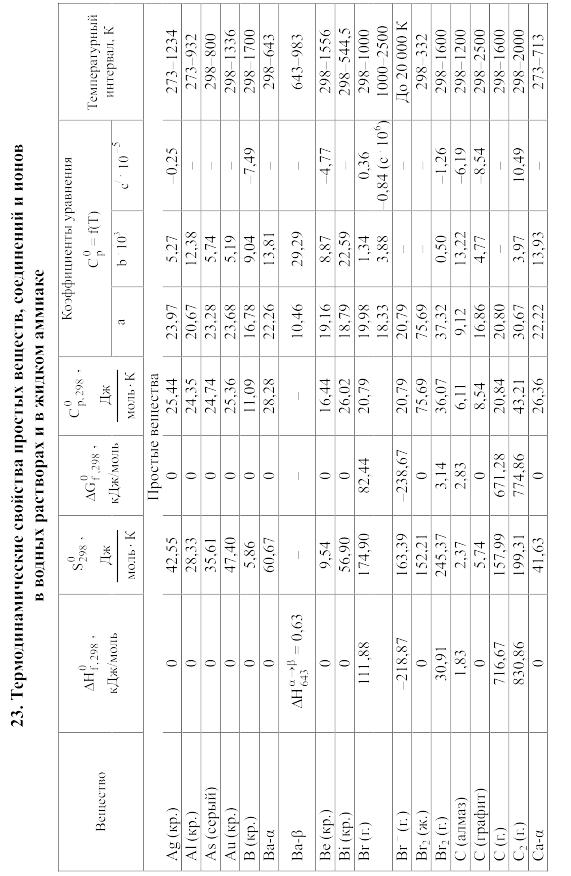
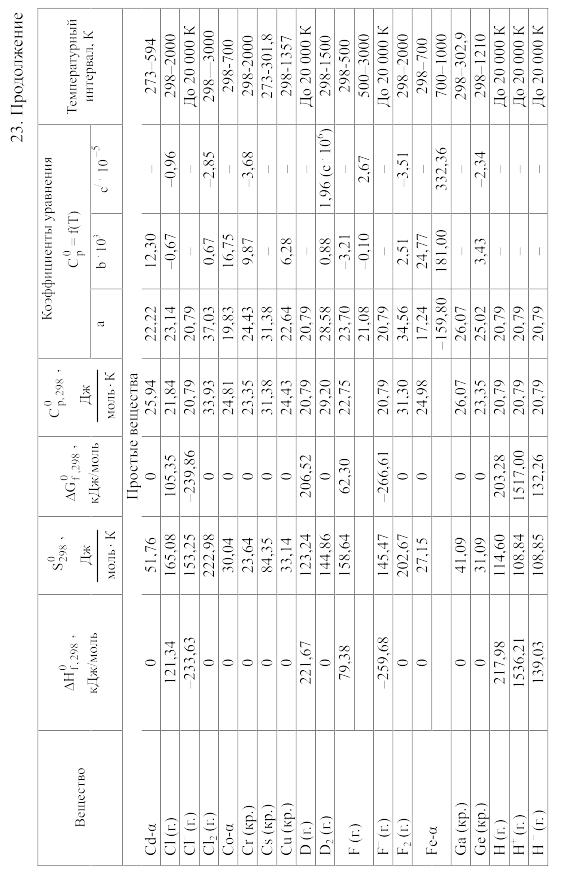
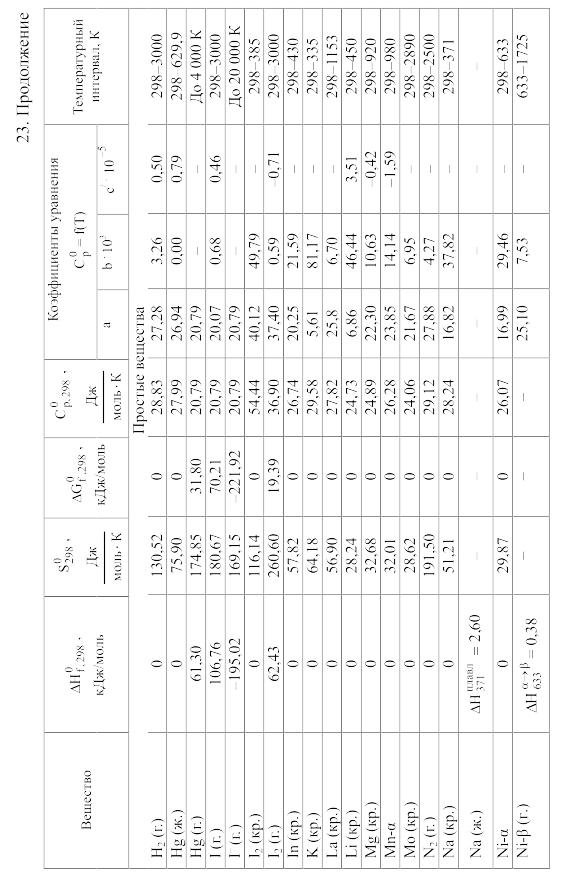
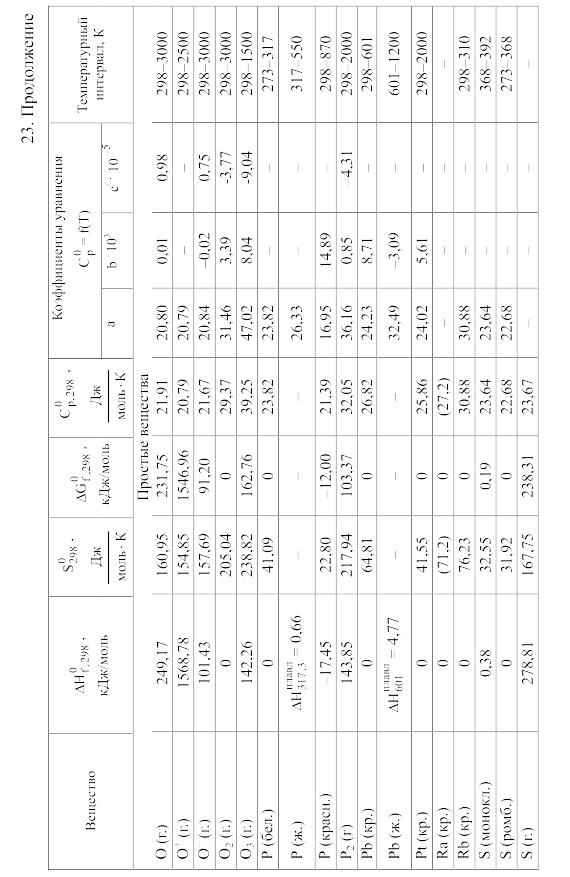
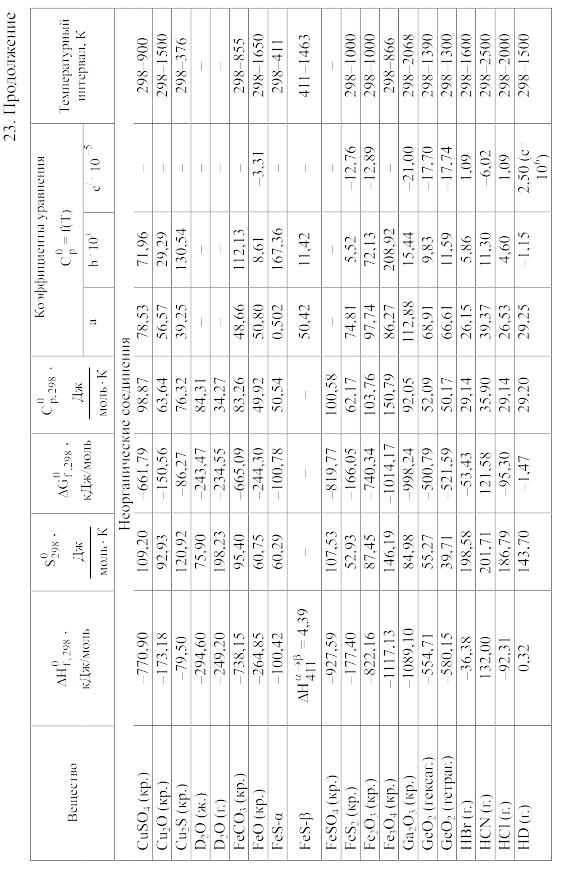
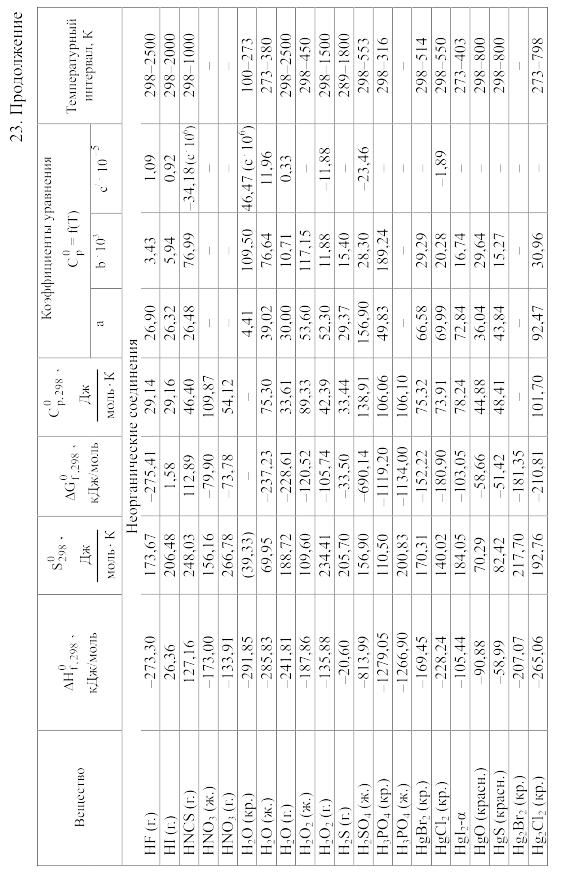
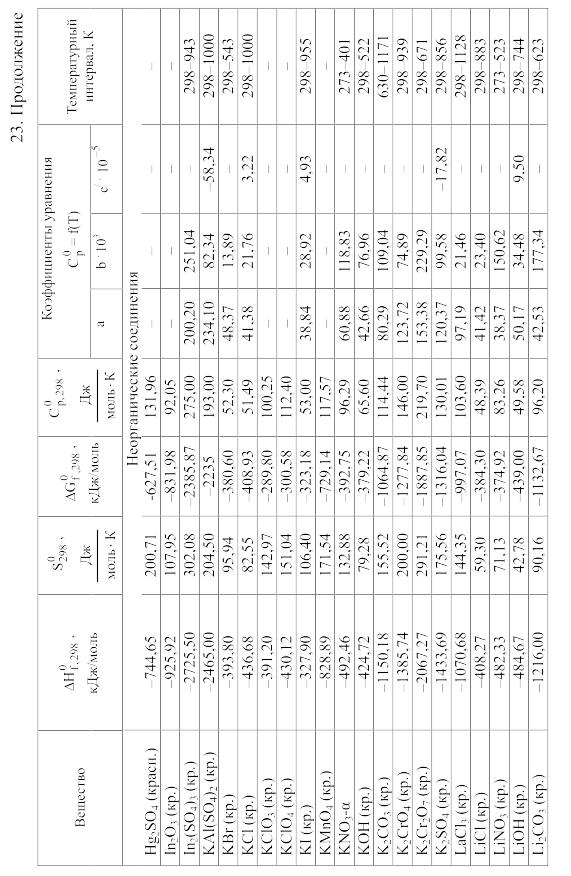
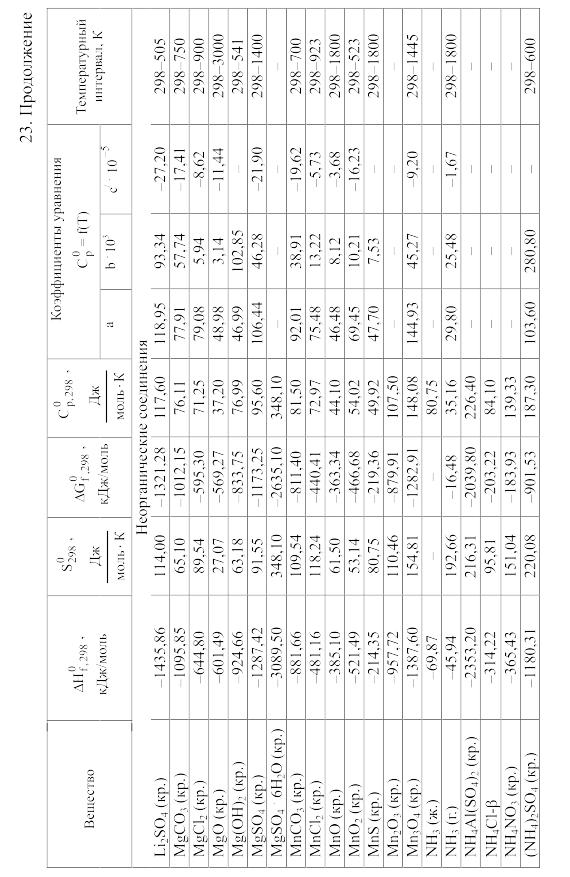
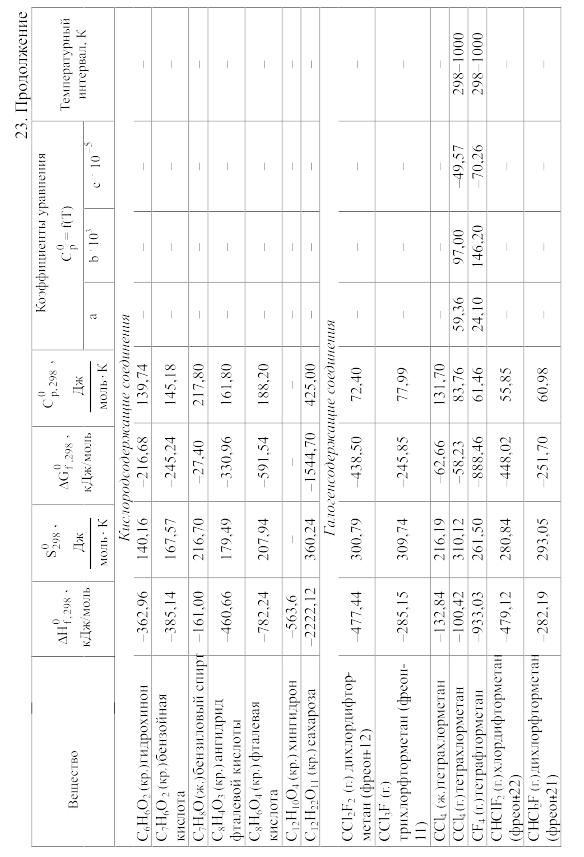
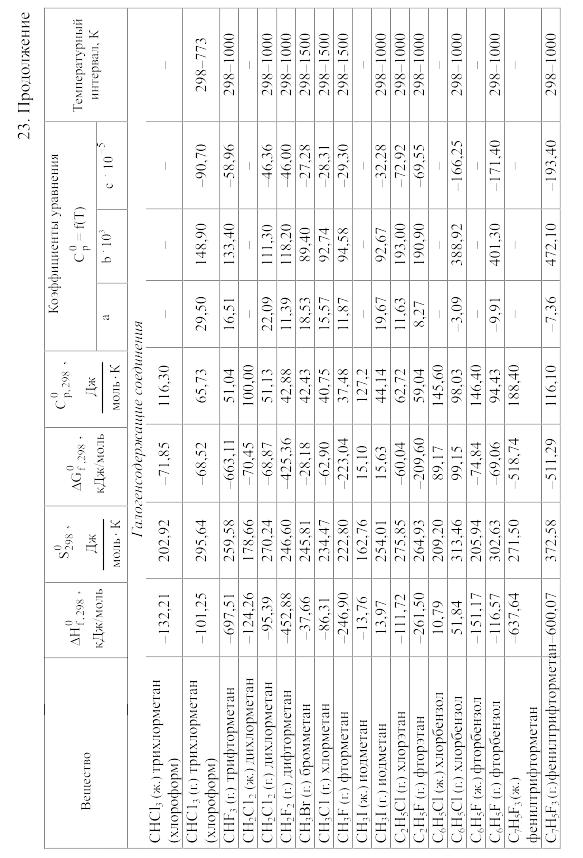
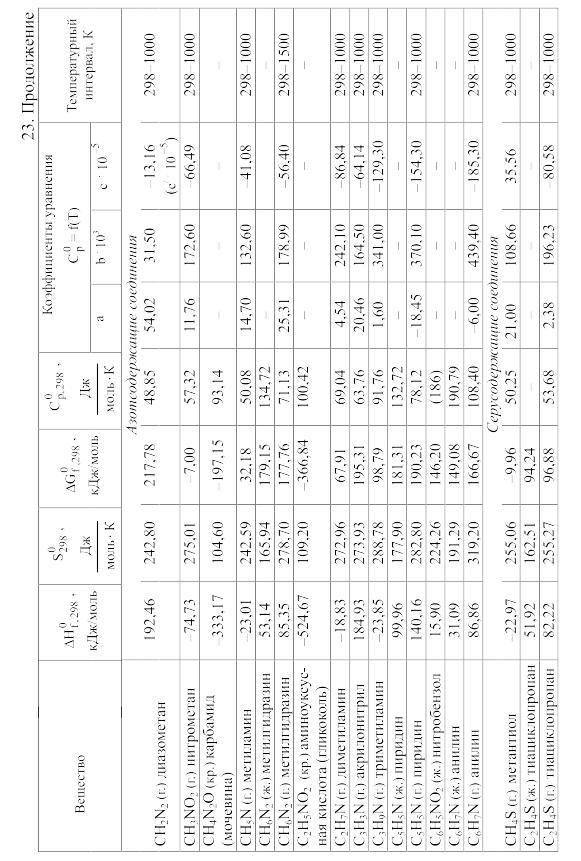
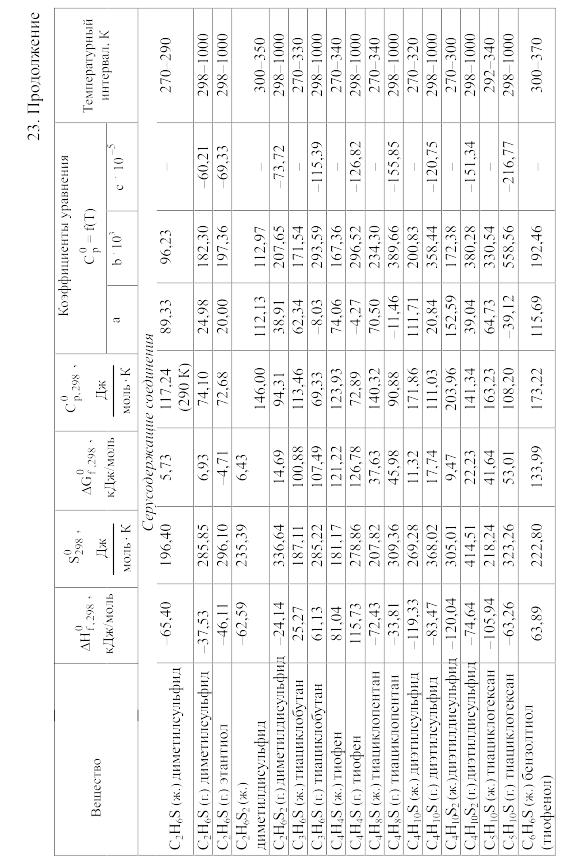
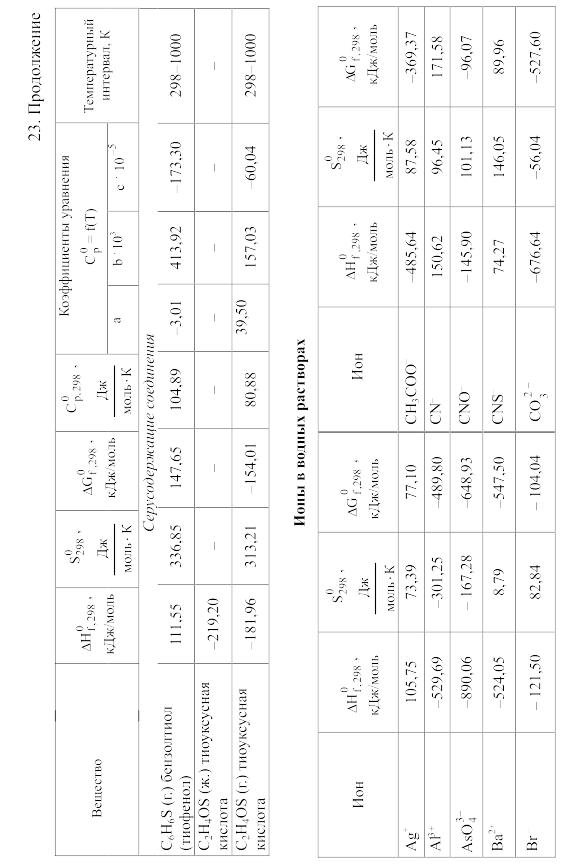
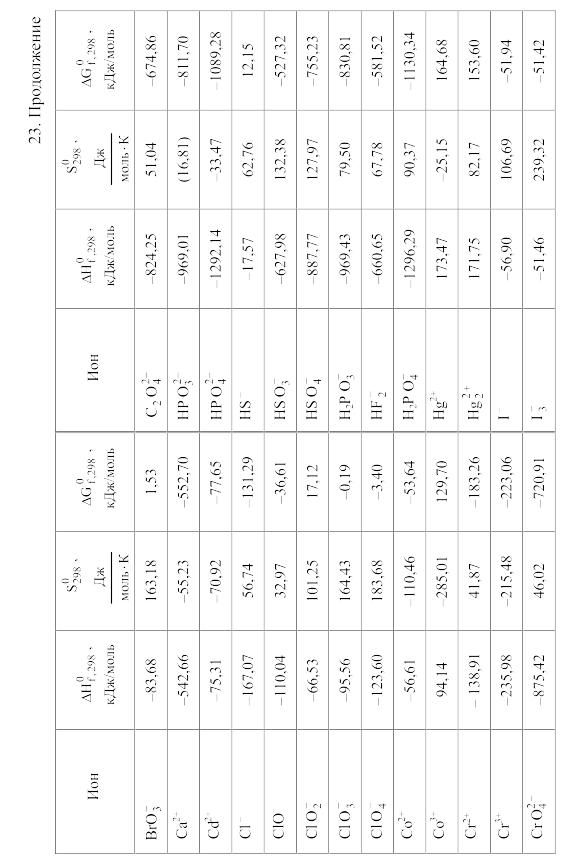
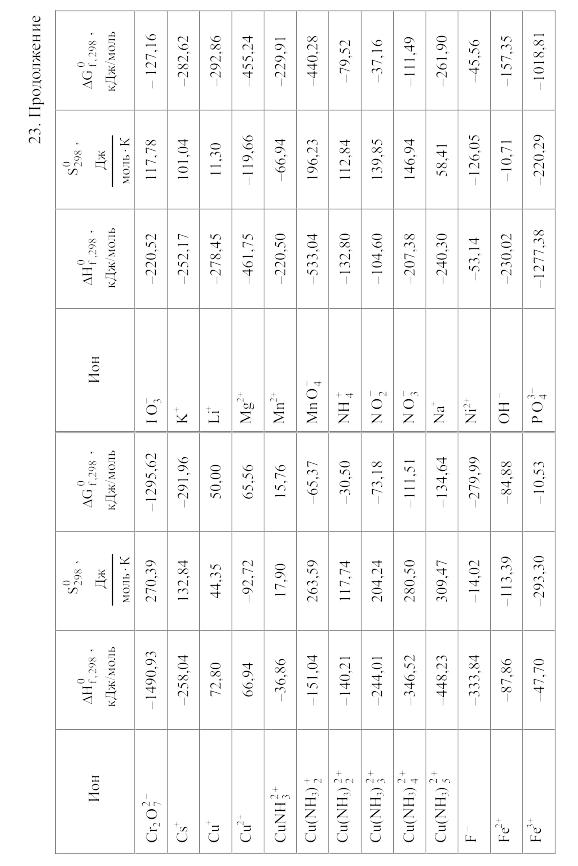
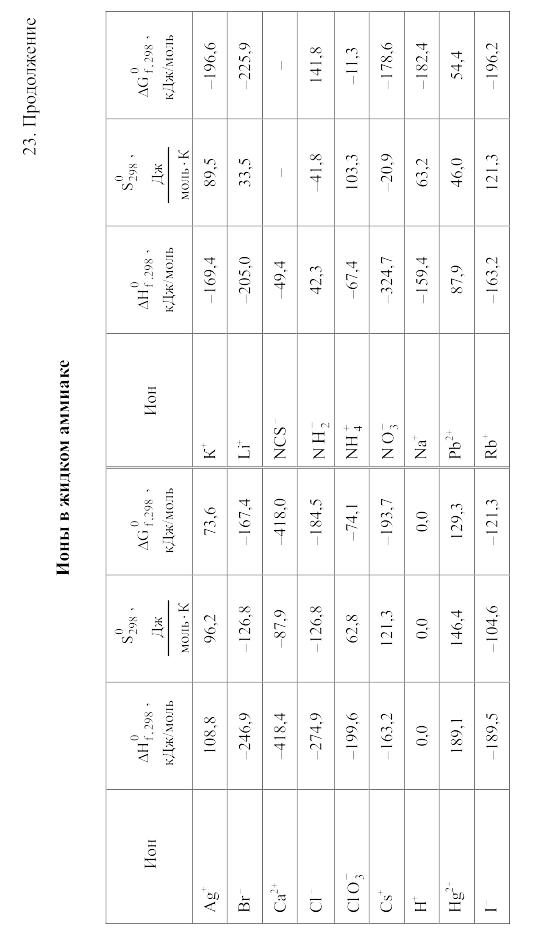
23. Термодинамические свойства простых веществ, соединений и ионов в водных растворах и в жидком аммиаке
![]() и
и
![]() – изменения стандартных энтальпий
(теплоты образования) и энергии Гиббса
образования (индекс f –
formation) данного вещества
из простых веществ, тepмодинамически
устойчивых при 101,325 кПа (1 атм) и при
выбранной температуре 298 К.
– изменения стандартных энтальпий
(теплоты образования) и энергии Гиббса
образования (индекс f –
formation) данного вещества
из простых веществ, тepмодинамически
устойчивых при 101,325 кПа (1 атм) и при
выбранной температуре 298 К.
![]() и
и
![]() –
стандартные значения энтропии и изобарной
теплоемкости вещества при 298 К.
–
стандартные значения энтропии и изобарной
теплоемкости вещества при 298 К.
Теплоемкость [в Дж/(моль . К)] при температуре Т в указанном в таблице интервале температур выражается уравнениями:
![]() или
или
![]()
Свойства ионов в растворах даны при а = 1 по отношению к Н+, соответствующие характеристики которого приняты равными нулю.


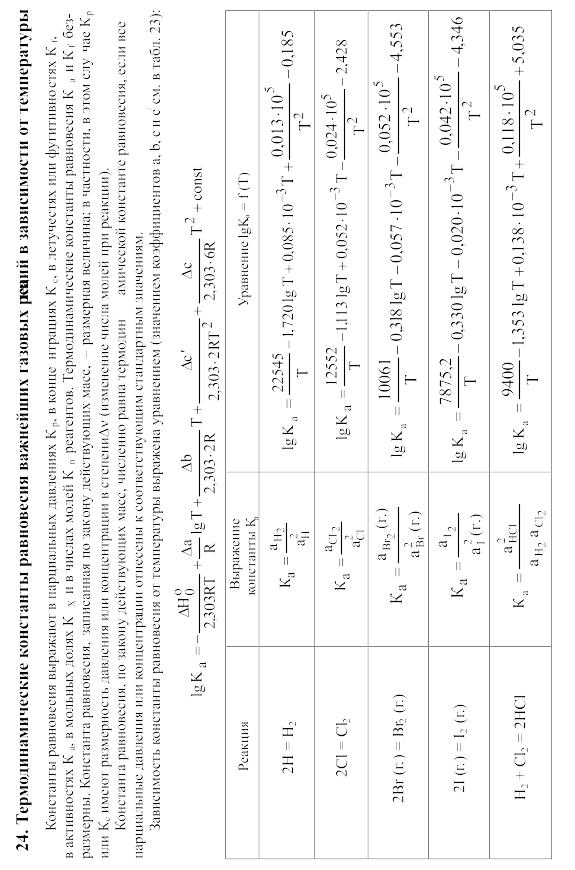
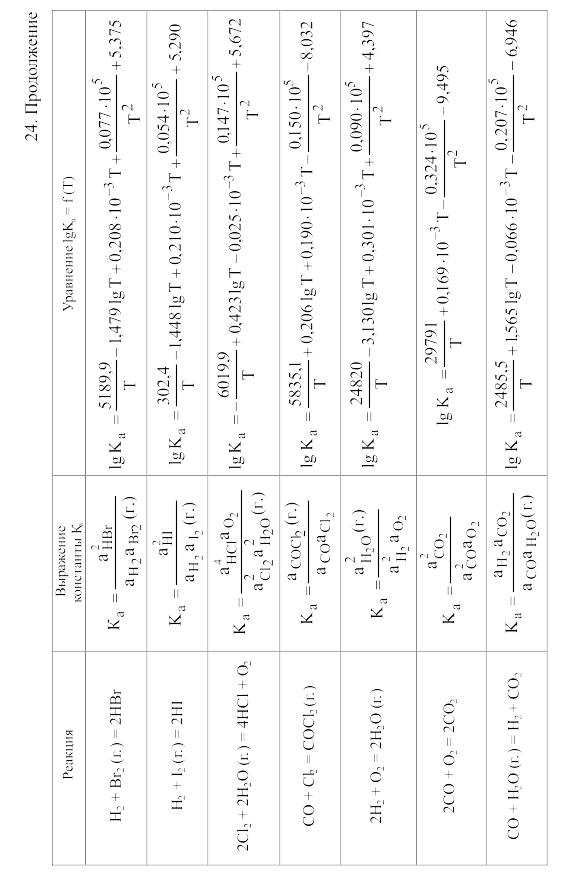
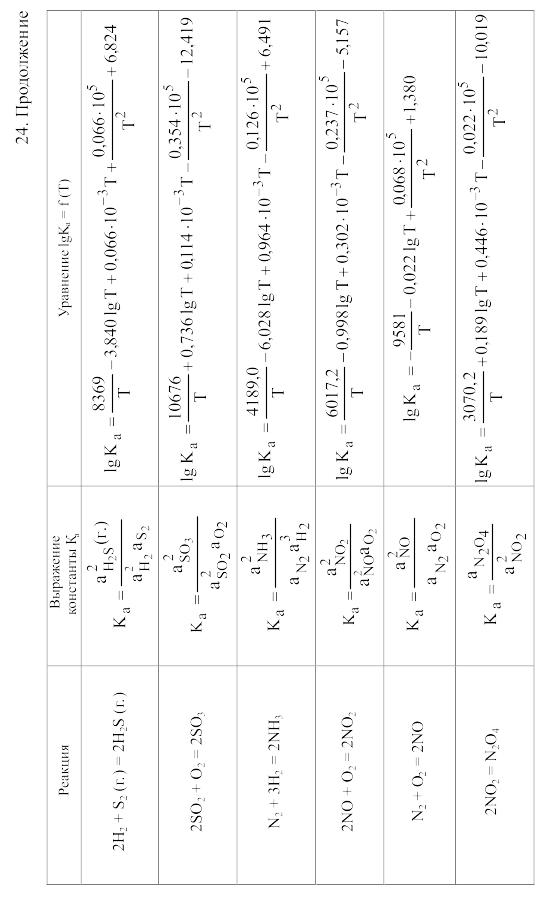
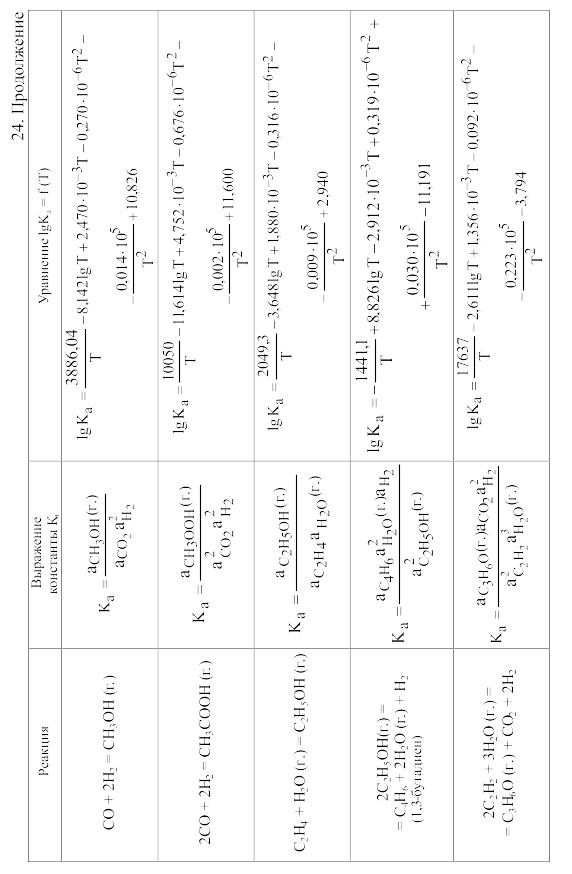
25. Величина Mn для вычисления стандартного изменения энергии Гиббса по методу Темкина и Шварцмана
![]() ,
,
где
![]() –
стандартный тепловой эффект;
–
стандартный тепловой эффект;
![]() ;
;
а (соответственно b,
с, с/)=
![]()
(обозначения см. таблица 23).
![]()
![]() (при n
0)
(при n
0)
Т, К |
М0 |
М1 . 10–3 |
М2 . 10–6 |
М–2 . 105 |
300 |
0,0000 |
0,0000 |
0,0000 |
0,0000 |
400 |
0,0392 |
0,0130 |
0,0043 |
0,0364 |
500 |
0,1133 |
0,0407 |
0,0140 |
0,0916 |
600 |
0,1962 |
0,0759 |
0,0303 |
0,1423 |
700 |
0,2794 |
0,1153 |
0,0498 |
0,1853 |
800 |
0,3597 |
0,1574 |
0,0733 |
0,2213 |
900 |
0,4361 |
0,2012 |
0,1004 |
0,2521 |
1000 |
0,5088 |
0,2463 |
0,1310 |
0,2783 |
1100 |
0,5765 |
0,2922 |
0,1652 |
0,2988 |
1200 |
0,6410 |
0,3389 |
0,2029 |
0,3176 |
1300 |
0,7019 |
0,3860 |
0,2440 |
0,3340 |
1400 |
0,7595 |
0,4336 |
0,2886 |
0,34835 |
1500 |
0,8141 |
0,4814 |
0,3362 |
0,3610 |
1600 |
0,8665 |
0,5296 |
0,3877 |
0,3723 |
1700 |
0,9162 |
0,5780 |
0,4424 |
0,3824 |
1800 |
0,9635 |
0,6265 |
0,5005 |
0,3915 |
1900 |
1,009 |
0,6752 |
0,5619 |
0,3998 |
2000 |
1,0525 |
0,7240 |
0,6265 |
0,4072 |
2100 |
1,094 |
0,7730 |
0,6948' |
0,4140 |
2200 |
1,134 |
0,8220 |
0,7662 |
0,4203 |
2300 |
1,173 |
0,8711 |
0,8411 |
0,4260 |
2400 |
1,210 |
0,9203 |
0,9192 |
0,4314 |
2500 |
1,246 |
0,9696 |
1,0008 |
0,4363 |
2600 |
1,280 |
1,0189 |
1,0856 |
0,4408 |
2700 |
1,314 |
1,0683 |
1,1738 |
0,44505 |
2800 |
1,346 |
1,1177 |
1,2654 |
0,4490 |
2900 |
1,3775 |
1,1672 |
1,3603 |
0,4527 |
3000 |
1,408 |
1,2166 |
1,4585 |
0,4562 |
