
Теория атома водорода по Бору
В качестве последнего примера безуспешных попыток классической физики дать полную теорию физических явлений рассмотрим атом водорода.
Согласно классической модели Резерфорда атом водорода состоит из одного электрона, вращающегося вокруг положительно заряженного малого атомного ядра. Эта классическая модель не смогла объяснить два основных экспериментальных факта:
а) стабильность атома водорода
б) структуру излучаемого им электромагнитного спектра.
В основу теории, исходящей из ядерной модели атома и объясняющей его основные опытные свойства и, прежде всего устойчивость и дискретный спектр излучения, Н. Бор положил два постулата (принципа):
1. Постулат стационарных состояний1 (орбит) – в атоме существуют некоторые особые стационарные состояния, находясь в которых электрон вращается вокруг ядра по круговым орбитам и не излучает, хотя и движется с ускорением (центростремительным). Этим постулатом Бор, не покушаясь на справедливость теоретических основ классической физики, допускает исключение из общего правила в виде особых состояний атома с круговыми орбитами электрона в них.
Бор
установил (догадкой) правило определения
стационарных круговых орбит электрона
– так называемое правило
квантования орбит.
Оно утверждает необходимость
целочисленности в постоянных Планка
![]() момента импульса L электрона на этих
орбитах, т. е.: L = mr
= n
момента импульса L электрона на этих
орбитах, т. е.: L = mr
= n![]() ,
где m и
– масса и скорость электрона, r – радиус
его орбиты, n – номер орбиты;
,
где m и
– масса и скорость электрона, r – радиус
его орбиты, n – номер орбиты;
![]() - постоянная Планка.
- постоянная Планка.
Правило
частот.
Излучение и поглощение энергии атомом
происходит при переходе его из одного
стационарного состояния в другое (при
переходе электрона с одной стационарной
орбиты на другую2).
Частота излучения (поглощения) определяется
из условия энергетического баланса:
![]() ,
где
,
где
![]() и
и
![]() - энергии электрона на m - ой и n - ой
орбитах, соответственно.
- энергии электрона на m - ой и n - ой
орбитах, соответственно.
Процесс обратный излучению заключается в поглощении фотона с частотой nm. В этом случае атом переходит из состояния с меньшей энергией в состояние с большей энергией.
Д


В математическом плане Бор при построении теории простейшего атома – атома водорода, отталкивался от двух уравнений для электрона в атоме. Одно из них было чисто классическим, представляя собой, второй закон Ньютона с кулоновской силой (центростремительной), а другое – чисто квантовым – уравнение для момента импульса электрона (правило квантования орбит). Отсюда следовал вывод о непоследовательности теории Бора, которая была уже не чисто классической, но не была еще и последовательно квантовой. Такая непоследовательность обусловила значительную ограниченность теории Бора, ее предсказательных возможностей.
Запишем и решим систему из двух уравнений для электрона в атоме с порядковым номером Z. Напомним, что у Бора Z = 1, что соответствовало атому водорода.
 здесь
здесь
![]() ;
;
![]() ;
;
![]() ;
;
n = 1, 2, 3, … - номера орбит.
Имеем
систему двух уравнений с двумя неизвестными
и r. Избавимся от ,
возведя второе уравнение в квадрат
![]() и
поделив его на первое, в котором сократим
r:
и
поделив его на первое, в котором сократим
r:
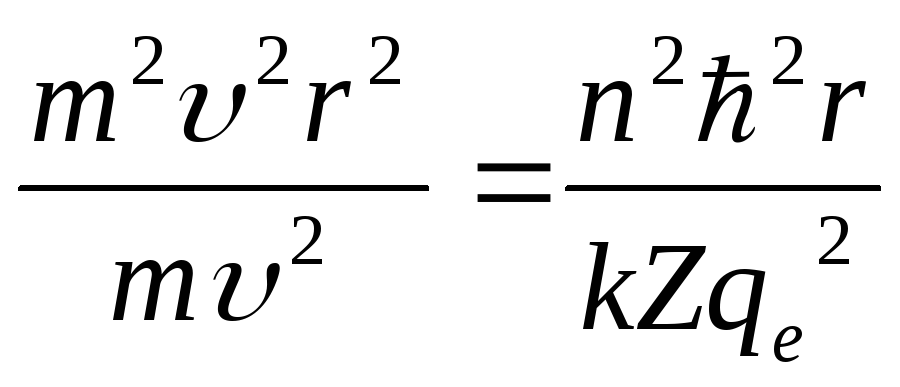
 =
=
![]() .
.
П

Скорость электрона также квантуется:
 ,
причем n
1/n.
,
причем n
1/n.
Полная
энергия электрона в атоме складывается
из суммы кинетической и потенциальной:
![]() ;
;
![]() -
энергия взаимодействия двух, разных по
знаку, точечных зарядов – электрона и
ядра.
-
энергия взаимодействия двух, разных по
знаку, точечных зарядов – электрона и
ядра.
Для
с:
![]() ;
;
![]()
Полученное выражение для полной энергии электрона в атоме содержит набор отрицательных значений; это является свидетельством связанности состояния электрона в атоме – энергия связи (отрицательная) превышает энергию движения (положительную). При возрастании полной энергии до нуля электрон оказывается свободным, а атом ионизированным.
С

![]()
E = 0 – электрон отрывается от ядра, а
атом превращается в положительный ион.
E = 0 – электрон отрывается от ядра, а
атом превращается в положительный ион.
Подставляя
в выражение для полной энергии электрона
ранее выражение для радиуса его орбиты,
получаем формулу для полной энергии
электрона:
 .
Полная энергия Е электрона в атоме
квантуется, т. е. имеет дискретный спектр.
.
Полная энергия Е электрона в атоме
квантуется, т. е. имеет дискретный спектр.
Для
n = 1 (атом водорода)

-13,6 эВ;
-13,6 эВ;
![]() ;
;
![]() ;
… Е
= 0.
;
… Е
= 0.
Энергетические уровни атома с ростом номера уровня сгущаются, и при n изменение энергии атома происходит почти непрерывно. Имеем переход к классической физике, выражаемый принципом соответствия4 Бора.
Разность
энергий электрона на втором и первом
энергетических уровнях называется
энергией
![]() возбуждения
атома: Ев
= Е2
– Е1.
Энергии возбуждения соответствует
потенциал
возбуждения
Vв:
Е = qеVв.
Для водорода Ев
= 10,2 эВ и Vв
= 10,2 В.
возбуждения
атома: Ев
= Е2
– Е1.
Энергии возбуждения соответствует
потенциал
возбуждения
Vв:
Е = qеVв.
Для водорода Ев
= 10,2 эВ и Vв
= 10,2 В.
Разность
энергий на бесконечно удаленной от ядра
и первой орбитах называется энергией
![]() ионизации,
т. е. отрыва электрона от атома; для
водорода Е
= Е
– Е1
= - Е1
= 13,6 эВ.
ионизации,
т. е. отрыва электрона от атома; для
водорода Е
= Е
– Е1
= - Е1
= 13,6 эВ.
Энергия фотона, излучаемого при переходе электрона с m - ой на n - ую орбиты может быть записана в виде: Е = Е(1/n2 – 1/m2).
Объяснение закономерностей линейчатого спектра атома водорода.
Вытекающая из теории Бора дискретная структура энергетических уровней электрона в атоме позволяет объяснить закономерности в спектре излучения атома водорода. Из опыта известно, что спектр теплового излучения невзаимодействующих атомов имеет дискретный характер в виде совокупности отдельных спектральных линий, которые определенным образом упорядочены в некоторые группы, называемые сериями. Такая сериальная упорядоченность спектра излучения атома водорода описывается обобщенной формулой Бальмера:
![]() ,
где
,
где
![]() и
и
![]() - постоянные Ридберга:
- постоянные Ридберга:
![]() ,
,
n - номер спектральной серии; n = 1, 2, 3 …
m - номер спектральной линии в серии; m = n + 1, m + 2 …
При
n = 1;
=![]() (1
– 1/m2),
где m = 2, 3, 4 … - серия Лаймана – лежит в
ультрафиолетовом
диапазоне.
(1
– 1/m2),
где m = 2, 3, 4 … - серия Лаймана – лежит в
ультрафиолетовом
диапазоне.
n
= 2;
=![]() (1/22
– 1/m2),
где m = 3, 4, 5… - серия Бальмера – первые
четыре ее линии лежат в
(1/22
– 1/m2),
где m = 3, 4, 5… - серия Бальмера – первые
четыре ее линии лежат в
видимой области спектра.
n

![]() (1/32
– 1/m2),
где m = 4, 5, 6 … - серия Пашена – лежит в
инфракрасной
области.
(1/32
– 1/m2),
где m = 4, 5, 6 … - серия Пашена – лежит в
инфракрасной
области.
Наглядное представление механизма образования сериально упорядоченного линейчатого спектра атома водорода дано на схеме.
Теория
Бора позволяет просто получить и саму
обобщенную формулу Бальмера. Выразим
из правила частот Бора
![]() частоту
излучения:
частоту
излучения:
![]() и,
подставив в нее выражение для энергии:
и,
подставив в нее выражение для энергии:
![]() получим:
получим:

Сравнивая
с формулой Бальмера, видим, что постоянная
Ридберга
![]() образуется набором фундаментальных
физических констант:
образуется набором фундаментальных
физических констант:
 при Z = 1. Подставляя их значения, получим
для
при Z = 1. Подставляя их значения, получим
для
![]() значение
значение
![]() ,
совпадающее с известным из опыта.
,
совпадающее с известным из опыта.
Формулу Бальмера часто записывают не для частоты , а для обратной длины волны 1/.
Из
= с/
1/
= /с
= (![]() /с)(1/n2
– 1/m2)
= R(1/n2
– 1/m2),
где R =
/с)(1/n2
– 1/m2)
= R(1/n2
– 1/m2),
где R =
![]() /с
=
/с
=
![]() .
.
Спектральная линия с наибольшей длиной волны в данной серии называется ее головной линией, а с наименьшей длиной волны – границей серии.
Формула Бальмера оказывается применимой для так называемых водородоподобных атомов. К ним относят ионизованные атомы, имеющие один электрон, например, однократно ионизованный атом гелия Не+ ( = 2) и двухкратно ионизованный атом лития L++ ( = 3).
Ограниченность теории Бора.
Теория Бора была первым серьезным шагом на пути внедрения квантовых идей в физику вещественного состояния материи. Она позволила вывести характер спектра излучения простейшего атома – водорода, но была не в состоянии предсказать распределение интенсивностей в этом спектре, а также рассчитать спектр более сложных, чем водород атомов. Такая ограниченность теории Бора объяснялась ей внутренней непоследовательностью, паллиативностью (половинчатостью). Здесь был сделан лишь один, первый “квантовый шаг”, который вскрыл плодотворность квантовой гипотезы и необходимость ее более полного воплощения в теории. Оно было последовательно осуществлено в рамках новой фундаментальной физической теории – квантовой механики.
В квантовой механике был найден такой формально - математический аппарат, из которого квантованность (дискретный спектр) мер движения частицы получалась как следствие определенных условий движения и взаимодействия, а не вводилась “вручную”, постулативно, как это вначале было осуществлено Н. Бором.
1 Стационарное состояние с наименьшей энергией называется основным.
2 Возможны переходы электрона в атоме «сверху вниз» и без излучения кванта света. В этом случае энергия возбуждения отдается обычно решетке твердого тела, то есть в виде внутренней, тепловой энергии.
3 Обычно соударения легкого электрона с массивным атомом ртути носят упругий характер – без изменения энергии электрона.
4
В квантовой механике принцип соответствия
будет выражаться иным, нежели n
условием, а именно
![]() 0.
0.
