
- •Кафедра химии древесины и лесохимических продуктов сПб глта
- •Электродвижущие силы и электродные потенциалы
- •1. Строение двойного электрического слоя на границе электрод-раствор электролита
- •2. Уравнение Нернста
- •3. Разность межфазных потенциалов.
- •4. Диффузионный потенциал
- •5. Элемент Якоби – Даниэля. Схематическое изображение электрохимического элемента
- •6. Водородная шкала стандартных потенциалов
- •7. Термодинамическое равновесие в электрохимическом элементе
- •8. Термодинамика электрохимического элемента
- •9. Классификация электродов
- •А. Двухфазные электроды первого рода
- •2. Электроды второго рода
- •3. Газовые электроды – трехфазные
- •Окислительно-восстановительные электроды редокс-электроды
- •Д.Ионообменные (ионоселективные) электроды.
- •10. Классификация электрохимических элементов
- •11. Термодинамические и электростатические соотношения для растворов сильных электролитов
- •Теория Дебая и Хюккеля
- •12. Электролитическая диссоциация воды. Концентрация ионов водорода
- •13. Буферные растворы
- •14. Потенциометрия
- •Измерения с водородным электродом
- •Измерения с хингидронным электродом
- •Измерения со стеклянным электродом
- •3. Стандартные электродные потенциалы e0эл в водных растворах при 25 °c.
Окислительно-восстановительные электроды редокс-электроды
Окислительно-восстановительный электрод – это электрод из инертного металла, являющийся переносчиком электронов, погруженный в раствор, содержащий окисленную и восстановленную форму вещества.
Схема и электродная реакция:
O, R|Pt; O + z ē = R.
Потенциал редокс электрода по уравнению Нернста:
E0, R|Pt = E0O,R + RT/zFln (a0/aR), (19)
где а0 и аR – активность окисленной и восстановленной формы; Z – число электронов, участвующих в окислительно-восстановительной реакции.
В частном случае, при восстановлении Fe3+ до Fe2+ z = 1.
К этому типу электродов относится хингидронный электрод.
Хингидронном называется эквимолекулярное соединение хинона и гидрохинона (тв. вещество) со структурной формулой:
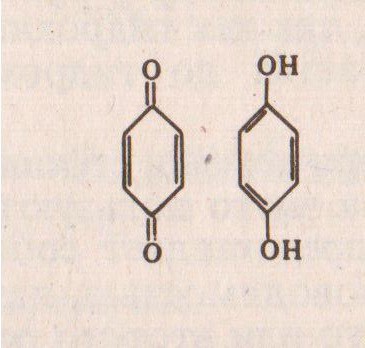
В водном растворе хингидрон распадается на хинон и гидрохинон:
C6H4O2·C6H4(OH)2 C6H4O2+C6H4(OH)2
Хингидронный электрод состоит из инертного металла, погруженного в исследуемый раствор, к которому добавлено небольшое количество хингидрона.
На хингидронном электроде: H+, C6H4O2,C6H4(OH)2Pt, протекает реакция: C6H4O2+2H++2ē C6H4(OH)2
ax aH+ aГ
Потенциал хингидронного электрода при 298 K:
EXГ = E0XГ + 0,02955 lg (axaH+2/aГ) (20)
Т.к. ах/аГХ ≈ 1, то EXГ = E0XГ + 0,02955 lg aH+ (21)
E0XГ – зависит от температуры: E0XГ = 0,699-0,00074 (t-25) (22)
В лабораторном практикуме платиновую пластинку заменяют на графитовый электрод.
Как видно из уравнения (21) хингидронный электрод используют для определения pH растворов.
Д.Ионообменные (ионоселективные) электроды.
В качестве примера ионообменных электродов рассмотрим стеклянный электрод.
В 1906 г. М. Кремер обнаружил существование разности потенциалов между двумя растворами с разной концентрацией водорода ионов, разделенных тонкой стеклянной перегородкой. Оказалось, что разность потенциалов такой цепи пропорциональна разности pH, разделенных перегородкой растворов. Т.е. поверхность стекла приобретает потенциал, величина которого зависит от pH раствора. В дальнейшем работы в этом направлении были продолжены Б.П. Никольским и М.М. Шульцем.
Применение стеклянного электрода (тонкостенной стеклянной мембраны) основано на том, что содержащиеся в структуре стекла катионы могут обмениваться с катионами раствора, в то время как анионы стекла (его каркас) не обмениваются с ионами раствора. Такими катионами являются Na+, Li+, K+. Катионы H+ внедряются в стекло при выдерживании стекла в растворе HCl.
В потенциалопределяющей реакции электроны не участвуют. Электродная реакция на стеклянном электроде – это обмен ионами водорода между раствором и стеклом: H+ H+ ст
Потенциал стеклянного электрода:
Eст. = E01ст + 2,3RT/2F[ lg (aH+/aH+ст)] = E01ст + b lg (aH+/aH+ст) (23)
где: z = 1, за счет перемещения единичного заряда иона водорода. Значение 2,3 RT/F обозначим b, т.к. оно несколько отличается от теоретического для стеклянного электрода.
Фактически в реакции обмена участвуют ионы щелочного металла:
H + + M ст+ H+ст M+
Этой реакции отвечает константа обмена:
Kобм = aH+(a - aH+ст.) / aHст. · aM+ (24)
Кобм зависит от сорта стекла, температуры. Считаем, что в данном сорте стекла сумма активностей ионов H+ и M+ постоянна, т.е. аH+ст + аМ+ст = а, тогда:
Кобм = aH+(a - aH+ст.) / aHст+·aM+ или aH+/ aHст+
= aH+· Кобм аМ+/a (25)
Подставим (25) в (23)
Получим: Eст. = E0ст.+ b (lg aH+ + Кобм ам+)
Т.к. b lg a – постоянная величина, то: E0ст. = E01ст. – b lg aH+ (26)
Для кислых растворов аН+ >> K обм · ам+, тогда (26) принимает вид:
Eст. = E0ст.+ b · lg aH+ = E0ст. – b pH (27)
Уравнение (27) справедливо для нейтральных сред и слабощелочных сред до pH 10 – 12, т.к. в этих условиях еще справедливо неравенство
аН+ >> K обм · ам+. В сильнощелочных растворах электрод становится обратимым относительно катиона натрия и K обм aNa+ > aH+.
