
- •Кафедра химии древесины и лесохимических продуктов сПб глта
- •Электродвижущие силы и электродные потенциалы
- •1. Строение двойного электрического слоя на границе электрод-раствор электролита
- •2. Уравнение Нернста
- •3. Разность межфазных потенциалов.
- •4. Диффузионный потенциал
- •5. Элемент Якоби – Даниэля. Схематическое изображение электрохимического элемента
- •6. Водородная шкала стандартных потенциалов
- •7. Термодинамическое равновесие в электрохимическом элементе
- •8. Термодинамика электрохимического элемента
- •9. Классификация электродов
- •А. Двухфазные электроды первого рода
- •2. Электроды второго рода
- •3. Газовые электроды – трехфазные
- •Окислительно-восстановительные электроды редокс-электроды
- •Д.Ионообменные (ионоселективные) электроды.
- •10. Классификация электрохимических элементов
- •11. Термодинамические и электростатические соотношения для растворов сильных электролитов
- •Теория Дебая и Хюккеля
- •12. Электролитическая диссоциация воды. Концентрация ионов водорода
- •13. Буферные растворы
- •14. Потенциометрия
- •Измерения с водородным электродом
- •Измерения с хингидронным электродом
- •Измерения со стеклянным электродом
- •3. Стандартные электродные потенциалы e0эл в водных растворах при 25 °c.
5. Элемент Якоби – Даниэля. Схематическое изображение электрохимического элемента
Рассмотрим систему (рис. 3), в которой не один, а два каких-нибудь металла, например, цинк и медь в виде пластинок опущены в растворы своих солей: сульфата цинка и сульфата меди (II) с соответствующими активностями (a1 и a2). Эти растворы сообщаются между собой с помощью пористой перегородки (или электролитического мостика), что дает возможность ионам перемещаться из одного раствора в другой. Каждый из металлов может выделить в раствор то количество ионов, которое отвечает его равновесию с раствором. Отвечающие такому равновесию потенциалы этих металлов неодинаковы. Цинк обладает более высокой способностью выделить ионы в раствор, чем медь, и поэтому приобретает более высокий отрицательный заряд. Если пластины соединить проволокой, то из-за разницы потенциалов с цинковой пластины на медную пластину будут переходить электроны, что и дает электрический ток.
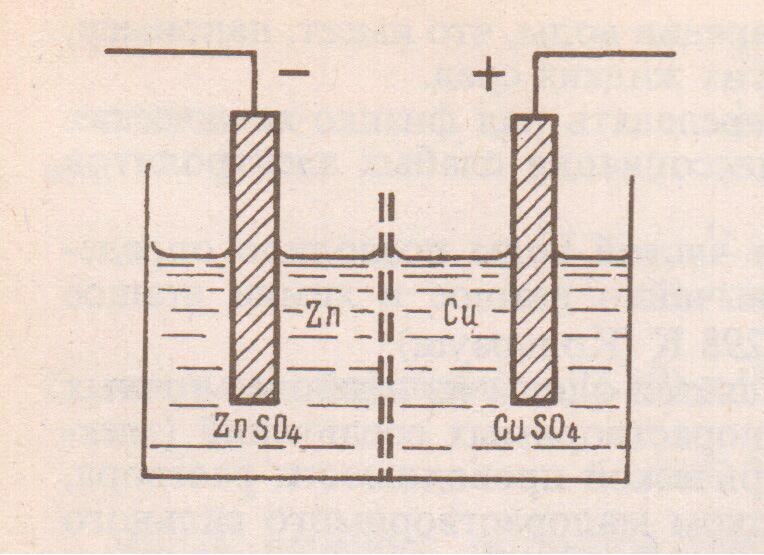
Рис. 3 Схема медно-цинкового электрохимического элемента
Включив бесконечно близкую по величине, но противоположно направленную разность потенциалов для того, чтобы процесс протекал в практически обратимых условиях, можно определить максимальную работу процесса и условия равновесия. Электрохимическим элементом называется устройство, дающее возможность получать электрический ток за счет проведения какой-либо окислительно-восстановительной химической реакции.
Электрическая работа будет наибольшей, когда элемент работает в условиях, наиболее близких к обратимым. Наибольшая разность потенциалов данного элемента (при обратимых условиях работы) называется электродвижущей силой (обозначается ЭДС).
При замыкании внешней цепи цинк растворяется. Происходит реакция окисления:

а на медном электроде выделяется медь – реакция восстановления

Общий процесс является суммой процессов, протекающих на отдельных электродах:

Внутренняя проводимость электрохимического элемента осуществляется через мембрану (электролитический мостик). Анионы SO42- начинают перемещаться из раствора сульфата меди (II) в раствор сульфата цинка, проходя через поры перегородки.
Важно заметить, что во всяком работающем электрохимическом элементе на отрицательном электроде осуществляется реакция окисления, а на положительном электроде реакция восстановления. Согласно правилам записи элемент Якоби-Даниэля можно представить схемой
(-) Zn|Zn2+||Cu2+|Cu(+)
В общем виде
(-) M2|M1|M1z+||M2z+|M2(+)
Сплошными линиями разделены фазы; двойной линией электролитический мостик; снизу обозначена активность электролитов; элемент разомкнут правильно, выводы к электроизмерительному прибору состоят из проводников M2 одинаковой природы; между металлами M1 и M2 существует контактная разность потенциалов. В дальнейшем мы ее показывать не будем.
Электрод вместе с раствором, куда он погружен, называется полуэлементом (или электродной ячейкой). На схеме полуэлементы разделены электролитическим мостиком.
При замыкании на отрицательном электроде идет реакция окисления, а на положительном – восстановления. ЭДС равна разности потенциалов полуэлементов: из потенциала полуэлемента, в котором происходит восстановление (справа) вычитают потенциал полуэлемента, в котором происходит окисление (слева). Причем электрический ток будет направлен в сторону, противоположную движению электронов, чтобы ЭДС была положительна.
