
- •Кафедра химии древесины и лесохимических продуктов сПб глта
- •Электродвижущие силы и электродные потенциалы
- •1. Строение двойного электрического слоя на границе электрод-раствор электролита
- •2. Уравнение Нернста
- •3. Разность межфазных потенциалов.
- •4. Диффузионный потенциал
- •5. Элемент Якоби – Даниэля. Схематическое изображение электрохимического элемента
- •6. Водородная шкала стандартных потенциалов
- •7. Термодинамическое равновесие в электрохимическом элементе
- •8. Термодинамика электрохимического элемента
- •9. Классификация электродов
- •А. Двухфазные электроды первого рода
- •2. Электроды второго рода
- •3. Газовые электроды – трехфазные
- •Окислительно-восстановительные электроды редокс-электроды
- •Д.Ионообменные (ионоселективные) электроды.
- •10. Классификация электрохимических элементов
- •11. Термодинамические и электростатические соотношения для растворов сильных электролитов
- •Теория Дебая и Хюккеля
- •12. Электролитическая диссоциация воды. Концентрация ионов водорода
- •13. Буферные растворы
- •14. Потенциометрия
- •Измерения с водородным электродом
- •Измерения с хингидронным электродом
- •Измерения со стеклянным электродом
- •3. Стандартные электродные потенциалы e0эл в водных растворах при 25 °c.
Рассмотрены и рекомендованы к изданию
учебно-методической комиссией
факультета химической технологии и биотехнологии
Санкт-Петербургской государственной лесотехнической академии
25 мая 2011 г.
С о с т а в и т е л и:
кандидат технических наук, доцент И.П. Шабанова
Отв. редактор
доктор, химических наук, профессор В.И. Рощин
Р е ц е н з е н т
Кафедра химии древесины и лесохимических продуктов сПб глта
Физическая Химия. Электродвижущие силы: методические указания к лабораторным работам/сост.: И.П. Шабанова – СПб.: СПб ГЛТА, 2011 - 40 с.
В методических указаниях даны теоретические сведения о равновесных системах, содержащих заряженные частицы: рассмотрена термодинамика электрохимических элементов, их классификация, причины возникновения электродного потенциала, и характеристики электродов.
Представлено подробное описание лабораторных работ по измерению ЭДС химических и концентрационных цепей, потенциалов отдельных электродов, а также потенциометрические измерения pH буферных растворов.
Темплан 2011 г
В в е д е н и е
Электродвижущие силы и электродные потенциалы
Химические превращения в растворах или расплавах на электродах при которых происходит перенос заряда через границу между электродами и электролитом, называются электродными процессами.
К электродным процессам относятся две группы процессов, тесно связанные между собой. Во-первых, это возникновение разности потенциалов и как следствие, электрического тока в гальванических элементах. Во-вторых, обратные им химические процессы, которые имеют место при прохождении постоянного электрического тока через раствор или расплав, называемые электролизом. Эти две группы процессов во многих случаях являются взаимно обратимыми. Хорошо известный свинцовый аккумулятор может служить примером такой обратимости. При зарядке его с помощью внешнего источника тока, осуществляется химическая реакция, которая при использовании заряженного аккумулятора в качестве источника тока протекает в обратном направлении и обуславливает необходимую разность потенциалов на электродах.
1. Строение двойного электрического слоя на границе электрод-раствор электролита
При погружении металлической пластинки в воду некоторая часть ионов металла с поверхности пластинки (в результате взаимодействия полярных молекул воды с катионами) переходит в раствор, прилегающий к поверхности – это ион-дипольное взаимодействие, характерное для нейтральных металлов.
Металл, погруженный в раствор, содержащий ионы данного металла называются электродом I рода. Металл заряжается отрицательно, и возникающие электростатические силы препятствуют дальнейшему течению этого процесса. В системе устанавливается электрохимическое равновесие. Указанные процессы приводят к возникновению двойного электрического слоя (ДЭС) и скачка потенциала между отрицательно заряженным металлом и слоем положительно заряженных ионов в растворе. Но вся система электрод-раствор остается электронейтральной. Одной обкладкой ДЭС служат заряды со стороны металла (избыточные электроны), а со стороны раствора электролита положительные ионы. Протяженность ДЭС составляет
10-5 – 10-7 м от поверхности металла (рис.1) (аналогично ионы из раствора могут переходить в металл, тогда он заряжается положительно). При погружении металла в раствор соли наблюдается такая же картина, но равновесие будет наступать при другом скачке потенциала, зависящим от природы металла и его концентрации, а точнее активности ионов в растворе. Одной обкладкой такого ДЭС служат заряды (катионы) со стороны металла, а другой заряда ионов (анионов) со стороны раствора.
В зависимости от расположения ионов в ДЭС различают плотный и диффузионный слои и два скачка потенциалов на границе металл-раствор.
К поверхности металла за счет электростатических сил и специфической адсорбции плотно притянуты ионы из раствора на расстоянии d (близкого радиусу сольватированного иона). Это плотный слой ДЭС.
Другая часть ионов, под влиянием с одной стороны электростатического притяжения к поверхности электрода, а с другой стороны – теплового движения, расположена на большом расстоянии от поверхности 1/æ = r. Здесь r – аналог радиуса ионной атмосферы, æ – параметр Дебая-Хюккеля, зависящий от концентрации и заряда ионов. Эти ионы образуют диффузионный слой. И на расстоянии в несколько десятков атомных диаметров от поверхности электрода плотность зарядов становится очень мала.
Если общий скачок потенциала равен E между металлом и раствором, а скачок потенциала в диффузном слое ѱ1 потенциал, то скачок потенциала в плотном слое ДЭС равен E-ѱ1 (рис. 1).
С увеличением активности ионов ДЭС сжимается, т.к. ѱ1 уменьшается, а E – ѱ1 увеличивается.
В условиях специфической адсорбции строение ДЭС будет иное и соответственно разница E – ѱ1 изменится.
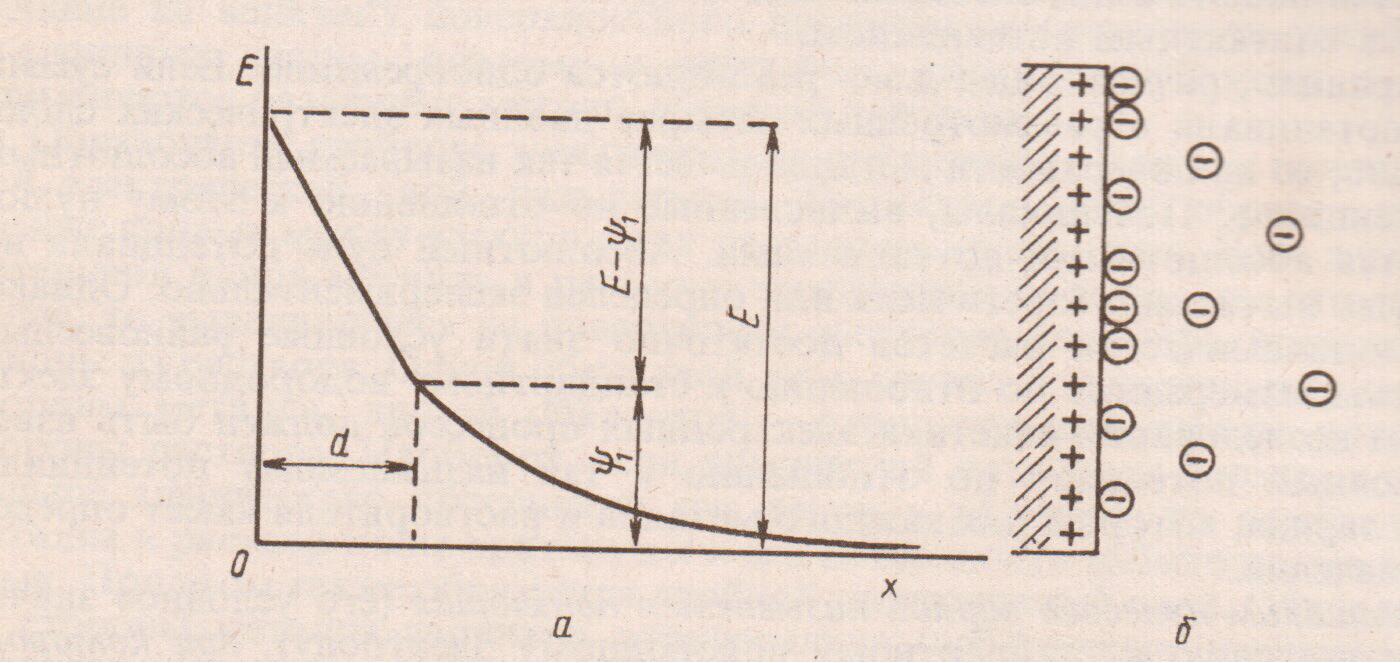
Рис. 1 а) Изменение потенциала с расстоянием x от поверхности электрода;
б) Строение ДЭС.
В данном случае ДЭС можно уподобить, плоскому конденсатору, одной обкладкой которого служит заряженная поверхность металла, а другой – эффективная граничная поверхность при r.
Таким образом, при погружении металла в воду или в раствор, содержащий ионы данного металла, на поверхности раздела металл/раствор образуется ДЭС и возникает разность / скачок потенциала между металлом и раствором.
Величина этой разницы зависит от свойств металла и раствора, концентрации металла в растворе и характера взаимодействия между частицами в ДЭС.
Примечание. Описанный механизм не является общим. Некоторые инертные мет металлы (платина, золото) обладают очень прочной кристаллической решеткой, что катионы из нее не могут освободиться. Поверхность таких металлов может адсорбировать многие вещества, способные окисляться или восстанавливаться. Это инертные электроды. Их потенциал определяется равновесием между адсорбированным на инертном электроде и растворенным веществом. Например, на платинированной пластине адсорбирован водород, находящийся в равновесии с ионами водорода в растворе. Здесь окисленная форма вещества находится в растворе, а восстановленная – на электроде.
Бывает, что обе формы находятся в растворе – тогда происходит обмен электронами между инертным электродом и ионами. Так катионы Fe3+ могут отнять от платины один электрон и восстанавливаться до Fe2+. При этом платина зарядится положительно, а раствор – отрицательно.
