
- •«Очистка выбросов производства автомобильных кондиционеров от летучих органических соединений»
- •Содержание
- •Введение
- •Глава 1. Газовые выбросы при производстве автомобильных кондиционеров.[11]
- •Глава 2. Методики очистки газов от летучих органических соединений.
- •Глава 3. Существующие типы абсорберов. [1]
- •2.1. Поверхностные абсорберы
- •Сравнительная характеристика насадок различных типов.
- •2.2. Барботажные (тарельчатые) абсорберы
- •2.3. Распыливающие абсорберы
- •Глава 4. Выбор прототипа абсорбера.
- •Список литературы
Глава 2. Методики очистки газов от летучих органических соединений.
в ч
В настоящее время широко применяются несколько методов очистки газов от ЛОС, и все они делятся на рекуперативные и деструктивные.[3]
Первые позволяют возвращать в производство компоненты выбросов, вторые трансформируют эти компоненты в менее вредные.
Для очистки от газов применяют следующие методы:
1. Термические методы очистки[6].
Являются деструктивными. При достаточной теплотворной способности выбросного газа его можно сжечь напрямую (все видели факелы, на которых горит попутный газ), можно применить каталитическое окисление, или (при малой теплотворной способности газа) использовать его в качестве дутьевого газа в печах. Получающиеся в результате термического разложения компоненты должны быть менее опасными для окружающей среды, чем исходный компонент (например, органические соединения можно окислить до углекислого газа и воды – если нет других элементов, кроме кислорода, углерода и водорода). Этот метод позволяет добиться высокой степени очистки, но может стоить дорого, особенно если используется дополнительное топливо.
2.Химические методы очистки. [6]
Как правило связанные с использованием катализаторов. Таковым, например, является каталитическое восстановление оксидов азота из выхлопных газов автотранспорта (в общем виде механизм этой реакции описывается схемой (2.1):
CnHm + NOx + CO----->CO2 + H2O +N2, Kt (2.1)
где в качестве катализатора Kt используется платина, палладий, рутений или другие вещества). Методы могут требовать применения реагентов и дорогих катализаторов.
3. Адсорбция[5].
То есть поглощение твёрдым веществом газового (в нашем случае) компонента. В качестве адсорбентов (поглотителей) применяют активные угли различных марок, цеолиты, силикагель и другие вещества. Адсорбция – надёжный способ, позволяющий достигать высоких степеней очистки; кроме того, это регенеративный метод, то есть уловленный ценный компонент можно вернуть обратно в производство. Применяется периодическая и непрерывная адсорбция. В первом случае по достижении полной адсорбционной емкости адсорбента газовый поток направляют в другой адсорбер, а адсорбент регенерируют – для этого используется отдувка острым паром или горячим газом. Затем ценный компонент можно получить из конденсата (если для регенерации использовался острый пар); для этой цели используется ректификация, экстракция или отстаивание (последнее возможно в случае взаимной нерастворимости воды и ценного компонента). При непрерывной адсорбции слой адсорбента постоянно перемещается: часть его работает на поглощение, часть – регенерируется. Это, конечно, способствует истиранию адсорбента. В случае достаточной стоимости регенерируемого компонента использование адсорбции может быть выгодным. Например, проведенный для одного из кабельных заводов расчёт участка рекуперации ксилола (весной 2001 года) показал, что срок окупаемости составит менее года. При этом 600 т ксилола, которые ежегодно попадали в атмосферу, будут возвращены в производство.
4. Абсорбция[1].
То есть поглощение газов жидкостью. Этот метод основан либо на процессе растворения газовых компонентов в жидкости (физическая адсорбция), либо на растворении вместе с химической реакцией – химическая адсорбция (например, поглощение кислого газа раствором с щелочной реакцией). Этот метод также является регенеративным, из полученного раствора можно выделить ценный компонент (при использовании химической адсорбции это не всегда возможно). В любом случае вода очищается и хотя бы частично возвращается в систему оборотного водоснабжения.
2.1. Термические методы. [5]
Термический метод обезвреживания получил более широкое распространение, так как некоторые вредные примеси трудно или невозможно полностью нейтрализовать другими методами из-за сложности их состава, низкой концентрации, а также из-за отсутствия эффективных средств улавливания. Он заключается в том, что все органические вещества полностью окисляются кислородом воздуха при высокой температуре до нетоксичных соединений. В результате выделяются минеральные продукты, вода, диоксид углерода, а также теплота, которые требуют дальнейшей их утилизации.
Метод термического окисления (дожига) органических веществ, содержащихся в отходящих газах, относится к энергоемким. Для поддержания необходимой температуры обезвреживания отходящих газов (800 -1200°С) используется высококалорийное топливо, поэтому преимущественно этот способ применяется для обезвреживания газов сложного состава и в тех случаях, когда возврат уловленных примесей в производство экономически нерентабелен.
Наиболее экономичным приемом термического обезвреживания газов из выбросов является их использование вместо дутьевого воздуха при сжигании высококалорийного топлива (природного газа, мазута) в действующих тепловых агрегатах, таких как печи, сушилки, топки и т. д. Для обеспечения надежного и качественного горения минимальное содержание кислорода в газовых выбросах должно быть около 17 %.
Метод дожига углеводородов получает все большее распространение. Накоплен опыт термического обезвреживания воздуха, содержащего примеси стирола, формальдегида, толуола, бутилацетата и других органических веществ.
Установки прямого сжигания представляют собой камеру, в которую по самостоятельным каналам подается топливо, очищаемый газ и воздух. Для полного окисления горючих компонентов необходимо тщательное перемешивание смеси. С целью снижения затрат отходящие газы чаще всего сжигаются совместно с твердыми отходами. В результате упрощается проблема утилизации промышленных отходов в целом, а также резко снижаются энергетические и эксплуатационные затраты. С помощью современных установок термодожига можно обеспечить полную безвредность и высокую производительность этого процесса.
Одним из таких устройств является установка типа «Вихрь» для бездымного сжигания нефтепродуктов, подлежащих вторичному использованию. В этой установке совмещены функции обезвреживания газов и сжигания отходов. Поступающий в установку шлам первоначально автоматически обезвоживается, а затем направляется в топочную камеру, где сжигается в ускоренном режиме при температуре порядка 1000 °С и подаче строго рассчитанного количества сжатого воздуха. Такие жесткие условия процесса способствуют тому, что побочные реакции окисления, ведущие к образованию тяжелых смолистых продуктов, оседающих плотными трудно выгораемыми наслоениями, отсутствуют. Процесс обеспечивает полное окисление продуктов, бездымность горения, отсутствие запахов и требуемую степень обезвреживания отходящих газов. По простоте конструкции, надежности в работе, высокому КПД и возможности подключения теплообменников для утилизации тепла установка «Вихрь» значительно превосходит другие агрегаты аналогичного назначения.
С целью снижения температуры обезвреживания органических примесей применяют установки сжигания, где в качестве инициатора окисления используются различные катализаторы. Тем самым достигается снижение температуры обезвреживания более чем в два раза и обеспечивается возможность нейтрализации газов с низким содержанием вредных примесей.
Особенность установки термокаталитического обезвреживания состоит в том, что затраты энергии необходимы только в момент пуска, т. е. когда требуется подогреть газовый поток до начальной температуры каталитического окисления (300 — 400 °С). Затем процесс протекает самопроизвольно за счет теплоты реакции окисления.
В качестве эффективных катализаторов, находящих применение на практике, служат самые различные вещества – от минералов, которые используются почти без всякой предварительной обработки, и простых массивных металлов до сложных соединений заданного состава и строения. Обычно каталитическую активность проявляют твердые вещества с ионными или металлическими связями, обладающие сильными межатомными полями. Одно из основных требований, предъявляемых к катализатору - устойчивость его структуры в условиях реакции. Например, металлы не должны в процессе реакции превращаться в неактивные соединения.
Современные катализаторы обезвреживания характеризуются высокой активностью и селективностью, механической прочностью и устойчивостью к действию ядов и температур. Промышленные катализаторы, изготавливаемые в виде колец и блоков сотовой структуры, обладают малым гидродинамическим сопротивлением и высокой внешней удельной поверхностью.
Наибольшее распространение получили каталитические методы обезвреживания отходящих газов в неподвижном слое катализатора. Можно выделить два принципиально различных метода осуществления процесса газоочистки - в стационарном и в искусственно создаваемом нестационарном режимах.
1. Стационарный метод.
Приемлемые для практики скорости химических реакций достигаются на большинстве дешевых промышленных катализаторов при температуре 200-600 °C. После предварительной очистки от пыли (до 20 мг/м³) и различных каталитических ядов (As,Cl2 и др.), газы обычно имеют значительно более низкую температуру.
Подогрев газов до необходимых температур можно осуществлять за счет ввода горячих дымовых газов или с помощью электроподогревателя. После прохождения слоя катализатора очищенные газы выбрасываются в атмосферу, что требует значительных энергозатрат. Добиться снижения энергозатрат можно, если тепло отходящих газов использовать для нагревания газов, поступающих в очистку. Для нагрева служат обычно рекуперативные трубчатые теплообменники.
При определенных условиях, когда концентрация горючих примесей в отходящих газах превышает 4-5 г/м³, осуществление процесса по схеме с теплообменником позволяет обойтись без дополнительных затрат.
Такие аппараты могут эффективно работать только при постоянных концентрациях (расходах) или при использовании совершенных систем автоматического управления процессом.
Эти трудности удается преодолеть, проводя газоочистку в нестационарном режиме.
2. Нестационарный метод ( реверс-процесс).
Реверс-процесс предусматривает периодическое изменение направлений фильтрации газовой смеси в слое катализатора с помощью специальных клапанов. Процесс протекает следующим образом. Слой катализатора предварительно нагревают до температуры, при которой каталитический процесс протекает с высокой скоростью. После этого в аппарат подают очищенный газ с низкой температурой, при которой скорость химического превращения пренебрежимо мала. От прямого контакта с твердым материалом газ нагревается, и в слое катализатора начинает с заметной скоростью идти каталитическая реакция. Слой твердого материала (катализатора), отдавая тепло газу, постепенно охлаждается до температуры, равной температуре газа на входе. Поскольку в ходе реакции выделяется тепло, температура в слое может превышать температуру начального разогрева. В реакторе формируется тепловая волна, которая перемещается в направлении фильтрации реакционной смеси, т.е. в направлении выхода из слоя. Периодическое переключение направления подачи газа на противоположное позволяет удержать тепловую волну в пределах слоя как угодно долго.
Преимущество этого метода в устойчивости работы при колебаниях концентраций горючих смесей и отсутствие теплообменников.
Основным направлением развития термокаталитических методов является создание дешевых катализаторов, эффективно работающих при низких температурах и устойчивых к различным ядам, а также разработка энергосберегающих технологических процессов с малыми капитальными затратами на оборудование. Наиболее массовое применение термокаталитические методы находят при очистке газов от оксидов азота, обезвреживании и утилизации разнообразных сернистых соединений, обезвреживания органических соединений и СО.
Для концентраций ниже 1 г/м³ и больших объемов очищаемых газов использование термокаталитического метода требует высоких энергозатрат, а также большого количества катализатора.
Термокаталитическое дожигание органических веществ до диоксида углерода и воды применяют в тех случаях, когда отходящие газы представляют собой многокомпонентную смесь различных органических веществ. В настоящее время разработаны типовые схемы обезвреживания выбросов от сушильных камер путем сжигания паров растворителей на поверхности катализатора. Внедрение схем, предусматривающих последующую утилизацию теплоты, позволяет достичь сокращения расхода теплоносителей не менее чем на 20 % (при сжигании паров с низким содержанием горючего компонента).
2.2. Химические методы. [7]
Устранение нежелательных компонентов в газах с использованием химических методов означает, что в основе процесса лежит химическая реакция и ее роль является преобладающей по сравнению с процессами адсорбции, абсорбции, конденсации или сжигания. В большинстве случаев, однако, технология сочетает в себе несколько операций и достаточно сложно классифицировать метод очистки в соответствии с перечисленными выше физико-химическими методами. Например, метод очистки газа от SO2 с использованием извести или известкового молока не приводится здесь в качестве химического, поскольку определяющей операцией является абсорбция на стадии скруббирования. Из этого примера видно, что определение, данное «химическому» методу очистки, неоднозначно и вводится для удобства изложения и необходимости классификации.
1) Введение аммиака.
Методы очистки газов от NOX являются наиболее удачным примером применения химических методов для обеспечения экологической чистоты промышленных выбросов. Особо отмечены два метода: некаталитическое гомогенное восстановление NOX добавками аммиака и селективный гетерогенно-каталитический процесс восстановления оксидов азота в присутствии NH3.
2) Метод селективного каталитического восстановления (СКВ).
В мировой практике проблеме очистки топочных газов уделяется большое внимание и разрабатывается несколько направлений, Однако наиболее перспективен «сухой» (без стадии промывки) способ, так как он прост и отличается более низкой стоимостью. Введение стадии абсорбции оксидов растворами резко усложняет технологию вследствие необходимости очистки сточных вод. Селективное каталитическое восстановление основано на реакции восстановления оксидов азота аммиаком на поверхности гетерогенного катализатора в присутствии кислорода. Термин «селективный» в данном случае отражает предпочтительное протекание каталитической реакции аммиака с оксидами азота по сравнению с кислородом. В то же время кислород является реагентом в каталитической реакции. Метод СКВ применим в первую очередь к топочным газам в условиях полного сгорания содержание кислорода в них более 1 % и отходящий газ подвергается химической реакции в окислительных условиях. Ранее описанный процесс некаталитического восстановления (НКВ) применим к топочным газам с высоким процентным содержанием исходного топлива, т. е. когда обеспечиваются восстанавливающие свойства газового потока. Процесс СКВ может быть представлен следующими брутто-уравнениями 2.2. и 2.3.:
2NH3 + 2NO + ½02 -+ 2N2 + ЗН2О; (2.2)
2NH3 + N02 + ½02 + 3/2N2 + 3H20. (2.3)
3) Неселективное каталитическое восстановление (НСКВ).
В данном методе восстанавливающий агент — аммиак — заменяется другими восстановителями (Н2, СО, углеводороды). Эти востановители действуют не селективно, поскольку взаимодействуют с кислородом и SOX газового потока; это взаимодействие идёт параллельно с целевой реакцией восстановления оксидов азота, что требует значительного избытка восстановителей. Чтобы обеспечить неселективное каталитическое восстановление, целесообразно проводить сжигание таким образом, чтобы образующийся топочный газ обладал восстанавливающими свойствами. Практически это означает подачу в камеру сжигания топлива и кислорода в количествах, близких к стехиометрическому отношению (так называемая обедненная горючим смесь). В этих условиях СО и непрореагировавшие углеводороды вступают в реакцию каталитического восстановления NOX и отпадает необходимость в дополнительном введении восстановителя в газовый поток. Такому процессу сжигания аналогичен процесс регулирования степени сгорания топлива в двигателях внутреннего сгорания автомобилей. Перенос технических решений автомобильной промышленности на стационарные сжигающие устройства находятся в стадии начальной разработки и не обсуждается более подробно.
4) Облучение потоком электронов.
Другой перспективный метод очистки отходящих газов от оксидов азота — стимулирование химических реакций с помощью электронного пучка. Метод обеспечивает восстановление NOX и SОx в реакции с аммиаком в отсутствие катализатора под дейcтвием стимулирующего излучения. Первоначально поток топочных газов очищается от золы, затем подается аммиак и газовая смесь облучается в реакторе. В результате аммиак и оксиды превращаются в сухой порошок неорганических солей: (NH4)2SO4 и (NH4)2SO4*2NH4NO3. В настоящее время нет точного описания химического механизма. После отделения солей горячий топочный газ выбрасывается через дымоход. Пилотная установка, работающая на этом принципе, обеспечивает восстановление 85 % оксид азота и 95 % оксидов серы в сильно загрязненных топочных газ котельных, использующих нефть в качестве топлива. Метод находится в стадии развития, однако имеет перспективы благодаря высокой эффективности одновременного удаления оксидов азот и серы, а также возможности получения в сухом виде ценного полупродукта для производства удобрений. Экономическую сторону такого способа очистки следует оценить в условиях длительной эксплуатации.
2.3. Адсорбция. [8]
Адсорбция (лат. Ad — на, при; sorbeo — поглощаю) — в широком смысле, процесс изменения концентрации у поверхности раздела двух фаз. В более узком и употребительном — это повышение концентрации одного вещества (газ, жидкость) у поверхности другого вещества (жидкость, твердое тело).
Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтив, поглощённое — адсорбат. В более узком смысле под адсорбцией часто понимают поглощение примеси из газа или жидкости твёрдым веществом (в случае газа и жидкости) или жидкостью (в случае газа) — адсорбентом. При этом, как и в общем случае адсорбции, происходит концентрирование примеси на границе раздела адсорбент-жидкость либо адсорбент-газ. Процесс, обратный адсорбции, то есть перенос вещества с поверхности раздела фаз в объём фазы, называется десорбция. Если скорости адсорбции и десорбции равны, то говорят об установлении адсорбционного равновесия. В состоянии равновесия количество адсорбированных молекул остается постоянным сколь угодно долго, если неизменны внешние условия (давление, температура и состав системы)[7]
На поверхности раздела двух фаз помимо адсорбции, обусловленной в основном физическими взаимодействиями (главным образом это Ван-дер-Ваальсовы силы), может идти химическая реакция. Этот процесс называется хемосорбцией. Чёткое разделение на адсорбцию и хемосорбцию не всегда возможно. Одним из основных параметров по которым различаются эти явления является тепловой эффект: так, тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата, тепловой эффект хемосорбции значительно выше. Кроме того в отличие от адсорбции хемосорбция обычно является необратимой и локализованной. Примером промежуточных вариантов, сочетающих черты и адсорбции и хемосорбции является взаимодействие кислорода на металлах и водорода на никеле: при низких температурах они адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать хемосорбция.
Причиной адсорбции являются неспецифические (то есть не зависящие от природы вещества)Ван-дер-Ваальсовы силы. Адсорбция, осложнённая химическим взаимодействием между адсорбентом и адсорбатом, является особым случаем. Явления такого рода называют хемосорбцией и химической адсорбцией. «Обычную» адсорбцию в случае, когда требуется подчеркнуть природу сил взаимодействия, называют физической адсорбцией.
Физическая адсорбция является обратимым процессом, условие равновесия определяется равными скоростями адсорбции молекул адсорбтива P на вакантных местах поверхности адсорбента S* и десорбции — освобождения адсорбата из связанного состояния S − P (2.4):
![]() ;
(2.4)
;
(2.4)
уравнение равновесия в таком случае (2.5):
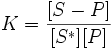 ,
(2.5)
,
(2.5)
где K — константа равновесия;
[S − P] и [S*] — доли поверхности адсорбента, занятые и незанятые адсорбатом;
[P] — концентрация адсорбтива.
Количественно процесс физической мономолекулярной адсорбции в случае, когда межмолекулярным взаимодействием адсорбата можно пренебречь, описывается уравнением Ленгмюра (2.6):
 ,
(2.6)
,
(2.6)
где ![]() —
доля площади поверхности адсорбента,
занятая адсорбатом;
—
доля площади поверхности адсорбента,
занятая адсорбатом;
![]() —
адсорбционный
коэффициент Ленгмюра;
—
адсорбционный
коэффициент Ленгмюра;
P — концентрация адсорбтива.
Поскольку [S – P] = θ и, соответственно, [S*] = 1 - θ, уравнение адсорбционного равновесия может быть записано следующим образом (2.7):
![]() (2.7)
(2.7)
Уравнение Ленгмюра является одной из форм уравнения изотермы адсорбции. Под уравнением изотермы адсорбции (чаще применяют сокращённый термин — изотерма адсорбции) понимают зависимость равновесной величины адсорбции от концентрации адсорбтива a=f(С) при постоянной температуре (T=const). Концентрация адсорбтива для случая адсорбции из жидкости выражается, как правило, в мольных либо массовых долях. Часто, особенно в случае адсорбции из растворов, пользуются относительной величиной: С/Сs, где С — концентрация, Сs — предельная концентрация (концентрация насыщения) адсорбтива при данной температуре. В случае адсорбции из газовой фазы концентрация может быть выражена в единицах абсолютного давления, либо, что особенно типично для адсорбции паров, в относительных единицах: P/Ps, где P — давление пара, Ps — давление насыщенных паров этого вещества. Саму величину адсорбции можно выразить также в единицах концентрации (отношение числа молекул адсорбата к общему числу молекул на границе раздела фаз). Для адсорбции на твёрдых адсорбентах, особенно при рассмотрении практических задач, используют отношение массы или количества поглощённого вещества к массе адсорбента, например мг/г или ммоль/г. Адсорбция — всеобщее и повсеместное явление, имеющее место всегда и везде, где есть поверхность раздела между фазами. Наибольшее практическое значение имеет адсорбция поверхностно-активных веществ и адсорбция примесей из газа либо жидкости специальными высокоэффективными адсорбентами. В качестве адсорбентов могут выступать разнообразные материалы с высокой удельной поверхностью: пористый углерод (наиболее распространённая форма — активированный уголь), силикагели, цеолиты а также некоторые другие группы природных минералов и синтетических веществ.
Адсорбция (особенно хемосорбция) имеет также важное значение в гетерогенном катализе. Пример адсорбционных установок приведён на странице азотные установки.
2.4. Абсорбция. [1]
Абсорбцией называют процесс поглощения газов или паров из газовых (паровоздушных) смесей жидкими поглотителями, называемыми абсорбентами. Возможность проведения абсорбции основывается на растворимости газов в жидкостях. Процесс абсорбции является избирательным и обратным, что дает возможность применять его не только для получения растворов газов в жидкостях, но также и для разделения газовых и паровых смесей, например для извлечения из коксового газа аммиака, бензола.
Наибольшее распространение получили насадочные (поверхностные) и барботажные тарельчатые абсорберы. Для эффективного применения водных абсорбционных сред удаляемый компонент должен хорошо растворяться в абсорбционной среде и часто химически взаимодействовать с водой, как, например, при очистке газов от HCl, HF, NH3, NO2. Для абсорбции газов с меньшей растворимостью (SO2, Cl2, H2S) используют щелочные растворы на основе NaOH или Ca(OH)2. Добавки химических реагентов во многих случаях увеличивают эффективность абсорбции благодаря протеканию химических реакций в пленке. Для очистки газов от углеводородов этот метод на практике используют значительно реже, что обусловлено, прежде всего, высокой стоимостью абсорбентов. Общими недостатками абсорбционных методов является образование жидких стоков и громоздкость аппаратурного оформления.
Различают физическую и химическую (хемосорбция) абсорбцию. При физической абсорбции растворение (поглощение) газа (пара) не сопровождается химической реакцией. При хемосорбции абсорбируемый компонент вступает в химическую реакцию в жидкой фазе.
Процесс физической абсорбции сопровождается выделением теплоты, повышением температуры абсорбера и газовой смеси. При повышении температуры возможно снижение растворимости газа в жидкости, поэтому в ряде случаев проводят охлаждение путем размещения в абсорбере охлаждающих поверхностей. Если температура процесса абсорбции не изменяется, то абсорбцию называют изотермической. Если температура повышается (при отсутствии охлаждающих поверхностей), то абсорбцию называют неизотермической.
При повышении температуры поглощение газа жидкостью снижается. На рис.1.1 приведена зависимость растворимости газа в жидкости от температуры и давления. Как видно на рис. 1.1, при повышении парциального давления компонента растворимость газа при всех температурах t1, t2, t3 увеличивается.
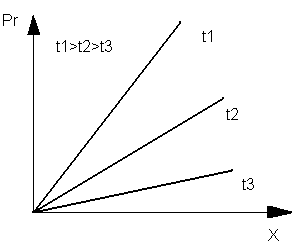
Рис.1.1. График зависимости растворимости газа в жидкости от его парциального давления над раствором при различных температурах: pr-парциальное давление газа; х - концентрация газа в жидкости; t1, t2, t3- температуры процесса.
Скорость физической абсорбции определяется законами диффузии. Скорость физической абсорбции - количество вещества, передаваемое из газовой фазы в жидкую через единицу поверхности SП в единицу времени, - определяется по уравнению (2.8):
![]() ,
(2.8)
,
(2.8)
где Ку - коэффициент массопередачи, зависящий от коэффициентов массоотдачи;
yср - средняя движущая сила, выраженная через концентрации компонента в газовой фазе.
Учитывая, что молярная концентрация вещества в газовой фазе связана с парциальным давлением газа, уравнение имеет вид (2.9):
![]() ,
(2.9)
,
(2.9)
где Kp - коэффициент массопередачи, отнесенный к движущей силе, выраженной через парциальные давления поглощаемого газа;
∆pср - средняя движущая сила процесса, выраженная через парциальные давления.
Хемосорбцию применяют в химической технологии для ускорения процессов абсорбции, а абсорбент в этом случае вступает в химическую реакцию с абсорбируемыми газообразными компонентами. В этом случае скорость хемосорбции определяется двумя факторами: интенсивностью массообмена и скоростью протекания химической реакции. [10]
Примером хемосорбции является процесс поглощения газа SО3 водой с получением серной кислоты. Если реакция протекает в жидкой фазе (SО3 + Н2О → H2S04), то часть газообразного компонента переходит в связанное состояние (H2S04). При этом концентрация свободного, т. е. не связанного с поглощенным газом, компонента в жидкости уменьшается, что приводит к ускорению абсорбции по сравнению с абсорбцией без химической реакции, так как увеличивается движущая сила процесса. В общем случае скорость хемосорбции зависит от скорости реакции, а также скорости массопередачи между фазами. В зависимости от того, скорость какого из этих процессов преобладает, различают кинетическую и диффузионную области протекания хемосорбционных процессов.
В кинетической области скорость химической реакции меньше скорости массопередачи, поэтому общая скорость процесса определяется скоростью химического взаимодействия.
В диффузионной области лимитирующей является скорость диффузии компонентов в зоне реакции, которая зависит от гидродинамики и физических свойств фаз и определяется по общему уравнению массопередачи.
Возможен вариант, когда скорости реакции и массопередачи соизмеримы по величине, тогда процесс абсорбции протекает в смешанной, или диффузионно-кинетической, области.
При расчете требуемой поверхности контакта фаз при хемосорбции процесс ускоряется с увеличением коэффициента массоотдачи в жидкой фазе (2.10):
![]() ,
(2.10)
,
(2.10)
где βx - коэффициент массоотдачи при абсорбции без химической реакции;
ф - фактор ускорения массообмена, показывающий, во сколько раз увеличивается скорость хемосорбции.
Коэффициент ф можно определить по графику в зависимости от величин комплексов γ и N, которые определяют по следующим формулам (2.11) и (2.12):
γ
=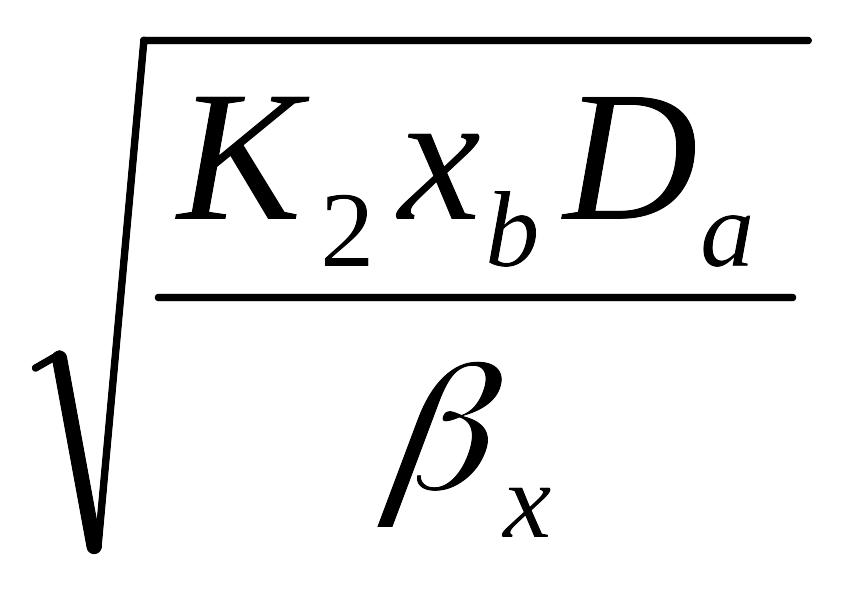 ,
(2.11)
,
(2.11)
где К2 – константа скорости реакции второго порядка, м3/(кмоль с);
xb – концентрация поглотителя b, кмоль/м3;
Da – коэффициент диффузии поглощаемого компонента a в растворе, м2/с;
![]() ,
(2.12)
,
(2.12)
где Db- коэффициент диффузии ионов реагента b (абсорбента) в растворе, м3
/с; x/a- концентрация поглощаемого компонента a на границе раздела фаз, кмоль/м3;
n- стехиометрический коэффициент.
В кинетической и диффузионной области выражение для расчета ф упрощается. Так, в кинетической области при условии, что 5 ≤ γ ≤ 0,5 (1 + N), фактор ускорения ф = γ. В диффузионной области при условии, что γ ≤10 (1 + N), величина ф = 1 + N.
При абсорбции концентрация газа в растворе зависит от природы абсорбента и газа (пара), состава газовой смеси, температуры и давления процесса. В случае растворения газа в жидкости (двухфазная система) по законам фазового равновесия число степеней свободы равно трем. Если температура постоянна, то число переменных равно двум - парциальное давление и состав смеси. Эта зависимость выражена законом Генри.
При повышенных давлениях (порядка тысяч килопаскалей) равновесие между газом и жидкостью не подчиняется закону Генри, так как изменение объема жидкости вследствие растворения в ней газа становится соизмеримым с изменением объема данного газа. При этих условиях константу фазового равновесия можно определить через фугитивность (летучесть) f0 (Па) поглощаемого газа.
2.5. Преимущества и недостатки всех методов. [9]
1) Термические методы.
Преимущества: калорийность обезвреживаемых примесей; возможность предварительного подогрева очищаемых газов; установки дожигания отличаются компактностью и низкими энергозатратами.
Недостатки: эффективно при обезвреживании газов, содержащих токсичные вещества в виде твердых включений органического происхождения (сажа, частицы углерода, древесная пыль и т.д.); образование вторичных загрязнителей, таких как оксиды азота, хлор, SO2 и др.; продукты сжигания газов, содержащих соединения серы, галогенов, фосфора, могут превосходить по токсичности исходный газовый выброс и становится необходима дополнительная очистка; повышение концентрации дожигаемых примесей ведет к значительному снижению расхода топлива, в отдельных случаях процесс может протекать в автотермическом режиме, т. е. рабочий режим поддерживается только за счет тепла реакции глубокого окисления вредных примесей и предварительного подогрева исходной смеси отходящими обезвреженными газами; трудность поиска и изготовления пригодных для длительной эксплуатации и достаточно дешевых катализаторов.
2) Химические методы.
Преимущества: возможность снижать концентрацию оксидов азота в топочном дыме на 40—60 % и совместимость с техническими решениями по улучшению режимов сгорания с целью снижения в топочном газе содержания NОх; можно успешно сочетать с методами совершенствования системы сжигания для снижения количества оксидов азота
Недостатки: необходимо очень точно устанавливать место ввода аммиака в топочный газ, поскольку процесс восстановления NO аммиаком эффективно протекает в узком температурном интервале; строго соблюдать требования к процессу восстановления и зависимость температуры потока от загрузки топлива и его калорийности могут ограничивать мощность сжигающего устройства; выброс в атмосферу аммиака (обычно не выше 50 млн-1) и других побочных продуктов; при сжигании высокосернистых нефтей или углей теплообменник котла может забиваться бисульфатом аммония; стоимость очистки может превысить затраты на, усовершенствование сжигающего устройства; образование и осаждение на стенках технологического оборудования твердого сульфат аммония и расплава бисульфата аммония при выходе из каталитического реактора; необходимость использования дополнительных устройств для очистки потока — блок обессеривания и др.; отсутствие надежной аппаратуры для определения количества аммиака в отходящем газе, чувствительность каталитического процесса к температурному режиму и связанные с этим ограничения в загрузке топлива, замена и дезактивация катализатора удобными с точки зрения охраны окружающей среды методами, надежность устройств очистки и их экономическая целесообразность.
3) Адсорбция.
Преимущества: основными промышленными адсорбентами являются активированные угли, сложные оксиды и импрегнированные сорбенты; способ применяют для очистки отходящих газов химико-фармацевтических и лакокрасочных предприятий, пищевой промышленности и ряда других производств;
Недостатки: невозможность очистки запыленных газовоксидные; адсорбенты (ОА) обладают снижением эффективности в присутствии влаги; после очистки адсорбент не регенерируют, а подвергают, например, захоронению или сжиганию вместе с прочно хемосорбированным загрязнителем; ограниченная емкость адсорбционных фильтров; при несвоевременной замене адсорбента, они сами становятся источником токсичных органических веществ и болезнетворных бактерий, загрязняющих окружающую атмосферу; не эффективен для основных экозагрязнителей городского воздуха; Высокие эксплутационные расходы; при несвоевременной смене фильтров - воздухоочистель становится источником вредных веществ; наиболее эффективна, когда концентрации загрязнителей воздуха или газов относительно невелики и необходимо очищать большие объемы воздуха; необходимость восстановления адсорбента и придания ему исходных свойств.
4) Абсорбция.
Преимущества: высокая степень очистки; широко применяется в практике газоочистки; позволяет улавливать наряду с газами и твердые частицы; отличается простотой оборудования; открывает возможности для утилизации улавливаемых примесей; возможность экономической очистки большого количества газов и осуществления непрерывных технологических процессов;
Недостатки: громоздкость оборудования; метод достаточно капризен в эксплуатации и связан с большими затратами; образование твердых осадков, что затрудняет работу оборудования, и коррозионную активность многих жидких сред; перед очисткой и после ее осуществления сильно понижается температура газов, что приводит в конечном итоге к снижению эффективности рассеивания остаточных газов в атмосфере.
Исходя из данного анализа всех методов, можно сделать вывод, что в нашей ситуации наиболее подходящим будет метод абсорбции. По всем показателям он является наиболее выгонным и целесообразным.
