
- •Лабораторная работа №1
- •Цель и объем работы.
- •Оглавление
- •Зависимость электропроводности раствора н2so4 от концентрации.
- •Вопросы для самопроверки.
- •Основные методические указания для составления отчетов по лабораторным работам
- •Вопросы для самопроверки
- •Оформление отчета.
- •Вопросы для самопроверки.
- •Экспериментальная часть
- •Лабораторная работа №11
- •Экспериментальные и расчетные данные при определении эффективной энергии активации электродного процесса температурно-кинетическим методом
- •Вопросы для самопроверки.
- •Вопросы для самопроверки.
- •Цель работы.
- •Методика работы
- •Лабораторная работа № 9
- •Вопросы для самопроверки.
- •Вопросы для самопроверки.
- •Цель и объем работы
- •Методика работы
Зависимость электропроводности раствора н2so4 от концентрации.
Способ приготовления раствора |
Объем эл-та, мл |
0 |
0,5 |
1,0 |
2,0 |
3,0 |
5,0 |
8,0 |
12 |
17 |
22 |
25 |
Объем H2O, мл |
25 |
24,5 |
24 |
23 |
22 |
20 |
17 |
13 |
8 |
3 |
0 |
|
Сопротивление раствора R, Ом |
|
|
|
|
|
|
|
|
|
|
|
|
Концентрация раствора С, г-экв/л |
|
|
|
|
|
|
|
|
|
|
|
|
Разведение раствора V,мл/г-экв. |
|
|
|
|
|
|
|
|
|
|
|
|
Уд. эл.-провод- ность,χ См.см-1 |
|
|
|
|
|
|
|
|
|
|
|
|
Эквивалентная эл.-пров.λ См.см2.экв-1 |
|
|
|
|
|
|
|
|
|
|
|
|
Построить графические зависимости χ – c (или V) и λ – V.
Литература:
Скорчеллетти В.В. Теоретическая электрохимия. – Л.: Госхимиздат, 1970.
Левин А.И. Теоретические основы электрохимии. – М.: Металлургиздат, 1972.
Антропов Л.И. Теоретическая электрохимия. – М.: Высшая школа, 1985.
Ротинян А.Л., Тихонов К.И., Шошина И.А. Теоретическая электрохимия/ под ред. А.Л. Ротиняна. – Л.: Химия, 1981, 424с.
Методы измерений в электрохимии. Т.2./ под ред. Ю.А. Чизмаджева. – М.: Мир, 1977, 475с.
Вопросы для самопроверки.
Что такое удельная и эквивалентная электропроводности электролита, их размерности и соотношения между собой ?
Почему с повышением температуры увеличиваются удельная и эквивалентная электропроводности электролитов ?
Почему электролитическая постоянная сосуда для измерения электропроводности имеет зависимость от количества залитого электролита ?
Почему нельзя даже с током высокой частоты при измерении электропроводности растворов применять электроды из металлов,
7
анодно активных в данном электролите (например, медных в растворе серной кислоты)?
Можно ли измерить проводимость электролита при прохождении через ячейку постоянного тока?
8
ВЫВОДЫ:
Определена зависимость удельной и эквивалентной электропроводностей раствора H2SO4 от его концентрации при +200С.
Зависимость - С для раствора H2SO4 выражается кривой с максимумом. Наибольшей электропроводностью обладает 6.9 Н раствор H2SO4. С ростом разведения эквивалентная электропроводность раствора постоянно возрастает.
Экспериментальные данные достаточно близко совпадают с табличными значениями электропроводности.
ЛИТЕРАТУРА:
Лабораторный практикум по теоретической электрохимии. Методическое пособие кафедры ТЭП НГТУ, 2001 г.
Антропов Л.И. Теоретическая электрохимия. –М.: Высшая школа, 1975.
Справочник химика. – М-Л.: Химия, т.III, 1964 г.
Некрасов Б.Б. Курс общей химии. ч.I, ГОНТИ, стр. 279, М., 1938 г.
69
Таблица Зависимость электропроводности раствора H2SO4 от концентрации t = +200C, C/ = 10.48 см –1, R1 = 198 Oм, R2 = 202 Oм |
25.0 |
0 |
33.0 1 |
34.0 |
29.4 |
96.7 |
98.7 |
0.107 |
3.15 |
Примечание: в графе “Пошло раствора NaOH” в числителе – объем раствора щелочи, а в знаменателе – объем пробы кислоты. |
22.0 |
3 |
29.1 1 |
30.0 |
33.3 |
100.5 |
102.5 |
0.102 |
3.40 |
||
17.0 |
8 |
22.5 1 |
20.2 |
43.1 |
48.0 |
49.0 |
0.214 |
9.21 |
||
12.0 |
13 |
16.0 1 |
16.5 |
60.6 |
22.6 |
23.1 |
0.453 |
37.5 |
||
8.0 |
17 |
22.6 2 |
11.7 |
85.5 |
16.0 |
16.3 |
0.645 |
55.2 |
||
10.0 |
40 |
13.4 2 |
6.9 |
145 |
14.1 |
14.4 |
0.728 |
105.5 |
||
6.0 |
44 |
19.9 5 |
4.1 |
244 |
17.0 |
17.3 |
0.605 |
148 |
||
4.0 |
46 |
26.4 10 |
2.72 |
368 |
24.8 |
25.3 |
0.415 |
153 |
||
2.0 |
48 |
13.2 10 |
1.36 |
735 |
39.8 |
40.6 |
0.258 |
190 |
||
1.0 |
49 |
6,7 10 |
0.69 |
1450 |
59.6 |
60.8 |
0.159 |
231 |
||
Объем H2SO4, мл |
Объем H2O, мл |
Пошло 1.03Н раствора NaOH при титровании, мл |
Концентрация раствора С, г-экв/л |
Разведение раствора V, мл/г-экв |
Rм, Ом |
Сопротивление раствора Rх, Oм |
Удельная электропроводность , Cм .см –1 |
Эквивалентная электропроводность , Cм.см 2.г-экв-1 |
||
Способ приготовления |
||||||||||
68
Лабораторная работа №2.
Определение чисел переноса по Гитторфу.
Прохождение электрического тока через растворы электролитов обусловлено направленным движением заряженных частиц-ионов. Перенос тока в электролитах осуществляется как катионами, так и анионами, простыми ионами и комплексами, одно- и многозарядными.
Доля тока (электричества), переносимая ионами данного вида, называется числом переноса.
|
(1) |
где Qi – количество электричества, перенесенное данными ионами за какой-то промежуток времени;
Q – общее количество протекшего электричества.
Число переноса какого-то иона будет прежде всего зависеть от его концентрации (при наличии в растворе нескольких электролитов), а также от заряда иона и его подвижности (скорости). В наиболее простом случае, когда раствор содержит один электролит, оба иона которого имеют одинаковый заряд, числа переноса катиона и аниона можно рассчитать по формуле (2):
|
|
(2) |
где Uk и Ua – соответственно скорости катиона и аниона, см2.В-1.сек-1.
Естественно, что |
nk+na=1 |
(3) |
В общем случае |
∑ni=1 |
(4) |
Знание чисел переноса является необходимым в расчетах, относящихся к кинетике электродных процессов. Без знания чисел переноса невозможно провести материальные расчеты электролизеров, работающих с разделением диафрагмой катодного и анодного пространства.
Различают истинные числа переноса и числа переноса по Гитторфу (кажущиеся). Все экспериментальные методы позволяют непосредственно определить только кажущиеся числа переноса, при расчете которых не принимается во внимание различие в переносе воды катионами и анионами. Впрочем, истинные числа переноса сравнительно мало отличаются от кажущихся. В практических расчетах этой разницей можно пренебречь.
Наиболее старым и более распространенным экспериментальным методом для определения кажущихся чисел переноса является
9
метод Гитторфа. Основой его является нахождение изменения концентрации соответствующего электролита в прианодном и прикатодном пространствах электролизера после прохождения через него тока. Этот метод применим в том случае, когда на электродах протекает какой-то один, вполне определенный процесс, т.е. побочные процессы в растворе должны отсутствовать. Необходимо, чтобы диффузионные и конвективные процессы между электродными пространствами были сведены к минимуму. В своем простейшем виде электролизер, применяющийся в методе Гитторфа, представляет собой два сосуда, соединенные между собой сифоном. В каждый из сосудов устанавливается электрод соответствующего вида.
Д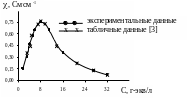 о
проведения опыта составляется электродный
баланс, показывающий изменения состава
раствора в приэлектродных пространствах
в ходе электролиза.
о
проведения опыта составляется электродный
баланс, показывающий изменения состава
раствора в приэлектродных пространствах
в ходе электролиза.
Например, для электролиза раствора H2SO4 с Pt-электродами.
Катодный баланс:
Разряд: 2H++2ē→H2
Перенос: +2nkH+-naSO42
∑-2H+-2ē+H2+2nkH+-naSO42-=-naH2SO4+H2-2ē
А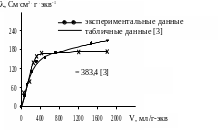 нодный
баланс:
нодный
баланс:
Разряд: H2O-2ē→![]() O2+2H+
O2+2H+
Перенос: -2nkH++naSO42-
∑-H2O+2ē+![]() O2+2H+-2nkH++naSO42-=-H2O+naH2SO4+
O2+2ē
O2+2H+-2nkH++naSO42-=-H2O+naH2SO4+
O2+2ē
Из электродных балансов видно, что при прохождении двух Фарадеев электричества должна наблюдаться: а) в катодном пространстве убыль na г-молей H2SO4 и б) в анодном пространстве прибыль na г-молей H2SO4.
Экспериментальной задачей и будет являться определение изменения концентрации растворов в катодном и анодном сосудах, измерение объема католита (H2SO4) и анолита и определение количества протекшего электричества.
Тогда
|
(5) |
где со, ск - начальная и конечная концентрация католита, г‑экв/л;
со, са - начальная и конечная концентрация анолита, г‑экв/л;
Vо , Vк – объем католита до и после электролиза, л.
Vо , Vа – объем анолита до и после электролиза, л.
Q – количество протекшего электричества в Фарадеях.
10
исследованном разведении (1450 мл/г-экв) величина однако, была еще значительно ниже значения .
Рисунок 3. Зависимость удельной электропроводности
раствора H2SO4 от концентрации.
Рисунок 4. Зависимость эквивалентной электропроводности
раствора H2SO4 от разведения
67
Примеры расчетов.
Расчет концентрации кислоты H2SO4
![]() где
где
![]() -
объем пробы раствора кислоты, СNaOH
и VNaOH
–концентрация и объем титрующей щелочи.
-
объем пробы раствора кислоты, СNaOH
и VNaOH
–концентрация и объем титрующей щелочи.
![]()
Расчет разведения раствора
![]()
Расчет сопротивления раствора
![]()
Расчет удельной электропроводности
![]()
Расчет эквивалентной электропроводности
= . V = 0.159 . 1450 = 231 Cм .см2.г-экв –1
Теоретическое значение эквивалентной электропроводности при бесконечном разведении [3, стр. 711] (при +180С).
![]()
![]()
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Зависимость удельной электропроводности раствора H2SO4 от концентрации выражается кривой с максимумом (рисунок 3). Максимальная электропроводность, равная 0.728 Cм .см –1, отмечена у 6.9 Н раствора H2SO4. Понижение электропроводности с дальнейшим повышением концентрации кислоты может быть объяснено сильным замедлением подвижности ионов вследствие резкого возрастания электростатических сил взаимодействия между ионами. Стабилизация величины при очень больших концентрациях может быть связана с образованием гидратов H2SO4 [4]. Совпадение экспериментальных величин с табличными значениями (рисунок 3) достаточно высокое (различия не более 12%), что указывает на сравнительную точность проведенного эксперимента. Величина с увеличением разведения постоянно повышается (рисунок 4), что связано с понижением в этих условиях влияния электростатических сил взаимодействия между ионами. При предельно
66
Цель и объем работы.
Определить кажущиеся числа переноса методом Гитторфа (вид электролита по заданию преподавателя).
Объем работы слагается из:
Сборки электрической схемы и приготовления раствора;
Пропускания тока через электролизер в течение заданного времени (примерно час);
Определения объема анолита и католита, расчета количества протекшего электричества (по кулонометру);
Анализа исходного раствора, а также католита и анолита;
Составление электродного баланса и расчета полученных чисел переноса;
Сравнение полученных экспериментальных величин с табличными данными.
Методика работы.
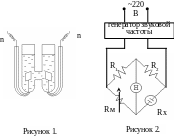
Прибор для определения чисел переноса (рисунок 1) состоит из толстостенных стеклянных сосудов 1 и 2, соединенных сифоном 3. Ток подводится к платиновым электродам 4 и 5. Последовательно в схему включается газовый кулонометр ГК, источник постоянного тока ИПТ, миллиамперметр на 100 мА и ключ К. Схема подключается к источнику тока на 120 вольт.

Рисунок 1.
Сосуды прибора устанавливаются по возможности на одном уровне. В каждый из них заливается по ~50мл. электролита (оставить
11
часть исходного электролита для анализа). Открывается кран 3. Устанавливаются на одном уровне электролит в сосуде и бюретке газового кулонометра. После этого включается ток 50-60мА. После часового электролиза закрывается кран 3 и электролит анодного и катодного пространств сливается в мерные цилиндры. Измеряется объем католита и анолита. Анализируется их состав, а также состав исходного электролита. Записывается объем газа, выделившегося в газовом кулонометре (привести к одному уровню растворы в основном сосуде и бюретке 1). Для приведения газа к нормальным условиям записать окружающую температуру и давление (в расчете учесть давление паров воды над раствором в газовом кулонометре). По объему гремучей смеси, выделившийся в газовом кулонометре, рассчитывается количество электричества, протекшего через электролизер.
По электродному балансу для исследуемого электролита составляется расчетная формула (пример см. выше), по которой уже и производится расчет кажущихся чисел переноса катионов и анионов электролита.
При отсутствии в справочной литературе чисел переноса для данного электролита (для сравнения с экспериментально полученными величинами) производят их расчет по формуле (2), используя скорости ионов при бесконечном разбавлении раствора.
Полученные экспериментальные и расчетные данные приводятся в сводной таблице, пример которой дается ниже.
Таблица.
Числа переноса по Гитторфу.
Р=….. мм.рт.ст. t=…...оС
Конц. р-ров, г-экв/л |
Объем р-ров, мл |
Объем газа в кулоно- метре |
Q, А.ч |
Числа переноса |
||||||
Исходного |
После опыта |
католит |
анолит |
эксперимент |
табличные |
|||||
католит |
анолит |
na |
nк |
na |
nк |
|||||
Требования к форме отчета – общие.
Литература:
Скорчеллетти В.В. Теоретическая электрохимия. – Л.: Госхимиздат, 1970.
Левин А.И. Теоретические основы электрохимии. – М.: Металлургиздат, 1972.
Антропов Л.И. Теоретическая электрохимия. – М.: Высшая школа, 1985.
12
противление Rм, добивались отсутствия тока в индикаторе нуля Н (наибольшего приближения изображения на его экране к прямой линии). При этом
|
(4) |
Первоначально
определяли постоянную сосуда С/
- отношение
![]() .
Для этого сосуд заполняли 0.100 Н KCl,
термостатировали при +250С и измеряли
сопротивление раствора. Компенсация
была осуществлена при Rм=
.
Для этого сосуд заполняли 0.100 Н KCl,
термостатировали при +250С и измеряли
сопротивление раствора. Компенсация
была осуществлена при Rм=![]() .
Rх=
.
Rх=![]() 0.1 Н KCl
при +250С равен 0.01289 Cм
.см –1. Тогда С/= Rх
. KCl
=813. 0.01289=10.48
0.1 Н KCl
при +250С равен 0.01289 Cм
.см –1. Тогда С/= Rх
. KCl
=813. 0.01289=10.48
После этого проведены измерения с растворами H2SO4. Последние готовились смешением концентрированной H2SO4, удельного веса 1.83 г/см3 (92 вес.%) с водой. Определенное количество кислоты вливалось в нужный объем воды. Концентрация полученного раствораопределялась титрованием 1Н раствором NaOH с индикатором метилоранжем. Опыты проводились при +200С в водяном термостате. После окончания измерений с одним раствором сосуд опоражнялся, споласкивался дважды небольшими объемами следующего раствора. В каждом опыте заливалось по 20 мл раствора.
Данные работы сведены в таблицу и показаны на графиках.
65
Лабораторная работа №1
Теоретическая электрохимия
Определение электропроводности электролита
Раствор любого электролита содержит заряженные частицы – ионы, наличие которых и обуславливает электропроводящие свойства таких растворов. Сопротивление электролита может быть рассчитано по обычной формуле закона Ома:
|
(1) |
где
![]() -
расстояние между электродами, см;
-
расстояние между электродами, см;
S – среднее поперечное сечение электролита, см2;
- удельная электропроводность раствора, См .см –1.
Электропроводящие свойства электролитов зачастую характеризуют, кроме удельной электропроводности, также величиной эквивалентной электропроводности . Последняя по своему физическому смыслу представляет электропроводность раствора, в котором растворен 1 г-экв. электролита и который заключен между электродами, расположенными на расстоянии 1 см друг от друга. Объем раствора в мл., в котором растворен 1 г-экв. электролита, носит наименование разведения V.
|
(2) |
где С – концентрация в г-экв/л.
Легко видеть, что
= .V
= 1000. |
(3) |
Цель работы. Определить зависимость удельной и эквивалентной электропроводности раствора серной кислоты от ее концентрации при комнатной температуре.
Экспериментальная часть. Сосуд для измерения электропроводности имеет Н-образную форму и содержит два гладких платиновых электрода (рисунке 1). На этом рисунке Э – электроды; п – токоподводы; Т – термометр.
В работе используем схему мостика Уитстона (рис.2). На рисунке а и в постоянные сопротивления, R1=198 ом, R2=202 ома, Rм – магазин сопротивления, Rх – сосуд для измерения электропроводности, Н – нуль-инструмент (“Индикатор нуля типа ИНО-3м У2-2”).
В работе использовался генератор звуковой частоты типа ГЗ‑35. Во всех опытах применялся ток частотой =1000 герц. Меняя со-
64
Ротинян А.Л., Тихонов К.И., Шошина И.А. Теоретическая электрохимия/ под ред. А.Л. Ротиняна. – Л.: Химия, 1981, 424с.
Методы измерений в электрохимии. Т.2./ под ред. Ю.А.Чизмаджева. – М.: Мир, 1977, 475с.
