
- •Лабораторная работа №1
- •Цель и объем работы.
- •Оглавление
- •Зависимость электропроводности раствора н2so4 от концентрации.
- •Вопросы для самопроверки.
- •Основные методические указания для составления отчетов по лабораторным работам
- •Вопросы для самопроверки
- •Оформление отчета.
- •Вопросы для самопроверки.
- •Экспериментальная часть
- •Лабораторная работа №11
- •Экспериментальные и расчетные данные при определении эффективной энергии активации электродного процесса температурно-кинетическим методом
- •Вопросы для самопроверки.
- •Вопросы для самопроверки.
- •Цель работы.
- •Методика работы
- •Лабораторная работа № 9
- •Вопросы для самопроверки.
- •Вопросы для самопроверки.
- •Цель и объем работы
- •Методика работы
Нижегородский государственный технический
университет
Кафедра “Технология электрохимических
производств”
лабораторный практикум
по теоретической электрохимии
(Методическое руководство)
г. Н. Новгород
2003 г.
УДК 541.13
Лабораторный практикум по теоретической электрохимии: Методическое руководство/ В.Н. Флеров, М.Г. Михаленко, В.В. Бакаев, В.А. Плохов, Ю.Л. Гунько, В.В. Исаев, О.Л.Козина; Нижегород. государ. технич. ин-т. – Н. Новгород; 2005. 72с.
Изложены основы теоретической электрохимии и методов исследования электрохимических систем. Приведены схемы установок и даны рекомендации по выполнению лабораторных работ для студентов специальности 2503 Технология электрохимических процессов.
Ил. 21. Библиогр. – 15 назв.
НГТУ, 2005
Лабораторная работа №1
ОПРЕДЕЛЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ ЭЛЕКТРОЛИТА.
Характерным признаком любого раствора электролита является наличие в нем заряженных частиц – ионов, которые при наложении электрического поля приобретают направленное движение, что и обуславливает электропроводящие свойства таких растворов. Хотя проводимость электролита имеет иной механизм, чем у металлов, обладающих электронной проводимостью, однако, некоторые закономерности будут общими. В частности, сопротивление электролита также подчиняется закону Ома:
![]()
где - удельное сопротивление, Ом.см;
![]() -
расстояние между электродами, см;
-
расстояние между электродами, см;
S – среднее поперечное сечение электролита, см2.
Обратной удельному
сопротивлению величиной будет удельная
электропроводность
![]() =
=![]() .
Ее обычно выражают в См·см-1. В
этом случае численно
будет равна электропроводности раствора
электролита с поперечным сечением 1см2
и расстоянием между электродами (длиной)
1см.
.
Ее обычно выражают в См·см-1. В
этом случае численно
будет равна электропроводности раствора
электролита с поперечным сечением 1см2
и расстоянием между электродами (длиной)
1см.
Для электролитов часто используют еще понятие эквивалентной электропроводности , которая облегчает математическую обработку некоторых закономерностей, присущих электролитам.
Физически величину можно определить, как электропроводность раствора, в котором растворен 1г-экв. вещества и который заключен между электродами, расположенными на расстоянии 1см друг от друга. При этом поверхность каждого из электродов будет численно равна объему раствора в мл., содержащего 1г-экв. вещества. Этот объем носит название разведения V и будет обратно пропорционален концентрации.
![]() где c
– концентрация в г-экв./л.
где c
– концентрация в г-экв./л.
Легко
видеть, что =·V=
1000.![]() См. см2г-экв.-1.
См. см2г-экв.-1.
Характерным отличием электролитов – проводников II-го рода от электронных проводников является наблюдающееся у первых увеличение χ при повышении температуры. Практически зависимо сть χ от
3
температуры имеет линейную зависимость, т.е. может быть выражена уравнением
![]()

где α – температурный коэффициент электропроводности.
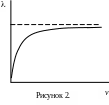
При повышении концентрации электролита наблюдается увеличение χ, однако, у ряда электролитов после некоторой оптимальной концентрации (обычно довольно высокой) может отмечаться иная зависимость (рис.1). Последнее объясняется резким усилением электростатических сил взаимодействия между ионами, что уменьшает их подвижность. Зачастую удобней пользоваться величиной, которая отражает зависимость только одного фактора, в частности λ. Выражая проводящие свойства всех ионов, входящих в состав одного г‑экв., λ будет зависеть только от их подвижности (а для слабых электролитов и от степени диссоциации). Вследствие этого λ с увеличением разведения V асимптотически стремится к величине λ∞ - эквивалентной электропроводности при бесконечном разведении (рис.2).
Цель и объем работы.
О
Объем выполняемой работы слагается из:
Сборки электрической схемы и приготовления исследуемых растворов.
Определение электрической постоянной сосуда.
Измерения сопротивлений исследуемых растворов.
Расчета удельных и эквивалентных электропроводностей и графическое выражение их зависимостей от заданного фактора.
4
Составители: профессор, д.т.н. Флеров В.Н.
профессор, д.т.н. Михаленко М.Г.
доцент , к.х.н. Бакаев В.В.
доцент , к.т.н. Плохов В.А.
доцент , к.т.н. Гунько Ю.Л.
доцент , к.т.н. Исаев В.В.
вед. инженер, к.т.н. Козина О.Л.
Ответственные за выпуск:
профессор, д.т.н. Михаленко М.Г.
доцент , к.т.н. Гунько Ю.Л.
