
- •Введение
- •1. Происхождение атмосферы земли
- •1.1. Основные гипотезы образования и развития атмосферы
- •1.2. Состав ранней атмосферы
- •1.3. Возникновение основных компонентов атмосферы
- •1.4. Вопросы для самоконтроля
- •2. Строение и состав атмосферы
- •2.1. Строение атмосферы
- •2.2. Химические реакции в атмосфере
- •2.3. Состав атмосферы
- •2.4. Вопросы для самоконтроля
- •3. Озоновый слой
- •3.1. Механизм образования озона
- •3.2. Роль озона в различных природных явлениях
- •3.3. Влияние циклов различных газов на образование и разложение озона
- •3.4. Вопросы для самоконтроля
- •4. Загрязнение атмосферы
- •4.1. Классификация атмосферных загрязнений
- •4.2. Аэрозоли
- •4.3. Загрязнение атмосферы автотранспортом
- •Вопросы для самоконтроля
- •Библиографический список
3.3. Влияние циклов различных газов на образование и разложение озона
Выше рассматривался механизм образования озона в атмосфере только на основе кислорода как компонента воздуха. Между тем, в образовании и разрушении озона атмосферы играют существенную роль и другие компоненты воздуха, как основные, так и примесные. Рассмотрение их влияния представляет существенный интерес как с точки зрения более углубленного понимания механизма образования озона в атмосфере, так и с точки зрения влияния антропогенных факторов на концентрацию озона в атмосфере. В этом отношении большую роль играет азот как главная составная часть атмосферы. Известно около пятидесяти фотохимических реакций азота. Верхние слои атмосферы (мезосфера и термосфера) состоят из атомов и ионов азота, образующихся под действием коротковолнового излучения. Образование озона также происходит в верхних слоях атмосферы, начиная с высоты 80 км, где давление еще позволяет образование молекул при тройных столкновениях. Ниже, в стратосфере, где происходит основное образование озона, начинают играть роль оксиды азота, главным образом, в виде оксида азота (II) и оксида азота (IV). В тропосфере их содержание убывает с высотой, вероятно, вследствие взаимодействий с водяным паром, тогда как в стратосфере картина обратная: содержание оксида азота (II) и оксида азота (IV) с высотой возрастает. Согласно экспериментальным данным, на высоте 30 км концентрация оксида азота (II) после восхода солнца возрастает на два порядка. Вообще отношение общего объема окислов азота к общему объему атмосферы изменяется от 10–10 до 10–8. Существует мнение, что разложение озона определяет в основном азотный цикл. В нем разлагается до 80% озона. Укажем лишь на некоторые стадии из этого цикла:
NO2 + O• → NO + O2, (3.15)
NO + O3 → NO2 + O2, (3.16)
NO2 + O3 → NO3 + O2, (3.17)
NO3 + hv → NO + O2. (3.18)
Следует отметить, что оксид азота (II) широко используется как реагент на атомарный кислород:
NO + O• → NO2+ hv. (3.19)
Это одна из немногих реакций, которая протекает с излучением желто-зеленого света. При этом интересно, что в тихом электрическом разряде, в смеси кислорода с оксидами азота (II) и (III) образования озона не происходит, и преимущественно протекают реакции (3.19) и реакция
NO2 + O• → NO + О2. (3.20)
Нельзя, однако, не отметить, что азот может способствовать образованию озона путем своего возбуждения и дальнейшему участию в возбуждении и диссоциации молекул кислорода:
N2* + O2 → N2 + О• +О•. (3.21)
Не исключена также возможность образования на свету (λ < 400 Å) атомарного кислорода из оксида азота (IV):
NO2 + hv → NO + О•. (3.22)
В целом можно констатировать, что роль оксидов азота в разложении озона очень велика, и они могут оказывать весьма существенное влияние на его концентрацию в атмосфере. Из приведенных компонентов атмосферы, влияющих соответствующим образом на образование и разрушение озона, следовало бы остановиться на водяном паре, точнее, на атомарном водороде и радикале гидроксида, образующихся при разложении воды под действием солнечного излучения:
Н2О + hv → Н• + ОН•. (3.23)
Кроме того, вода может реагировать с атомами водорода и кислорода с образованием радикалов ОН•, играющих большую роль в разложении озона:
О• + Н2О → 2ОН•, (3.24)
Н• + Н2О→ Н2 + ОН•. (3.25)
Хотя водяной пар содержится главным образом в тропосфере и его проникновению в стратосферу препятствует тропопауза, являющаяся своеобразной холодной ловушкой для водяного пара, тем не менее, несконденсированные остатки воды проникают из тропосферы в стратосферу. По ориентировочным данным, через тропопаузу проходит ежегодно от 0,5 до 1,2 млрд. т водяного пара, так что объемное отношение водяного пара в стратосфере обычно колеблется от 3·10–6 до 6·10–6.
Таблица 2
Число частиц в 1 см3 атмосферы по расчетным данным [10]
Частицы |
Высота, км |
||
40 |
30 |
20 |
|
О• |
1,5·109 |
1,7·108 |
2,4·106 |
О2 |
1,8·1016 |
8·1016 |
4,1·1017 |
О3 |
4,7·1011 |
3,1·1012 |
2,0·1012 |
ОН• |
1,4·106 |
4,1·105 |
1,1·105 |
НО2• |
2,2·107 |
1,9·107 |
5,3·106 |
Н2 |
1,1·106 |
2,3·105 |
4,4·102 |
Н2О |
6,9·1011 |
2,3·1012 |
8,8·1012 |
Н |
7,8·102 |
1,5·103 |
2,3·104 |
Н2О2 |
1,9·109 |
1,5·109 |
3,6·108 |
Имеются основания считать, что из всех приведенных в табл. 2 частиц, присутствующих в атмосфере, только О•, Н• и ОН• имеют равновесную концентрацию в зависимости от интенсивности солнечного облучения. Тогда, принимая, что образование атомарного водорода происходит только по реакциям (3.23) и
ОH• + О• → Н• + О2, (3.26)
а его исчезновение – по реакциям
Н• + О2 + М• → НО2• + М•, (3.27)
Н• + О3 → ОH• + О2, (3.28)
равновесную концентрацию атомов водорода можно рассчитать, подобно тому как это делалось выше при расчете концентрации атмосферного озона. Для этого составим систему кинетических уравнений
![]() =
k23[Н2О]
IН2О
+k26[OH][O],
(3.29)
=
k23[Н2О]
IН2О
+k26[OH][O],
(3.29)
![]() =
k27[Н][O2][M]+k28[H][O3],
(3.30)
=
k27[Н][O2][M]+k28[H][O3],
(3.30)
и с учетом того, что при равновесии = , получим
 .
(3.31)
.
(3.31)
Оценочные данные показывают, что на высоте 40 км в 1 см3 содержится приблизительно 103 атомов водорода.
Аналогично можно поступить и в случае радикалов ОН•. Считая, что частицы ОН• образуются только по реакциям
НО2• + О→ НО• + О2, (3.32)
НО2• + О3→ НО• + 2О2, (3.33)
а расходуются по реакциям (3.26) и
ОH• + О3 → НО2• + О2, (3.34)
получим
![]() .
(3.35)
.
(3.35)
Оценочные данные показывают, что содержание ОН• в атмосфере равно приблизительно 106 частиц в 1 см3. Судя по удовлетворительному совпадению расчетных данных для О2 и О3 с непосредственно измеренными, можно полагать, что цифры, приведенные в табл. 2, в определенном приближении отражают действительность [10].
Как уже отмечалось, разложение озона определяет в основном азотный цикл, В этом отношении антропогенные факторы поступления оксидов азота в атмосферу играют важную роль в загрязнении атмосферы и отрицательном влиянии на озоновый защитный слой. Один из источников их поступления – ядерный взрыв. Образование оксидов азота при ядерном взрыве происходит за счет быстрого разогрева воздуха примерно до 6000 К и затем быстрого его охлаждения. Считается, что при взрыве мощностью в 1 Мт образуется от 1000 до 12 000 т (т. е. до 2,5∙1032 молекул) оксидов азота. Существенное влияние на образование оксидов в атмосфере оказывают выхлопные газы звуковых и сверхзвуковых самолетов. Вносит свой вклад в загрязнение атмосферы и растущее потребление азотных удобрений, которые под влиянием микроорганизмов генерируют оксид азота (I) (N2O). Наконец, значительное воздействие может оказать и сжигание обычного топлива, коль скоро при температурах порядка 2000…3000 ˚С термодинамическое равновесие сдвигается значительно в сторону образования оксидов азота. За счет ежегодного сжигания топлива на планете образуется до 3 млн. т оксидов азота.
Говоря о влиянии антропогенных факторов на защитный слой озона, нельзя пройти мимо влияния хлора и его окислов, возникающих при фотолизе хлорфторметанов (фреонов). Как известно, фреоны нашли очень широкое практическое применение. Фреоны представляют собой галогенпроизводные метана, этана (С2Н6), пропана (С3Н8) с обязательным содержанием фтора: CF2CI2, CF3Cl, CF4, С2Н4F2, С2Н2F4 и т. д. Они очень хорошо сохраняются в атмосфере, поскольку плохо растворимы в воде и не горят, имеют, как правило, низкие температуры кипения и поэтому на воздухе хорошо испаряются. Из тропосферы часть фреонов может уходить с водой и, не гидролизуясь, скапливаться в океане. Океан является своеобразным резервуаром фреонов. По имеющимся данным, объемное отношение смеси фреонов к незагрязненному воздуху равно примерно 10–16. Фотолиз фреонов, происходящий под действием ультрафиолетового облучения, обусловливает разрыв связи С – С в фреоне и соответственно генерацию активного хлора:
CFCl3 + hv → CFCl2 + Cl•, (3.36)
CF2Cl2 + hv → CF2Cl + Cl•. (3.37)
В свою очередь, Cl• инициирует различные циклы взаимодействия с озоном:
Cl• + O3 → ClO + O2, (3.38)
ClO + O• → Cl + O2, (3.39)
ClО• + O3 → ClO + 2O2, (3.40)
ClО• + O3 → ClO2 + O2, (3.41)
ClО2 + O → ClO + O2. (3.42)
Обрыв цепей в хлорных циклах, по-видимому, происходит за счет реакций:
Cl• + СН4 → НCl + СН3, (3.43)
Cl• + Н2O2 → НCl + НO2•, (3.44)
Cl• + Н2 → НCl + Н•, (3.45)
Cl + НO2• → НCl + O2 . (3.46)
Вклад различных циклов разложения озона (см. рисунок) подтверждает высказанное выше предположение о том, что на озоновый слой влияет главным образом азотный цикл, тогда как галоидный цикл оказывается не столь существенным. Тем не менее, он заслуживает должного внимания. Появление озоновых дыр обеспокоило весь мир, в связи с чем производство фреонов в настоящее время запрещается или сводится к минимуму.
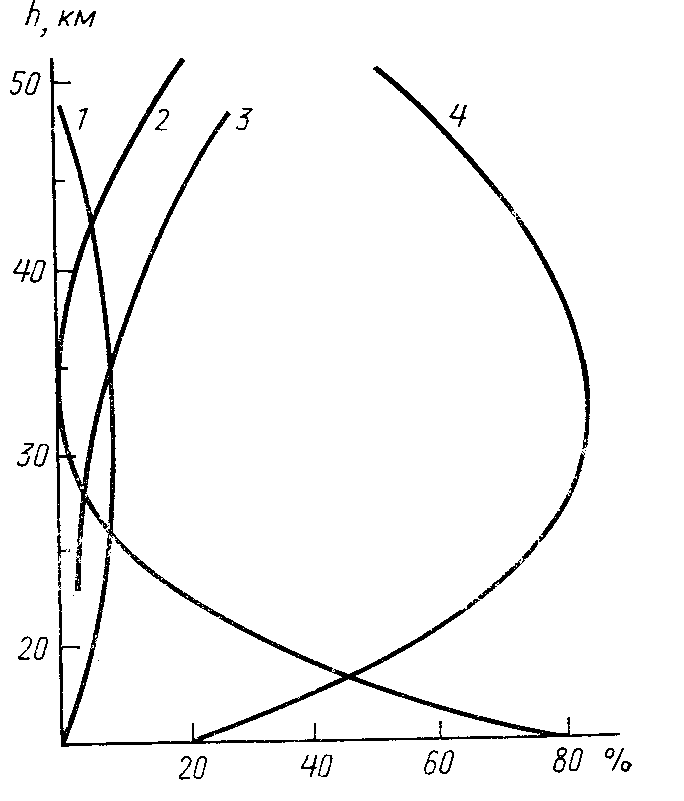
Вклад различных циклов в скорость разложения озона:
1 – галоидный цикл; 2 – водородный цикл;
3 – кислородный цикл; 4 – азотный цикл
Существуют и природные предшественники активного хлора, способные проникать в стратосферу. К ним относится метилхлорид (СН3Cl), который выделяется в больших количествах из воды, выбрасывается вулканами, а также образуется при горении биомассы [11]. В условиях стратосферы метилхлорид разлагается с выделением активного хлора. Его называют «резервуарным газом», поскольку он не реагирует непосредственно с озоном.
Другим резервуарным газом служит гипохлорит нитронила (ClONO2). Он играет важную роль в объяснении феномена образования озоновой дыры над Антарктидой. Суть его заключается в том, что зимой в Южном полушарии происходит постепенное, а вначале весны более быстрое уменьшение общего содержания озона, обычно достигающее в октябре 30…50% от среднегодового. Затем в середине весны общее содержание озона в стратосфере восстанавливается до нормального уровня.
В настоящее время сложилось представление о том, что озоновая дыра возникает вследствие уникальных физико-химических процессов, протекающих в стратосфере Антарктиды [11]. К ним прежде всего относится зимний циркумполярный вихрь, изолирующий атмосферу над Антарктидой от других частей стратосферы. Вследствие этого в зимний период в антарктическую стратосферу не поступает воздух из низких широт, и, следовательно, не восполняется убыль озона внутри вихря.
Другая особенность антарктической стратосферы заключается в аномально низкой зимней температуре (в нижних слоях в ночные часы температура обычно бывает ниже 195 К). В этих условиях образуются так называемые «полярные стратосферные облака». Зимой в экстремально холодной стратосфере резко уменьшается содержание оксидов азота и водяного пара, а стратосферные облака захватывают ледяными кристаллами один из компонентов азотного цикла –азотную кислоту. Действующие вулканы Антарктиды, прежде всего Эребус, пополняют стратосферу хлором. В обедненной оксидами азота атмосфере меньше образуется резервуарного газа ClONO2:
ClO + NO → NO2 + Cl•, (3.47)
ClO + NO2• → ClONO2, (3.48)
стратосфера обогащается частицами ClO, активными по отношению к озону.
Весной циркумполярный вихрь быстро разрушается на сегменты, которые дрейфуют в направлении экватора. В целом температура в стратосфере над Антарктидой резко повышается, полярные стратосферные облака исчезают, высвобождаются компоненты азотного цикла. Приток воздуха из низких широт ликвидирует дефицит озона над континентом.
В разработанной некоторыми группами западных исследователей «химической гипотезе» [11] основная роль в разрушении стратосферного озона над Антарктидой отводится активным формам хлора, образующимся из антропогенных хлорфторуглеродов. Однако в зимней стратосфере внутри вихря фотодеструкция этих устойчивых соединений невозможна.
Таким образом, образование озоновой дыры над Антарктидой, скорее всего, связанно с естественными причинами.
