
- •Введение
- •1. Происхождение атмосферы земли
- •1.1. Основные гипотезы образования и развития атмосферы
- •1.2. Состав ранней атмосферы
- •1.3. Возникновение основных компонентов атмосферы
- •1.4. Вопросы для самоконтроля
- •2. Строение и состав атмосферы
- •2.1. Строение атмосферы
- •2.2. Химические реакции в атмосфере
- •2.3. Состав атмосферы
- •2.4. Вопросы для самоконтроля
- •3. Озоновый слой
- •3.1. Механизм образования озона
- •3.2. Роль озона в различных природных явлениях
- •3.3. Влияние циклов различных газов на образование и разложение озона
- •3.4. Вопросы для самоконтроля
- •4. Загрязнение атмосферы
- •4.1. Классификация атмосферных загрязнений
- •4.2. Аэрозоли
- •4.3. Загрязнение атмосферы автотранспортом
- •Вопросы для самоконтроля
- •Библиографический список
4.3. Загрязнение атмосферы автотранспортом
Наибольшее количество загрязнителей поступают в атмосферный воздух от подвижных энергетических установок, работающих на углеводородном топливе (бензин, керосин, дизельное топливо, мазут, уголь, природный газ и др.). Количество загрязнения определяется составом, объемом сжигаемого топлива и организацией процесса сгорания.
Основными источниками загрязнения атмосферы являются транспортные средства с двигателями внутреннего сгорания. Основные компоненты, выбрасываемые в атмосферу при сжигании различных видов топлива в двигателях всех видов – нетоксичные углекислый газ и водяной пар. Оба этих газа являются парниковыми. Углекислый газ основное вещество, обуславливающее парниковый эффект. Однако кроме них в атмосферу выбрасываются и вредные вещества, такие как оксид углерода (II), оксиды серы, азота, соединения свинца, сажа, углеводороды, в том числе канцерогенный бенз(а)пирен (С20Н12), несгоревшие частицы топлива и т. п.
Так, при работе двигателя на этилированном бензине в выхлопах появляются окислы азота, свинец и его соединения. Количество свинца в воздухе находится в прямой зависимости от интенсивности движения и может достигать 4…12 мг/м3. При работе на серосодержащем топливе в выхлопах появляется также SO2. Как правило, содержание токсичных веществ в выхлопе бензиновых и дизельных двигателей превышает предельно допустимые концентрации в десятки и сотни раз. Тысяча автомобилей с карбюраторным двигателем в день выбрасывает около 3 т угарного газа, 100 кг оксидов азота, 500 кг соединений неполного сгорания бензина [10].
В идеальном случае при сгорании топлива должны получаться только углекислый газ и пары воды, например:
С9Н20 + 14О2 → 9СО2 + 10Н2О. (4.5)
Однако, из-за неполного сгорания (и разного рода добавок) образуются различные химические вещества, например, могут протекать реакции:
С9Н20 + 9,5О2 → 9СО + 10Н2О, (4.6)
С8Н18 +2,5О2 → 4СН3СОН + Н2О, (4.7)
Pb(C2H5)4 + 2CH3CH2Br + 14,5О2 → PbBr2 +12СО2 +15Н2О. (4.8)
В результате фотохимических превращений смеси углеводородов, образующихся при неполном сгорании топлива и оксидов азота, поступивших в воздух в результате автомобильных выбросов, возможно образование фотохимического смога. Смог – это туман с влажностью около 70%. Образующие фотохимический смог вещества значительно превышают по своей токсичности исходные атмосферные загрязнения.
Фотохимический смог сопровождается неприятным запахом, резко снижается видимость, у людей воспаляются глаза, слизистые оболочки носа и горла, возникает удушье, обостряются легочные заболевания, бронхиальная астма. Фотохимический смог повреждает и растения. Сначала на листьях появляется водянистое набухание, через некоторое время нижние поверхности листьев приобретают серебристый или бронзовый оттенок, а верхние становятся пятнистыми с белым налетом. Затем наступает быстрое увядание растения.
Фотохимический смог вызывает коррозию металлов, растрескивание красок, резиновых изделий, портит одежду, нарушает работу транспорта.
Как говорилось выше, основной причиной фотохимического смога являются отработанные газы. В утренние часы «пик» в воздухе накапливается достаточно большое их количество, и к полудню образуется фотохимический туман. Во второй половине дня под действием усиливающего нагрева инверсия ослабевает, смог поднимается вверх
Рассмотрим реакции, приводящие к образованию фотохимического смога, более подробно [8]. Многие виды топлива содержат связанный азот. В реакционной зоне пламени могут происходить превращения по схеме

Образовавшийся молекулярный азот может вступать в реакцию взаимодействия с кислородом, сопровождающуюся образованием оксида азота (II):
N2 + O2 → 2NO. (4.10)
На каждом километре пути легковой автомобиль выделяет около 10 г оксида азота (II). Оксид азота (II) может окисляться до оксида азота (IV):
2NО + O2 → 2NO2, (4.11)
который под действием солнечного излучения расщепляется с образованием атомарного кислорода:
NО2 → NO + O•. (4.12)
Атомарный кислород, взаимодействуя с кислородом воздуха, образует молекулу озона:
O• + О2 → O3. (4.13)
Молекулы озона могут взаимодействовать с оксидом азота (II):
O3 + NО → NO2 + O2. (4.14)
Далее вновь протекает реакция (4.12), т. е. возникают циклические реакции, в итоге в атмосфере образуется избыток озона. Озон вступает в реакции с непредельными углеводородами, и образуются продукты окисления (оксиданты), представляющие собой органические пероксидные соединения, – характерные составляющие фотохимического смога. При этом протекают следующие реакции:

В настоящее время во многих крупных городах мира – Нью-Йорке, Чикаго, Бостоне, Дейтройте, Токио, Милане – образуется фотохимический смог [12, 13]. В городах России подобных явлений не наблюдалось, однако условия для их появления могут возникнуть.
Для снижения вредных выбросов в выхлопных трактах автомобилей устанавливают нейтрализаторы. В США нейтрализаторы снизили суммарный выброс токсичных веществ автотранспортом с 76 млн. т в 1997 году до 55 млн. т в 2002 году [13].
Испытания семейства каталитических нейтрализаторов, разрабатываемых в нашей стране, показали, что они снижают уровень содержания угарного газа в выхлопах на 80%, углеводородов – на 70%, оксида азота (II) – на 50%. В целом токсичность выброса уменьшается в 10 раз.
В двухступенчатых каталитических нейтрализаторах отработавшие газы проходят последовательно через два слоя катализаторов [8]. Сначала через пористые восстановители (восстановительный катализатор), в качестве которых используются сплав меди и никеля, при этом происходит восстановление оксида азота (II):
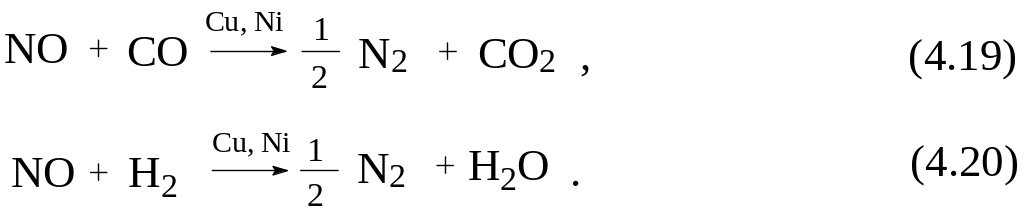 Затем
на другом катализаторе (окислительный
катализатор) в окислительной среде, для
создания которой в нейтрализатор
дополнительно вводится воздух, происходит
окисление таких продуктов неполного
сгорания, как угарный газ и углеводороды:
Затем
на другом катализаторе (окислительный
катализатор) в окислительной среде, для
создания которой в нейтрализатор
дополнительно вводится воздух, происходит
окисление таких продуктов неполного
сгорания, как угарный газ и углеводороды:

Платина является наилучшим окислительным катализатором, но этот дорогой и дефицитный материал не может применяться широко. Предпринятые поиски более дешевых и доступных катализаторов показали, что платину можно заменить палладием (Pd), рутением (Ru), а также оксидом меди (II) (CuO), оксидом хрома (II) (CrO), оксидом никеля (II) (NiO), оксидом марганца (IV) (MnO2), а в нейтрализаторах российского производства используется оксид алюминия (Al2O3) [12].
